葡萄籽原花青素对睡眠呼吸暂停低氧大鼠海马区超微结构及认知功能的影响①
2014-05-25赵雅宁刘文倩曹书华郭霞王红阳
赵雅宁,刘文倩,曹书华,郭霞,王红阳
葡萄籽原花青素对睡眠呼吸暂停低氧大鼠海马区超微结构及认知功能的影响①
赵雅宁1,2,3,刘文倩2,曹书华3,郭霞2,王红阳2
目的 探讨葡萄籽原花青素(GSPE)对睡眠呼吸暂停低氧大鼠海马区超微结构及认知功能的影响。方法80只雄性Sprague-Dawley大鼠随机分成对照组,模型组,GSPE高、低剂量组。对照组暴露于空气中,模型组每天暴露于低氧条件下(50 ml/ L)8 h,持续时间2周和6周,GSPE高、低剂量组入舱前2周开始每天分别灌胃给药GSPE 200 mg/kg、100 mg/kg。电镜观察海马区神经细胞超微结构,比色法检测大脑组织丙二醛(MDA)水平和超氧化物歧化酶(SOD)水平,TUNEL法检测凋亡细胞,水迷宫测试动物学习记忆功能。结果模型组海马区超微结构损伤,MDA含量显著升高、SOD活性显著降低、TUNEL阳性细胞显著增多,水迷宫检测动物逃避潜伏期时间显著延长、穿台次数显著减少(P<0.001);与模型组比较,GSPE各组海马区损伤减轻,MDA含量降低,SOD活性提高,TUNEL阳性细胞减少,水迷宫测试逃避潜伏期时间缩短、穿台次数增多(P<0.05);高剂量组优于低剂量组(P<0.05)。结论葡萄籽原花青素减轻睡眠呼吸暂停模式低氧大鼠海马区超微结构的损伤,改善认知功能。
睡眠呼吸暂停;学习;记忆;海马;丙二醛;超氧化物歧化酶;凋亡;大鼠
[本文著录格式]赵雅宁,刘文倩,曹书华,等.葡萄籽原花青素对睡眠呼吸暂停低氧大鼠海马区超微结构及认知功能的影响[J].中国康复理论与实践,2014,20(3):236-239.
阻塞性睡眠呼吸暂停患者睡眠时反复出现低氧血症和/或高碳酸血症,可造成大脑皮质灰质丢失,海马区实质萎缩等,出现认知障碍[1]。葡萄籽原花青素(grape seed proanthocyanidin extract,GSPE)是从葡萄籽中提取的生物黄酮物质。研究表明,GSPE具有极强的抗氧化和清除自由基作用,且具有调节血脂、降低血糖、稳定血压、保护心脑血管、抗肿瘤等作用[2-5]。本研究模拟临床呼吸暂停事件,建立睡眠呼吸暂停间歇性低氧大鼠模型,探讨葡萄籽原花青素对睡眠呼吸暂停低氧大鼠海马区超微结构的损伤及认知功能的影响。
1 材料与方法
1.1 材料
雄性Sprague-Dawley大鼠80只:北京维通利华公司,合格证号SCXK(京)2002-003,体重310~350 g。TUNEL试剂盒:北京中杉生物有限公司。H-7650透射电镜:日本日立公司。脂质氧化物丙二醛(MDA)和超氧化物歧化酶(SOD)检测试剂盒:南京建成科技公司。测氧仪:建德市梅城电化分析仪器厂。低氧控制程序:天津医科大学总医院呼吸科。纯氮:天津六方气体高科技有限公司。低氧舱:天津医科大学研制。
1.2 动物分组和模型制备
大鼠分成对照组(n=20)、模型组(n=20)、高剂量GSPE组(n=20)、低剂量GSPE组(n=20)。模型组和GSPE各组每天8:00~16:00置于低氧舱内,向舱内循环充入氮气和空气,每次循环2 min,连续给予氮气30 s,维持舱内氧浓度最低至5%(50 ml/L),随后复氧至氧浓度21%(210 ml/L)。对照组持续充入压缩空气。用数字测氧仪监测舱内氧浓度变化,使舱内氧浓度维持在预定的氧浓度内(±0.5%);每天实验8 h,持续2或6周。GSPE组在动物进入低氧舱前2周开始每天GSPE灌胃1次,持续8周。剂量:高GSPE组200 mg/kg,低GSPE组100 mg/kg。分别在实验第2周和第6周进行检测。
1.3 电镜观察
常规麻醉动物,开胸暴露心脏,应用混合固定液(2.5%戊二醛+2%多聚甲醛的磷酸缓冲液)心脏灌流,断头取脑,取大脑海马组织,切成1×1×1 mm组织块,40 ml/L戊二醛固定,0.1 mol/L二甲砷酸缓冲液冲洗,共2次;40 ml/L四氧化锇固定,缓冲液冲洗2次。逐级丙酮脱水,环氧树脂浸透,包埋,超薄切片,醋酸铀枸橼酸铅双重染色,透射电镜80 kV下观察并摄片。
1.4 MDA、SOD检测
大脑海马组织用冰冷的生理盐水漂洗,除去血液,滤纸拭干,称取组织重量,加9倍量匀浆液匀浆器匀浆(冰水浴中进行),制成10%匀浆液,3500 r/min离心10 min,取上清液。考马斯亮蓝显色法测定脑组织蛋白含量。分光光度计测MDA和SOD吸光度。
1.5 细胞凋亡检测
大鼠脑组织标本多聚甲醛固定。脱水、透明、浸蜡、包埋、切片,按TUNEL检测试剂盒进行操作,DAB显色,苏木精复染。每个标本取4张切片,200×光镜下每张切片在海马区随机选取5个视野,计数阳性细胞数,取均值。
1.6 学习记忆功能检测
采用Morris水迷宫[6]进行检测。每只动物晨起训练5次后分别在上午、下午各测试6次,分别记录各组大鼠逃避潜伏期及撤去平台后动物穿越原平台位置的次数,取均值。
1.7 统计学分析
应用SPSS 17.0统计软件进行数据处理。数据以(±s)表示,进行单因素方差分析。显著性水平α= 0.05。
2 结果
2.1 电镜观察
对照组大鼠海马神经元细胞核规则,核仁清晰,核质均匀散在,核膜光滑,边缘清晰,神经元内细胞器,包括高尔基体、粗面内质网、多聚核糖体、线粒体、溶酶体等丰富,结构正常;突触结构完整清晰。模型组低氧2周时,神经细胞超微结构变化不明显,细胞器数量丰富,结构较完整;低氧6周可见细胞核染色质边集,线粒体数量、糖原颗粒数量明显减少,细胞器消失,突触小泡不能辨认。GSPE组脑组织超微结构损伤明显减轻,突触仍能分辨出且数量较多;高剂量GSPE组海马超微结构损伤减轻程度最为显著。见图1和图2。
2.2 MDA和SOD
与对照组比较,模型组海马区MDA含量增高,SOD活性下降;随低氧时间延长,MDA含量进一步增高,SOD活性进一步下降。与模型组比较,GSPE组MDA含量降低,SOD活性提高,以高剂量GSPE组更为显著。见表1。
2.3 神经细胞凋亡
与对照组比较,模型组海马区神经细胞凋亡数量增加,且随低氧时间的延长,神经细胞凋亡数量基进一步升高;与模型组比较,GSPE组可有效降低凋亡神经细胞数量,且在高剂量GSPE组变化更为显著。见表1。
2.4 水迷宫测试
与对照组相比,模型组逃避潜伏期延长,穿越平台位置次数减少;与模型组比较,GSPE组逃避潜伏 期缩短,穿越原平台位置次数增加(P<0.05)。见表1。

图1 各组大鼠海马区神经元形态变化(透射电镜,20,000×)
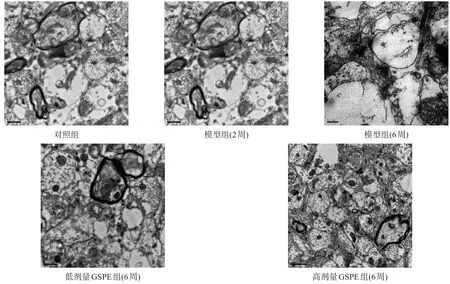
图2 各组大鼠海马区突触形态变化(透射电镜,20,000×)

表1 各组测评指标比较
3 讨论
睡眠呼吸暂停综合征患者认知功能障碍主要表现为注意、集中、记忆和复杂问题解决能力等受损。水迷宫中逃避潜伏期反映大鼠有效获取有效学习能力,而检测穿越原平台位置次数反映记忆的保持能力。结果显示,GSPE可改善睡眠呼吸暂停低氧导致的学习记忆损伤。
睡眠呼吸暂停综合征引起的间歇性低氧使脑组织因氧耗竭而导致氧自由基转化代谢异常,产生大量氧自由基,超出细胞内抗氧化防御体系,如SOD及谷胱甘肽过氧化物酶(GSH)等的防御清除能力[7-8]。而低氧环境可引起离体海马突触长时间阻滞,对突触可塑性产生影响,导致细胞功能丧失[9];此外长期间歇性低氧类似于缺血再灌注损伤,可导致神经细胞凋亡[10]。
GSPE抗氧化能力是维生素E的50倍、维生素C的20倍,与SOD相当[11]。谭毓治等报道,GSPE能改善D-半乳糖所致衰老小鼠的学习记忆能力,增强正常小鼠信息的保持和再现能力,与其能降低血液和脑组织中过氧化脂质有关[12]。本研究应用GSPE预处理动物,对睡眠呼吸暂停低氧大鼠海马区超微结构及认知功能有良好的改善作用。
GSPE具有多种药理活性。其改善睡眠呼吸暂停综合征引起的神经损伤的其他机制有待进一步探讨。
[1]郑庆,杨宇.阻塞性睡眠呼吸暂停综合征与认知功能障碍及痴呆[J].中国老年学杂志,2008,28(12):2392-2393.
[2]吴秀香,张妍,孙柳青,等.葡萄籽原花青素对肾血管性高血压大鼠血管重塑的影响[J].中国病理生理杂志,2012,28(6): 1023-1027.
[3]Cui XP,Li BY,Gac HQ,et al.Effects of grape seed proanthocyanidin extracts on peripheral nerves in streptozocin-induced diabetic rats[J].Nutr Sci Vitaminol(Tokyo),2008,54(4):321-328.
[4]Hsu CP,Lin YH,Chou CC,et al.Mechanisms of grape seed procyanidin-induced apoptosis in colorectal carcinoma cells[J].Anticancer Res,2009,29(1):283-289.
[5]Feng Y,Liu YM,Leblanc MH,et al.Grape seed extract given three hours after injury suppresses lipid peroxidation and reduces hypoxicischemic brain injury in neonatal rats[J].Pediatr Res,2007,61(3):295-300.
[6]Smith DH,Okiyama K,Thomas MJ,et al.Evaluation of memory dysfunction following experimental brain injury using the Morris water maze[J].Neurotrauma,1991,8(4):259-269.
[7]Suzuki YJ,Jain V,Park AM,et al.Oxidative stress and oxidant signaling in obstructive sleep apnea and associated cardiovascular diseases[J].Free Radic Biol Med,2006,40(10):1683-1692.
[8]Shan X,Chi L,Ke Y,et al.Manganese superoxide dismutase protects mouse cortical neurons from chronic intermittent hypoxia-mediated oxidative damage[J].Neurobiol Dis,2007,28 (2):206-215.
[9]Kim JJ,Soog EY,Kosten TA.Stress effect in the hippocampus: synaptic,plasticity and memory[J].Stress,2006,9(1):1-1l.
[10]Calabrese V,Lodi R,Tonon C,et al.Oxidative stress,mitochondrial dysfunction and cellular stress response in Friedreich's ataxia[J].Neurol Sci,2005,233(1-2):145-162.
[11]王红阳,韩晓庆,张盼盼,等.重度间歇低氧大鼠学习记忆功能与氧化应激的关系[J].中华结核和呼吸杂志,2012,35(1):34-36.
[12]谭毓治,万晓霞,赖娟娟,等.葡萄籽原花青素对学习记忆的影响[J].中国药理通学报,2004,4(7):804-807.
Effect of Grape Seed Proanthocyanidin Extract on Ultrastructure Injury in Hippocampous and Cognition Impairment in Rats of Obstructive Sleep Apnea Hypoxia
ZHAO Ya-ning,LIU Wen-qian,CAO Shu-hua,et al.Tianjin University of Traditional Chinese Medicine,Tianjin 300000,China
ObjectiveTo investigate the effect of grape seed proanthocyanidin extract(GSPE)on ultrastructure injury in hippocampous and cognition impairment in rat model of obstructive sleep apnea hypoxia.Methods80 male Sprague-Dawley rats were randomly divided into control group,model group,high and low dose GSPE groups.The control group was exposed in air,while the model group was suffered from intermittent hypoxia conditions(50 ml/L,8 h everyday,for 2 or 6 weeks),and the GSPE groups accepted GSPE 200 mg/kg or 100 mg/ kg 2 weeks respectively before hypoxia.Pathology in hippocampal region was observed under electromicroscope.Malondialdehyde(MDA) contents and superoxide dismutase(SOD)activity were detected with colorimetry,and apoptotic cells were measured with TUNEL.The cognition function of rats was assessed with the Morris water maze(MWM).ResultsThe ultrastructure in hippocampous was significantly injured,with the increase of MDA and decrease of SOD(P<0.001)in the model group.The apoptotic cells increased(P<0.001).The escaping latency prolonged(P<0.001)and the frequency of crossing the platform decreased(P<0.001)in MWM test in the model group.Compared with the model group,the GSPE groups decreased in MDA content,increased in SOD level,decreased in apoptotic cells and ultrastructure damages,shortened the escaping latency,and increased the frequency of crossing the platform(P<0.001),especially in the high dose group (P<0.05).ConclusionGSPE can relieve the damage of ultrastructure and improve cognition function after obstructive sleep apnea hypoxia in rats.
sleep apnea;learning;memory;hippocampus;malondialdehyde;superoxide dismutase;apoptosis;rats
R742
A
1006-9771(2014)03-0236-04
2013-05-23
2013-07-23)
河北省教育厅重点资助项目(No.ZH2012046)。
1.天津中医药大学,天津市300000;2.河北联合大学康复医学院,河北唐山市063000;3.天津市第一中心医院,天津市300000。作者简介:赵雅宁(1974-),女,河北唐山市人,博士,副教授,主要研究方向:脑损伤与脑保护。通讯作者:曹书华。
10.3969/j.issn.1006-9771.2014.03.010
