低频电针对脊神经结扎大鼠痛敏化的干预作用①
2014-05-25蒋永亮尹小虎沈亚芳赵晓芸何晓芬方剑乔
蒋永亮,尹小虎,沈亚芳,赵晓芸,何晓芬,方剑乔
低频电针对脊神经结扎大鼠痛敏化的干预作用①
蒋永亮,尹小虎,沈亚芳,赵晓芸,何晓芬,方剑乔
目的 观察低频电针对脊神经结扎神经病理痛大鼠模型痛敏化的干预作用,探讨其可能的外周痛敏化调节机制。方法建立大鼠L5脊神经结扎模型,电针足三里和昆仑穴,观察大鼠痛觉超敏反应,运用Western blotting法检测L4、L5背根神经节(DRG)辣椒素受体(TRPV1)与P物质(SP)水平,采用TRPV1激动剂6'-IRTX进行验证。结果脊神经结扎大鼠出现明显的痛敏化反应,术侧L4DRG TRPV1和L5DRG SP水平升高(P<0.05);低频电针能减轻模型大鼠的痛敏反应,抑制TRPV1、SP水平上升(P<0.05)。6'-IRTX腹腔注射能拮抗低频电针的抗痛敏化作用。结论低频电针可减轻痛敏化,发挥对神经病理痛的治疗作用,其机制可能与其有效调控DRG TRPV1和SP有关。
神经病理痛;电针;背根神经节;辣椒素受体;P物质
[本文著录格式]蒋永亮,尹小虎,沈亚芳,等.低频电针对脊神经结扎大鼠痛敏化的干预作用[J].中国康复理论与实践, 2014,20(3):211-214.
神经病理痛是由躯体感觉神经系统损伤或病变直接引起的疼痛综合征,主要表现为自发性疼痛、痛觉过敏、痛觉超敏,临床上常见、多发、难治,如脊髓、外周神经损伤所致神经痛,脑卒中后遗痛,疱疹后遗痛等,是疼痛医学与康复医学领域的棘手问题[1-2]。药物治疗神经病理痛存在疗效不佳、治疗缺乏针对性、毒副作用大等问题,探寻疗效好、副作用少的非药物疗法是当前神经病理痛治疗与康复的一个重要方向[3]。
大量基础与临床研究表明,针灸对慢性疼痛具有良好的疗效,针刺治疗慢性炎性痛的抗炎镇痛机制和中枢阿片机制业已清楚,极大地促进了世界范围内针刺治疗炎性痛的应用[4]。有研究表明,电针对神经病理痛也有治疗作用,且低频电针的疗效好于高频电针[5]。这种作用不被纳洛酮阻断[6],表明电针干预神经病理痛存在非阿片机制。
痛觉敏化的外周机制,即初级痛觉神经元的超兴奋性,是神经病理痛的一个重要机制,涉及多种离子通道、受体、神经递质在背根神经节(dorsal root ganglion,DRG)神经元上的变化[7]。辣椒素受体(transientreceptor potential vanilloid type 1,TRPV1)与疼痛信号的产生、传递与调节密切相关,DRG神经元TRPV1在神经病理痛痛敏化中起着重要作用。P物质(substance P,SP)是一种重要的神经肽,释放后能进一步促进痛觉敏化[8]。
本研究建立L5脊神经结扎(spinal nerve ligation, SNL)神经病理痛大鼠模型,观察低频电针对痛觉超敏反应、DRG TRPV1与SP表达水平的影响。进一步行TRPV1激动剂6'-IRTX对低频电针作用的影响的验证性实验,以明确低频电针治疗神经病理痛是否存在抑制痛敏化的过程,是否与有效干预DRG TRPV1和SP有关。
1 材料和方法
1.1 实验动物
选用健康雄性SD大鼠32只,体重(200±10)g,购于中国科学院上海实验动物中心[SCXK(沪)2008-0016],由浙江中医药大学实验动物中心饲养。
1.2 主要试剂与药物
华佗牌无菌针灸针0.25×13 mm:苏州医疗用品厂有限公司;韩氏穴位神经刺激仪:北京华卫产业开发公司;动态足底测量仪:意大利UGO BASILE公司;凝胶成像仪:日本FUJI FILM公司;美国绵羊多克隆抗体TRPV1抗体:美国ABCAM公司;山羊多克隆抗体Substance P抗体:美国SANTA CRUZ公司;小鼠单克隆抗体β-actin抗体:上海康成生物工程有限公司;RIPA裂解液、BCA蛋白浓度测定试剂盒(增强型)、超敏ECL化学发光试剂盒:碧云天公司;蛋白酶抑制剂Cocktail:生工生物工程(上海)股份有限公司;TRPV1激动剂6'-IRTX:美国SIGMA公司。
1.3 实验方法
1.3.1 分组与造模 将大鼠随机分为正常组、假手术组、模型组、电针组,每组8只。
按照Kim和Chung[9]的方法建立L5SNL神经病理痛大鼠模型。大鼠称重后,用10%水合氯醛3.5 ml/kg腹腔麻醉。大鼠俯卧位放置在手术台上,腰部去毛,备皮。在脊柱右侧旁开0.5 cm处,沿L3~S2垂直切开背部皮肤,钝性分离右侧椎旁肌肉,暴露L4~S2横突。用小咬骨钳小心咬除L5横突,暴露、分离L5脊神经,用6/0丝线紧紧结扎。逐层缝合切口,并在术侧(右侧)大腿注射青霉素预防感染。假手术组操作与手术组相同,但不结扎神经。
1.3.2 治疗方法 造模后第3天开始治疗。电针组取患侧足三里(ST36)、昆仑穴(BL60),定位参照华兴邦大鼠穴位图谱。将大鼠固定在特制的布套里,双后肢、尾巴暴露在外。扎入不锈钢针灸针,用韩氏穴位神经刺激仪给予电刺激,治疗参数:频率2 Hz,强度1 mA 15 min,2 mA 15 min,共30 min。隔日1次,共7次。正常组、模型组、假手术组大鼠不做治疗,给予与电针组相同固定。
1.4 痛觉超敏反应检测
采用动态足底测量仪检测大鼠术侧后足缩腿阈(paw withdrawal threshold,PWT)。将大鼠置铁丝网上11.5×17×14 cm透明塑料盒内30 min适应环境。待大鼠安静后(停止梳理毛发和探索性活动),将连在机械泵上类Von Frey丝的金属丝(直径0.5 mm)置于大鼠后足中央,避开足垫;启动机械泵,金属丝以恒定速度自动上台,对大鼠足底施加机械刺激。刺激强度从0开始以2.5 g/s递增,直至大鼠产生缩腿反应;最大刺激强度50 g。连续测量3次,取平均值,每次间隔5 min。分别于造模前(基础痛阈)和造模后第1天、造模后第3天、造模后第15天4个时间点测量。
1.5 Western blotting检测
于造模后第15天将大鼠用10%水合氯醛3.5 ml/kg腹腔麻醉,小心剪开胸腔,暴露心脏。剪开右心室,经左心室灌注生理盐水。大鼠处死后,冰上立即取出术侧L4-5DRG,迅速放入-80℃冰箱保存。DRG放入2 ml EP管中称重,加入预冷的裂解液RIPA 100 μl/10 mg新鲜组织、蛋白酶抑制剂Cocktail 1 μl/100 μl RIPA。冰上充分超声粉碎。4℃冰箱静置30 min,低温10000 r/min离心10 min,取上清液测定蛋白浓度,计算上样量为30 μg所需的总蛋白量。总蛋白与2倍上样缓冲液等比例稀释,100℃水浴变性10 min。
TRPV1用8%SDS-PAGE分离胶,SP采用15% SDS-PAGE分离胶;浓缩胶用5%SDS-PAGE。电泳:浓缩胶电压80 V,30 min;分离胶电压120 V,90 min,分离蛋白。电泳后分别用0.45 μm和0.22 μm PVDF膜进行转膜;条带在5%脱脂奶粉中封闭2 h;分别用绵羊多克隆抗TRPV1抗体(1∶2000)、山羊多克隆抗SP抗体(1∶500)和小鼠单克隆抗β-actin抗体(1∶10000),4℃冰箱孵育过夜。TBST缓冲液洗涤3次,每次10 min。所得的印迹室温下与相应的辣根过氧化物酶(HRP)结合的二抗孵育2 h,TBST缓冲液洗涤3次,每次10 min;用ECL显色液反应1 min,滤去显色液,凝胶成像仪拍片。Image Quant TL软件对蛋白条带进行灰度分析。
1.6 6 '-IRTX验证实验
大鼠随机分为低频电针+生理盐水组和低频电针+ 6'-IRTX组,每组8只。造模、低频电针治疗方法同前。低频电针+生理盐水组与低频电针+6'-IRTX组在造模后第15天电针干预前分别腹腔注射生理盐水1 ml和6'-IRTX 0.001 mg/kg(95%乙醇稀释,用生理盐水补足到1 ml)。分别于造模前(基础痛阈)和造模后第1天、造模后第3天、造模后第15天4个时间点测量PWT。
1.7 统计学分析
采用SPSS 17.0统计学软件进行分析,数据用(±s)表示,多组间比较采用单因素方差分析(oneway ANOVA),组间两两比较采用post hoc LSD检验。6'-IRTX验证实验采用t检验。显著性水平α=0.05。
2 结果
2.1 PWT
各组大鼠造模前PWT无显著性差异(P>0.05)。造模后第1天,模型组大鼠出现抬脚、舔足等自发性疼痛与痛觉超敏现象,PWT显著低于正常组和假手术组(P<0.001),一直持续到造模后第15天。假手术组与正常组PWT无显著性差异(P>0.05)。电针组造模后第15天PWT显著高于模型组(P<0.001)。见表1。
2.2 TRPV1
造模后第15天,模型组大鼠术侧L5DRG TRPV1水平明显低于正常组(P<0.01),而L4DRG TRPV1升高(P<0.05);与模型组比较,电针组L4DRG TRPV1水平显著下降(P<0.001),L5DRG TRPV1水平无显著性差异(P>0.05)。见图1。
2.3 SP
造模后第15天,模型组大鼠术侧L5DRG SP水平高于正常组(P<0.05),L4DRG SP水平无显著性差异(P>0.05);与模型组比较,电针组L5DRG SP水平显著下降(P<0.001),L4DRG SP水平无显著性差异(P>0.05)。见图2。
2.4 6 '-IRTX对低频电针抗痛敏化作用的影响
造模后第15天,低频电针+6'-IRTX组PWT显著低于低频电针+生理盐水组(P<0.001)。见表2。
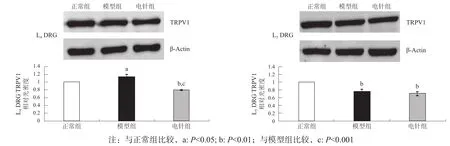
图1 造模后第15天各组DRG TRPV1水平比较
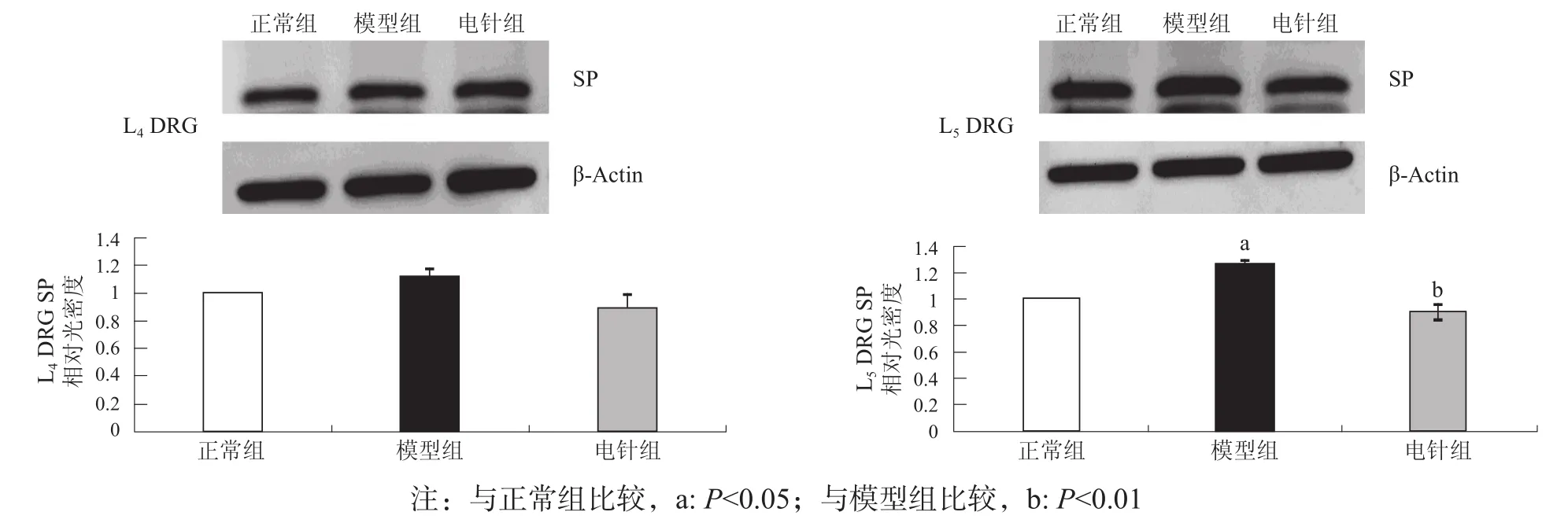
图2 造模后第15天各组DRG SP水平比较
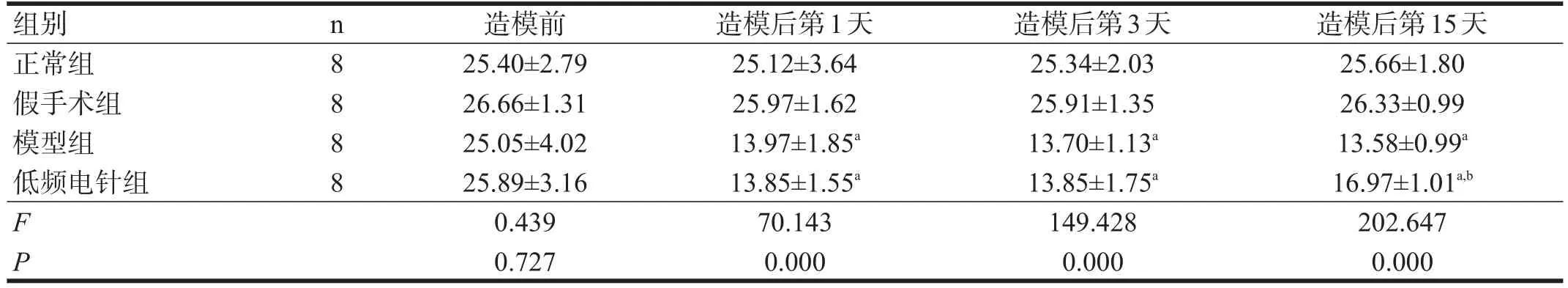
表1 各组各时间点PWT比较(g)
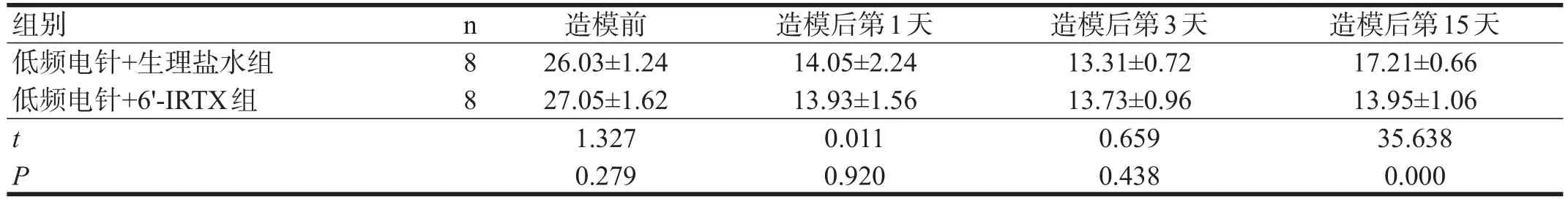
表2 验证实验各组各时间点PWT比较(g)
3 讨论
TRPV1是TRPs超家族中与炎性痛和神经病理痛均密切相关的成员[10],在外周主要分布于较细的DRG神经元、C纤维和Aδ纤维[11-12],与痛敏化相关[13]。在SNL损伤的DRG神经元中,TRPV1上调,与SNL诱导的神经病理痛有关[14]。本研究显示,SNL神经痛大鼠完整的L4DRG中,TRPV1出现上调;而结扎损伤的L5DRG中,TRPV1却出现下调。其确切机制有待进一步明确。
低频电针能显著降低上调的L4DRG TRPV1;TRPV1激动剂6'-IRTX腹腔注射,能显著拮抗低频电针抗痛敏化的作用。表明低频电针可通过调控TRPV1干预痛敏化。
SP最初从马的大脑和肠提取物中分离,是一种由11个氨基酸构成的神经肽。SP主要在DRG神经元中合成,通过轴流转运向上可至脊髓背角,向下可至感觉神经末梢。与TRPV1一样选择性表达于感受伤害性信息的中小感觉神经元,是一种从外周到中枢神经系统传送痛觉冲动的主要炎性神经肽[10]。神经损伤后,C纤维兴奋性增加,SP大量释放,促进痛觉敏化[8]。本研究显示,SNL大鼠损伤的L5DRG中,SP显著上升;低频电针能有效抑制SP上升。这也可能与低频电针干预神经病理痛痛敏化有关。
TRPV1激活能促使DRG神经元释放SP,进一步促进痛觉敏化[8]。本研究显示,损伤的L5DRG中TRPV1水平下降,SP水平上升。SP的释放与TRPV1有何关系,是否还与其他痛敏化相关受体、离子通道的激活有关,有待进一步明确。
本研究行为学实验表明,SNL大鼠早期出现痛觉超敏反应;低频电针能显著改善痛敏化程度。
[1]Wang W,Gu J,Li YQ,et al.Are voltage-gated sodium channels on the dorsal root ganglion involved in the development of neuropathic pain?[J].Mol Pain,2011,7:16.
[2]Austin PJ,Moalem-Taylor G.The neuro-immune balance in neuropathic pain:involvement of inflammatory immune cells,immune-like glial cells and cytokines[J].J Neuroimmunol,2010,229(1-2):26-50.
[3]马芸,刘延青.脉冲射频治疗慢性神经病理性疼痛的临床新进展[J].中国康复理论与实践,2011,17(11):1010-1012.
[4]Berman BM,Langevin HM,Witt CM,et al.Acupuncture for chronic low back pain[J].New Engl J Med,2010,363(5):454-461.
[5]孙瑞卿,王贺春,王韵,等.不同频率的电针对大鼠神经源性痛的治疗作用[J].中国应用生理学杂志,2002,18(2):25-28.
[6]孙瑞卿,王贺春,景峥,等.2 Hz电针减轻神经源性痛大鼠的痛觉超敏和冷诱发的持续性疼痛[J].中国疼痛医学杂志,2003,(4):220-224.
[7]Dworkin RH,Backonja M,Rowbotham MC,et al.Advances in neuropathic pain:diagnosis,mechanisms,and treatment recommendations[J].Arch Neurol,2003,60(11):1524-1534.
[8]Meents JE,Neeb L,Reuter U.TRPV1 in migraine pathophysiology[J]. Trends Mol Med,2010,16(4):153-159.
[9]Kim SH,Chung JM.An experimental model for peripheral neuropathy produced by segmental spinal nerve ligation in the rat[J].Pain,1992,50 (3):355-363.
[10]Jara-Oseguera A,Simon SA,Rosenbaum T.TRPV1:on the road to pain relief[J].Curr Mol Pharmacol,2008,1(3):255-269.
[11]Caterina MJ,Schumacher MA,Tominaga M,et al.The capsaicin receptor:a heat-activated ion channel in the pain pathway[J].Nature, 1997,389(6653):816-824.
[12]Xia R,Dekermendjian K,Lullau E,et al.TRPV1:a therapy target that attracts the pharmaceutical interests[J].Adv Exp Med Biol,2011,704: 637-665.
[13]Palazzo E,Luongo L,de Novellis V,et al.Moving towards supraspinal TRPV1 receptors for chronic pain relief[J].Mol Pain,2010,6:66.
[14]Vilceanu D,Honore P,Hogan QH,et al.Spinal nerve ligation in mouse upregulates TRPV1 heat function in injured IB4-positive nociceptors[J].J Pain,2010,11(6):588-599.
Effect of Electroacupuncture with Low Frequency on Pain Sensitization of Rats Suffered from Spinal Nerve Ligation
JIANG Yongliang,YIN Xiao-hu,SHEN Ya-fang,et al.Department of Neurobiology and Acupuncture Research,the Third Clinical Medical College,Zhejiang Chinese Medical University,Hangzhou 310053,Zhejiang,China
ObjectiveTo investigate the effect of electroacupuncture with low frequency on pain sensitization of neuropathic pain rats, and the possible mechanism of regulating peripheral pain sensitization.MethodsRat neuropathic pain model was established with the right L5spinal nerve ligation.Zusanli(ST36)and Kunlun(BL60)were selected for electroacupuncture intervention.Mechanical allodynia,and the levels of stransient receptor potential vanilloid type 1(TRPV1)and substance P(SP)in ipsilateral L5and L4dorsal root ganglion(DRG) were tested.A further validation experiment with TRPV1 agonist 6'-IRTX was carried out.ResultsRats suffered from L5spinal nerve ligation showed obvious pain sensitization.The levels of TRPV1 in ipsilateral L4DRG and SP in ipsilateral L5DRG were significantly elevated. Electroacupuncture with low frequency significantly relieved pain sensitization,and suppressed TRPV1 and SP increase.6'-IRTX intraperitoneally administered significantly counteracted the anti-pain sensitization action of electroacupuncture with low frequency.ConclusionElectroacupuncture with low frequency is effective on neuropathic pain by intervening pain sensitization,which may be related to the regulation of DRG TRPV1 and SP.
neuropathic pain;electroacupuncture;dorsal root ganglion;transient receptor potential vanilloid type l;substance P
R745.4
A
1006-9771(2014)03-0211-04
2013-09-26
2014-01-23)
1.国家自然科学基金项目(No.81072855);2.浙江省自然科学基金项目(No.LY12H27015;No.Z2100979)。
浙江中医药大学第三临床医学院针灸神经生物学实验室,浙江杭州市310053。作者简介:蒋永亮(1981-),男,浙江磐安县人,博士,助理研究员,主要研究方向:针刺镇痛与免疫调节的相关性研究。并列第一作者:尹小虎。通讯作者:方剑乔(1961-),男,博士,教授,博士生导师。
10.3969/j.issn.1006-9771.2014.03.003
