鸭疫里默氏杆菌TaqMan荧光定量PCR检测方法的建立
2014-05-21万春和程龙飞邵周伍林刘思国
万春和,程龙飞,邵周伍林,刘思国,黄 瑜*,张 云*
(1.中国农业科学院哈尔滨兽医研究所兽医生物技术国家重点实验室,黑龙江 哈尔滨 150001;2.福建省农业科学院畜牧兽医研究所福建省畜禽疫病防治工程技术研究中心,福建 福州 350013)
鸭疫里氏杆菌(Riemerella anatipestifer,RA)是一种革兰氏阴性、无鞭毛、无芽孢,可以形成荚膜的棒状杆菌。RA病又称鸭传染性浆膜炎,以纤维性心包炎、肝周炎和气囊炎为典型“三炎”病变特征,该病于1932年首次报道于美国,我国于1982年首次报道[1-2]。RA目前已报道的血清型多达21种,并且陆续有新血清型的报道,不同血清型之间无显著的交叉保护[3-4]。
在铁限制的环境下,绝大多数致病菌通过产生特殊的螯合剂-铁载体来获取铁离子。最新研究表明,致病菌铁离子摄取系统起调控作用的基因主要分为两大类:大肠杆菌中的铁离子摄取抑制子(FUR)[5-6]和白喉棒状杆菌中的白喉棒状杆菌毒素抑制子(DtxR)[7-8]。本研究建立基于TaqMan探针检测RA的荧光定量PCR方法,该方法操作简便、特异性强、敏感性高,重复性好,可以实时定量分析RA铁依赖抑制子基因(RaDtxR)在动物体内的含量来检测其RA感染程度,为研究RA的治病机理奠定基础。
1 材料和方法
1.1 菌株、病毒株及主要试剂 RA血清型(1型、2型、3型及10型)、大肠杆菌(E.coli)、巴氏杆菌(P.multocida)、沙门氏菌(Salmonella)、Ⅰ型鸭肝炎病毒(DHV-1)、禽坦布苏病毒(ATMUV)和鸭圆环病毒(DuCV)均由哈尔滨兽医研究所分离、鉴定和保存;Premix ExTaqTM(Probe qPCR)、Premix ExTaqTMVersion 2.0(Loading dye mix)、pMD18-T、50 bp DNA Ladder均购自TaKaRa公司;胶回收试剂盒、质粒小量抽提试剂盒、细菌基因组提取试剂盒购自天根生化科技(北京)有限公司;Trans 5α感受态细胞购自北京全式金生物技术有限公司。
1.2 引物和探针的设计与合成 参考GenBank中登录的RaDtxR基因序列设计引物:RA-TaqMan1F:5'-CTGCTGTAACTGTAGATAC-3'和RA-TaqMan1R:5'-GAAGGTGTGAGAAATACC-3', 探 针 RA probe:5'-(FAM)CGGTTACCATCATAGAAGCGTCAA(TAMRA)-3',其中 5'端以FAM标记,3'端TAMRA标记。引物 RA-R1F:5'-TATTTTATTTTTGTGTCTAT GAACT-3'和 RA-R1R:5'-TCTTGGCTGAGTTTTAA TCT-3'用于扩增含RaDtxR基因编码区的片段。引物和探针由上海生工生物工程技术服务有限公司合成。
1.3 荧光定量PCR重组质粒标准品的制备 利用细菌基因组提取试剂盒提取RA基因组DNA,以特异性引物RA-R1F和RA-R1R,扩增含RaDtxR基因编码区的目的片段,预期长度约为700 bp。扩增体系为 50 μL,反应条件:94℃ 5 min;94℃ 50 s、55℃ 30 s、72℃ 40 s,35个循环;72℃ 10 min。将PCR产物克隆于pMD18-T载体中构建重组质粒pMD-RaDtxR。测序正确后,利用分光光度计测定OD260nm值,计算拷贝数作为荧光定量PCR阳性标准品,并进行10倍连续稀释,于-20℃备用。
1.4 反应条件的优化及标准曲线的建立 采用Premix ExTaqTM(Probe qPCR)推荐的 25 μL 体系。以出现最高的荧光值(△Rn)、最小的Ct值为指标,对退火温度(52℃~66℃)、引物终浓度(0.1 μM~1 μM)及探针终浓度(0.05 μM~0.5 μM)进行优化。反应条件:95℃30 s;95℃5 s、55℃10 s、72℃30 s,45个循环。以10倍连续稀释后的阳性标准品质粒为模板,利用优化后的反应条件进行扩增,反应结束后得到相应的动力学曲线,并绘制标准曲线。
1.5 特异性试验 利用建立的荧光定量PCR方法分别检测RA血清型(1型、2型、3型、10型)、E.coli、P.multocida、DuCV的基因组 DNA及 DHV-1和ATMUV基因组RNA反转录后的cDNA,评价该方法的特异性。
1.6 重复性试验 将阳性标准品稀释3个浓度梯度,每个梯度设3个重复,利用建立的荧光定量PCR方法进行检测,评价其重复性,计算组内变异系数。将该标准阳性标准质粒置于-20℃冰箱保存,每隔2周进行重检,计算其组间变异系数。
1.7 临床样品的检测 利用建立的荧光定量PCR方法,对18份鸭临床肝脏样品进行RA检测,并与常规PCR方法进行比较[9],同时对阳性样品进行细菌的分离。
2 结 果
2.1 实时荧光定量PCR标准品的制备 以RA基因组DNA为模板,RA-R1F和RA-R1R为引物,扩增含RaDtxR基因编码区的目的片段。结果显示,扩增产物大小约为700 bp,与预期大小相符(图1)。将目的基因克隆于pMD18-T载体中构建重组质粒pMD-RaDtxR,将其作为重组质粒标准品。
2.2 荧光定量PCR反应条件优化及标准曲线的建立 对引物和探针终浓度进行优化,反应体系为25 μL,引物和探针终浓度均为0.2 μM。最佳反应条件为:95℃ 30 s;95℃ 5 s、55℃ 15 s、72℃30 s,45个循环。以不同浓度的标准品质粒为模板,利用优化后的反应条件进行扩增,绘制动力学曲线和标准曲线。结果显示,在 4.27×102拷贝/μL~4.27×106拷贝/μL范围内具有良好的线性关系,所获得标准曲线斜率为-3.564,Y轴截距为31.03,相关系数为0.998,扩增效率为99%,最低检测限为4.27×102拷贝 /μL(图 2)。

图1 PCR扩增结果Fig.1 Amplification of the target gene by PCR
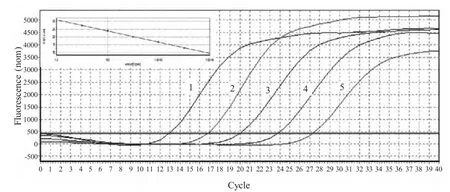
图2 荧光定量PCR的扩增动力学曲线和标准曲线Fig.2 The dynamic curve and standard curve of real-time PCR
2.3 特异性分析 利用建立的荧光定量PCR方法对核酸的检测结果显示,仅RA血清型(1型、2型、3型、10型)可见有阳性荧光信号;而其他相应核酸均未检测到荧光信号,表明该方法具有良好的特异性(图 3)。

图3 特异性试验结果Fig.3 The specificity for the real-time PCR
2.4 重复性试验 对不同浓度和批次的阳性标准品进行荧光定量PCR检测。结果显示,组内变异系数为0.23%~0.77%,组间变异系数为0.93%~1.32%,表明该检测方法重复性良好(表1)。

表1 荧光定量PCR的组内和组间重复性试验结果Table 1 Reproducibility test of intra-and inter-assay of the real-time PCR
2.5 荧光定量PCR对临床样品的检测 对18份临床样品进行检测,结果显示,荧光定量PCR检测阳性样品为11份,而常规PCR方法检测阳性样品为7份,该7份样品均为荧光PCR阳性样品;对11份荧光PCR阳性样品进行细菌分离,均分离到RA;表明荧光定量PCR检测与细菌分离方法的符合率为100%。
3 讨 论
本研究以RA RaDtxR为靶基因设计引物进行荧光定量PCR,不同血清型和同种血清型不同毒力的RA的RaDtxR基因均十分保守,对E.coli、P.multocida和Salmonella等进行检测,均未扩增到目的片段,表明该基因为RA所特有的功能基因(待发表材料),可以作为RA潜在诊断标记物[10-13]。
本研究基于TaqMan探针建立的荧光定量PCR方法,检测 RaDtxR基因在 4.27×102拷贝 /μL~4.27×106拷贝/μL范围内,标准曲线线性关系良好(R2=0.998),扩增效率为99%,最低检测限为4.27×102拷贝/μL。组内和组间的变异系数分别为0.23%~0.77%和0.93%~1.32%,均小于2%,重复性好,特异性强,对其它水禽常见病原均未检测到荧光信号,可以用于RA感染的早期检测,也可以用于明确不同毒力RA在鸭只体内的动态载量,为研究RA的免疫效果提供重要参考。
[1]Leavitt S,Ayroud M.Riemerella anatipestiferinfection of domestic ducklings[J].Can Vet J,1997,38(2):113.
[2]黄瑜,苏敬良,张大丙,等.鸭疫里默氏菌最新研究进展[J].中国兽医科技,2000,30(7):43-44.
[3]Pathanasophon P,Sawada T,Tanticharoenyos T.New serotypes of Riemerella anatipestiferisolated from ducks in Thailand[J].Avian Pathol,1995,24(1):195-199.
[4]Pathanasophon P,Phuektes P,Tanticharoenyos T,et al.A potential new serotype of Riemerella anatipestiferisolated from ducks in Thailand[J].Avian Pathol,2002,31(3):267-270.
[5]Troxell B,Fink R,Porwollik S,et al.The Fur regulon in anaerobically grownSalmonella entericasv.Typhimurium:identification of new Fur targets[J].BMC Microbiol,2011,11:236.
[6]Teixidó L,Carrasco B,Alonso J C,et al.Fur activates the expression of Salmonella entericapathogenicity island 1 by directly interacting with the hilD operatorin vivoandin vitro[J].PLoS One,2011,6(5):e19711.
[7]Wennerhold J,Bott M.The DtxR regulon of Corynebacterium glutamicum[J].J Bacteriol,2006,188(8):2907-2918.
[8]Chen Huan,Wu Rong-rong,Xu Guang-zhi,et al.DR2539 is a novel DtxR-like regulator of Mn/Fe ion homeostasis and antioxidant enzyme inDeinococcus radiodurans[J].Biochem Biophys Res Commun,2010,396(2):413-418.
[9]程龙飞,施少华,李文杨,等.PCR检测鸭疫里默氏菌的研究[J].江西农业大学学报,2004,26(1):131-133.
[10]Wan Chun-he,Huang Yu,Cheng Long-fei,et al.The development of a rapid SYBR Green I-based quantitative PCR for detection of Duck circovirus[J].J Virol,2011,8:465.
[11]万春和,黄瑜、傅光华,等.一种用于检测鹅圆环病毒的引物和探针[P].CN101942528B,2012-07-04.
[12]Rubbenstroth D,Ryll M,Knobloch J K,et al.Evaluation of different diagnostic tools for the detection and identification of Riemerella anatipestifer[J].Avian Pathol,2013,42(1):17-26.
[13]Han Xiang-an,Ding Chan,He Liang,et al.Development of loop-mediated isothermal amplification(LAMP)targeting the GroEL gene for rapid detection of Riemerella anatipestifer[J].Avian Dis,2011,55(3):379-383.
