冬凌草甲素下调STAT3-HKⅡ通路诱导Hep G2细胞凋亡的研究
2014-05-19王天晓刘迎滑时小燕
王天晓,刘迎滑,时小燕
(河南大学中药研究所,药学院,河南开封 475004)
肿瘤细胞所需的能量主要由葡萄糖的氧化供应,肿瘤细胞糖代谢的主要特征是糖酵解明显增强。造成肿瘤细胞糖酵解增强的主要原因与该细胞的酵解酶的过表达及活性增强有关。抑制这些酶的表达和活性,阻断糖酵解的进行,可使肿瘤细胞因能量供应缺乏而死亡,但正常细胞不受影响。己糖激酶(hexokinase,HK)是调节细胞糖酵解的关键限速酶。在恶性肿瘤细胞中,以HK-Ⅱ亚型高表达为主,HK-Ⅱ除了具有糖代谢酶的催化活性,还具有拮抗细胞凋亡的功能[1-3]。因此,抑制 HK-Ⅱ 可抑制肿瘤细胞生长、诱导肿瘤细胞凋亡。冬凌草甲素(Oridonin)具有抗肿瘤活性,但其对肿瘤细胞糖代谢的调控作用还未见报道。因此,本研究探讨冬凌草甲素对人肝癌HepG2细胞中HK-Ⅱ的影响,以进一步研究其新的抗肿瘤作用机制。
1 材料与方法
1.1 试剂 RPMI 1640培养基购于Gibco公司;新生牛血清购自杭州四季青生物工程公司;MTT购于Sigma公司;RT-PCR试剂盒为北京全式金生物公司产品;STAT3、pSTAT3和 HK-Ⅱ一抗 为 Cell Signaling technology公司产品;β-actin一抗 和HRP标记二抗购于北京博奥森生物技术有限公司。Hoechst 33342和PI为碧云天产品。冬凌草甲素由河南大学药学院康文艺老师馈赠。HK-Ⅱ抑制剂3-溴丙酮酸(3-Bromopyruvic acid,3-BrPA)购于 Alfa Aesar公司。
1.2 细胞培养 人肝癌HepG2细胞用含10%血清、100 kU·L-1青霉素、100 mg·L-1链霉素的 RPMI 1640培养基在37℃,5%CO2,饱和湿度条件下培养至对数生长期。
1.3 细胞增殖检测 对数生长期的HepG2细胞,调整细胞密度至5×107·L-1,接种于96孔培养板,每孔100μl,24 h后分别用 0、5、10、20、30 mg·L-1冬凌草甲素或3-BrPA处理细胞,48 h后每孔加5 g·L-1MTT 10μl,37℃继续孵育 4 h,弃上清,每孔加入150μl DMSO,酶标仪检测各孔在490 nm波长下的吸光值(A值),计算细胞抑制率。
1.4 细胞凋亡检测 Hoechst 33342/PI双染检测细胞凋亡:收集对数生长期的HepG2细胞,调整细胞密度至5×107·L-1,接种于96孔培养板,每孔100μl,24 h后分别用0、10、20、30 mg·L-1冬凌草甲素或 3-BrPA处理细胞,48 h后,PBS洗涤2次,加入PBS 80 μl,加入 PI染液,终浓度 5 mg·L-1,4℃避光染色 60 min,再加入 Hoechst 33342染液,终浓度5 mg·L-1,37℃避光染色20 min,再用 PBS洗涤2次,加入100 μl PBS后用Arrary ScanVTIHCS600型高内涵成像系统观察照相,同时检测PI的荧光强度。
1.5 STAT3 siRNA转染 HepG2细胞接种于6孔板,待细胞汇合度为30%~40%时进行STAT3 siRNA转染,以Lipofectamine 2000为转染试剂。转染48h后,收集细胞,提取细胞总RNA和细胞总蛋白,进行RT-PCR和Western blot分析。STAT3特异性siRNA的序列为 sense:5′-CCCGUCAACAAAUUAAG AAdTdT-3′,antisense:5′-UUCUUAAUUU GUUGACG GG dTdT-3′,由Invitrogen公司合成。
1.6 RT-PCR 经 0、10、20、30 mg·L-1冬凌草甲素或STAT3 siRNA处理48 h后的HepG2细胞,应用TRIzol试剂提取细胞总RNA,利用RT-PCR试剂盒扩增 HK-Ⅱ 和 STAT3 mRNA。HK-Ⅱ-Forward primer:5′TCTGCTTGCCTACTTCTTC3′,HK-Ⅱ-Reverse primer:5′TTCTCCATCTCCACCTTCT3′,Product length:312bp;STAT3-Forward primer:5′CCAAGGAGGAGGCATTCG3′, STAT3-Reverse primer 5′ACATCGGCAGGTCAATGG3′,扩增片段 147 bp。βactin为内参,引物序列为5′-CTTCTACAATGAGCTGCGTG-3′,5′-TCATGAGGTAGTCAGTCAGG-3′,扩增片段305 bp。
1.7 Western blot 收集经 0、10、20、30 mg·L-1冬凌草甲素或3-BrPA处理48 h后的HepG2细胞,加入RIPA细胞裂解液,冰上裂解15 min后,超声匀浆提取细胞总蛋白并定量。总蛋白经10%SDSPAGE胶电泳分离后,转移至PVDF膜上,室温下5% 脱脂牛奶封闭 1 h,加入 HK-Ⅱ、STAT3和pSTAT3一抗4℃过夜,洗膜3次后,加入辣根过氧化物酶标记的二抗,室温孵育1 h,再洗膜3次,通过ECL试剂盒进行显影检测。β-actin为内参蛋白。
1.8 统计学处理 所有数据采用SPSS 17.0应用软件进行统计学分析。数据均以¯x±s表示,进行方差分析及t检验。
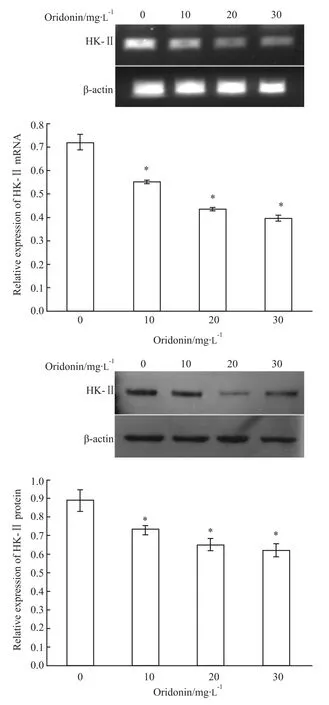
Fig 1 Oridonin inhibits the expression of HK-Ⅱ
2 结果
2.1 Hep G2细胞中HK-Ⅱ的表达及冬凌草甲素对其表达的影响 RT-PCR及Western blot结果显示,HepG2细胞中有高表达的HK-Ⅱ,而且冬凌草甲素作用后,可剂量依赖性地降低HepG2细胞中HK-ⅡmRNA及蛋白表达水平(Fig 1)。
2.2 冬凌草甲素下调HK-Ⅱ对Hep G2细胞增殖及凋亡的影响 MTT结果显示,冬凌草甲素可剂量依赖性地抑制HepG2细胞生长,其对HepG2细胞的IC50为20.45 mg·L-1。3-BrPA作为 HK特异性抑制剂能够抑制肿瘤细胞的糖酵解和氧化磷酸化过程,使肿瘤细胞因ATP供应不足而死亡[4]。因此本研究以3-BrPA作为阳性对照,MTT结果显示,浓度在30 mg·L-1以下时,冬凌草甲素的抑制肿瘤细胞增殖作用略弱于3-BrPA,当浓度达30 mg·L-1时,冬凌草甲素的抗肿瘤细胞增殖活性与3-BrPA作用相当(Fig 2)。
高内涵活细胞成像系统检测结果显示,冬凌草甲素处理的HepG2细胞内PI的荧光强度明显增加,表明冬凌草甲素可促进HepG2细胞发生晚期凋亡和坏死,其促细胞凋亡作用也与3-BrPA相当(Fig 3)。
同时,用3-BrPA作用HepG2细胞24 h来抑制HK-Ⅱ,然后检测冬凌草甲素对HepG2细胞增殖及凋亡的影响,结果显示3-BrPA抑制HK-Ⅱ后,冬凌草甲素对HepG2细胞的抑制作用被消除(Fig 4A、B),由此表明冬凌草甲素可通过抑制HK-Ⅱ来发挥其抗肿瘤活性。
2.3 冬凌草甲素对STAT3-HK-Ⅱ通路的影响STAT3作为一种由细胞因子等激活的转录因子,可通过调控相关生长基因的表达水平来影响肿瘤细胞的生长及凋亡,其过度激活及表达与肿瘤细胞的增殖、凋亡密切相关。那么STAT3与HK-Ⅱ基因之间的关系如何,STAT3是否调控HK-Ⅱ的表达,冬凌草甲素是否通过影响STAT3表达来抑制HK-Ⅱ的表达?为探讨STAT3与HK-Ⅱ基因之间的关系,我们通过STAT3 siRNA下调 STAT3,观察 HK-ⅡmRNA及蛋白表达水平以及细胞凋亡状态。结果显示,STAT3 siRNA可明显降低HK-Ⅱ mRNA及蛋白水平(Fig 5A),表明转录因子STAT3对HK-Ⅱ具有调控作用;我们又观察不同浓度冬凌草甲素对HepG2细胞中STAT3、pSTAT3及HK-Ⅱ表达的影响,结果显示,冬凌草甲素可剂量依赖性地下调HepG2细胞中STAT3 mRNA及STAT3、pSTAT3和HK-Ⅱ蛋白表达水平(Fig 5B)。而且STAT3 siRNA抑制 STAT3后,再用冬凌草甲素作用HepG2细胞24 h,此时冬凌草甲素对细胞增殖及凋亡的影响被消除(Fig 5C、D)。由此进一步表明冬凌草甲素可通过抑制STAT3的表达及活性来抑制HK-Ⅱ的表达,从而抑制HepG2细胞的生长,促进HepG2细胞的凋亡。
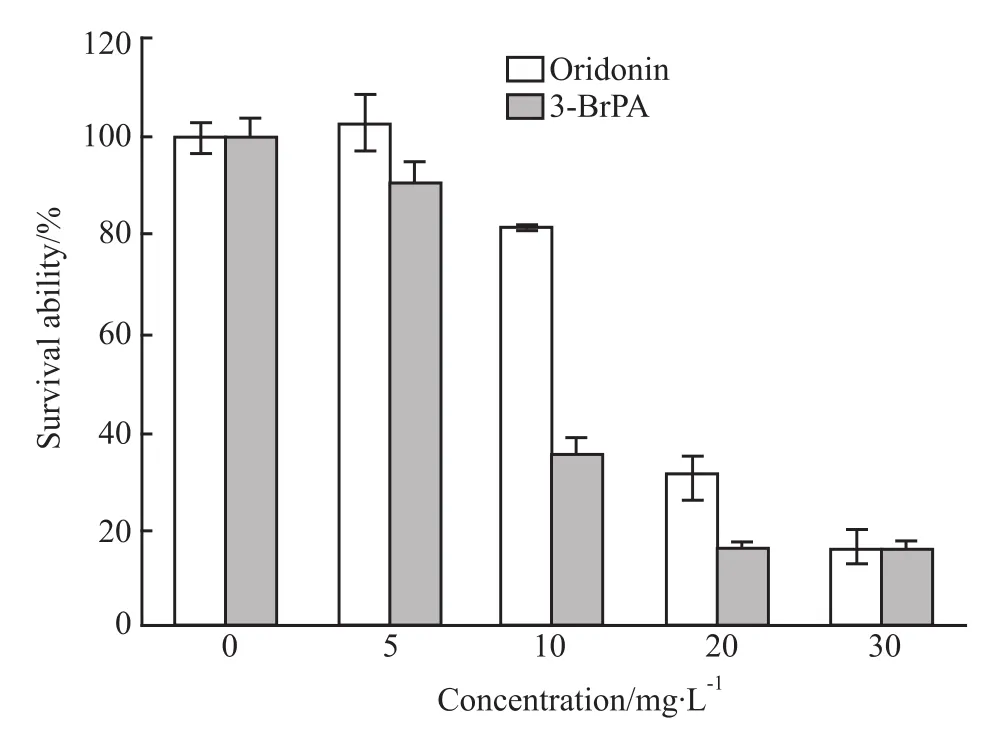
Fig 2 Effect of oridonin on Hep G2 cell proliferation(¯x±s)
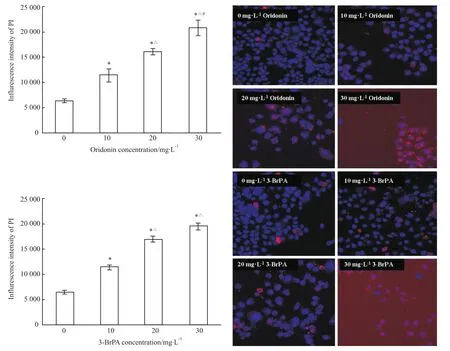
Fig 3 Effect of oridonin on HepG2 cell apoptosis(¯x±s)
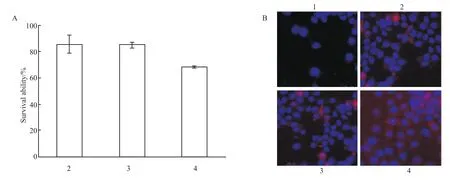
Fig 4 Effect of oridonin on cell proliferation and apoptosis after 3-Br PA inhibiting HK-Ⅱ(¯x±s)
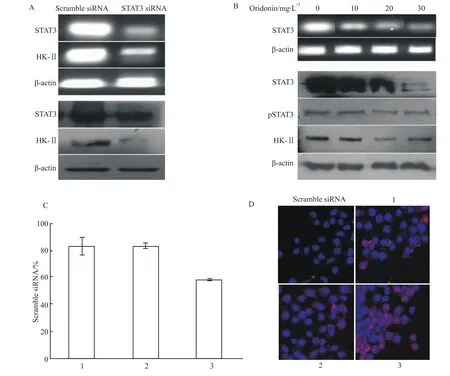
Fig 5 Effect of oridonin on STAT3-HK-Ⅱ pathway
3 讨论
Warburg在20世纪20年代首次报道肝癌细胞比正常肝细胞糖酵解代谢活跃,即使在供氧充足条件下,恶性肿瘤细胞糖酵解也明显增强,即有氧糖酵解[5-6]。进一步的研究显示,活跃的糖酵解代谢表型存在于大多数恶性肿瘤细胞中。HK是糖酵解代谢的第一个关键限速酶,它催化葡萄糖转化成6-磷酸葡萄糖。目前已知人类有Ⅰ、Ⅱ、Ⅲ和Ⅳ4种同工酶,其中HK-Ⅱ 亚型与恶性肿瘤相关性最大,在许多恶性肿瘤细胞中高表达,而且HK-Ⅱ 不仅具有糖酵解代谢酶的催化活性,还有拮抗细胞凋亡的作用[1-3]。恶性肿瘤细胞糖酵解代谢受细胞内信号转导通路调控,STAT3作为细胞内的重要转录因子,与细胞增殖和凋亡关系密切,在很多恶性肿瘤中过度表达和活化[7-8]。抑制 STAT3的表达或活化可抑制肿瘤细胞生长,促进肿瘤细胞凋亡[9-11]。
本研究结果显示,STAT3和HK-Ⅱ 基因在人肝癌HepG2细胞中呈过表达或高水平表达,因此抑制STAT3和(或)HK-Ⅱ的表达及活性,可抑制HepG2细胞生长。本研究显示,冬凌草甲素可剂量依赖性地抑制STAT3和HK-Ⅱ的表达及活性,抑制HepG2细胞生长、促进HepG2细胞凋亡;STAT3 siRNA可明显降低HK-Ⅱ的mRNA和蛋白水平;同时应用STAT3 siRNA干涉STAT3,3-BrPA抑制HK-Ⅱ,研究冬凌草甲素对HepG2细胞生长及凋亡的影响,结果显示STAT3和HK-Ⅱ分别被抑制后,冬凌草甲素对HepG2细胞的生长抑制被消除。上述结果表明,冬凌草甲素可通过抑制STAT3的表达及活性来抑制HK-Ⅱ的表达及活性,从而抑制HepG2细胞的生长,促进HepG2细胞的凋亡。
总之,冬凌草甲素可通过下调STAT3-HK-Ⅱ通路诱导HepG2细胞凋亡。
参考文献:
[1]Robey RB,Hay N.Mitochondrial hexokinases,novel mediators of the antiapoptotic effects of growth factors and Akt[J].Oncogene,2006,25(34):4683-96.
[2]Smith T A.Mammalian hexokinases and their abnormal expression in cancer[J].Br J Biomed Sci,2000,57(2):170-8.
[3]Pedersen P L,Mathupala S,Rempel A,et al.Mitochondrial bound typeⅡ hexokinase:a key player in the growth and survival of many cancers and an ideal prospect for therapeutic intervention[J].Biochim Biophys Acta,2002,1555(1-3):14-20.
[4]Harrison S A,Di Bisceglie A M.A new approach totherapy for hepatocellular carcinoma[J].Hepatol,2003,37(2):471-3.
[5]Warburg O.On the origin of cancer cells[J].Science,1956,123(3191):309-14.
[6]Upadhyay M,Samal J,Kandpal M,et al.The Warburg effect:insights from the past decade[J].Pharmacol Ther,2013,137(3):318-30.
[7]Haricharan S,Li Y.STAT signaling in mammary gland differentiation,cell survival and tumorigenesis[J].Mol Cell Endocrinol,2014,382(1):560-9.
[8]Nikolaou K,Sarris M,Talianidis I.Molecular pathways:the complex roles of inflammation pathways in the development and treatment of liver cancer[J].Clin Can Res,2013,19(11):2810-6.
[9]Khan M,Li T,Ahmad Khan MK,et al.Alantolactone induces apoptosis in HepG2 cells through GSH depletion,inhibition of STAT3 activation,and mitochondrial dysfunction[J].Biomed Res Int,2013,2013:719858.
[10]Yan S,Li Z,Thiele C J.Inhibition of STAT3 with orally active JAK inhibitor,AZD1480,decreases tumor growth in neuroblastoma and pediatric sarcomas in vitro and in vivo[J].Oncotarget,2013,4(3):433-45.
[11]Walker SR,Xiang M,Frank D A.Distinct roles of STAT3 and STAT5 in the pathogenesis and targeted therapy of breast cancer[J].Mol Cell Endocrinol,2014,382(1):616-21.
