多花黄精多糖的分级提取及结构初步分析
2014-05-17岳永德
王 坤,岳永德,汤 锋,荀 航,孙 嘏,王 进
国际竹藤中心,北京100102
黄精始载于《明医别录》,是中国传统中草药。为百合科黄精属(Liliaceae)多年生草本植物,有黄精(Polygonatum sibiricum Red.)、滇黄精(Polygonatum kingianum Coll.et Hemsl.)和多花黄精(Polygonatum cyrtonema Hua.)等,其中以多花黄精的质量最佳、药效最好[1]。黄精多糖是黄精化学组成的一个重要部分,含量可以达到17.79%[2],是黄精的主要生物活性成分之一,现代药理学研究证明,黄精多糖具有抗衰老、抗肿瘤[3]、降血糖[4]、降血脂、防动脉硬化、抗病毒[5]、抗菌[6]、提高机体免疫力等多种药理作用。关于黄精多糖的组成、种类及分子量等理化性质则因黄精的品种和产地而有明显差异,张晓红等[7]报道内蒙古野生黄精多糖是由单一果糖组成的相对分子量为7073 Da的同多糖;吴群绒等[8]报道滇黄精多糖I主要是由葡萄糖组成的相对分子量为8100 Da的中性杂多糖,以α-(1,4)糖苷键链接。这些研究仅对黄精多糖的种类和结构做了初步探索。
另外,黄精多糖的提取分离工艺、含量测定及其药理作用方面国内外已有大量研究报道,但关于黄精多糖的组成和结构的研究报道甚少。本文采用多种现代仪器分析测试手段如离子色谱仪、红外光谱分析仪、凝胶色谱分析仪、核磁共振波谱仪、热重分析仪等,对黄精多糖的组成及含量进行表征,着重研究比较不同提取条件下黄精多糖的分离及结构特性,包括单糖组成、分子量及其分布和热稳定性等理化性质,为黄精多糖构效关系的研究和功能产品的开发利用提供了新的理论依据。
1 材料与方法
1.1 材料与试剂
黄精原材料于2011年10月采于安徽省九华山,经安徽省林科院胡一民研究员鉴定为百合科植物多花黄精(Polygonatum cyrtonema Hua.)。经洗净烘干,切片,用植物粉碎机粉碎成约20目,密封于磨口瓶于-10℃冷冻保存,备用。
单糖标准品(L-阿拉伯糖、L-鼠李糖、L-葡萄糖、L-半乳糖、D-甘露糖、D-木糖)购买于美国 Sigma公司;葡聚糖标样(分子量分别为 180、2500、4600、7100、21400、41100、133800 和 2000000);其它试剂均为分析纯。
1.2 仪器与设备
BP-221S电子天平(d=0.1 mg),德国 Sartorius公司;EYELAN-1000旋转蒸发仪,日本 EYELA公司;DHG-9123A电热恒温鼓风干燥箱,上海精宏实验设备有限公司;恒温水浴锅,北京市长风仪器仪表公司;PURELAB Plus型超纯水系统,美国 PALLGELMAN公司;IKA ETS-D5加热型磁力搅拌器,德国IKA公司;LABCONCO Free Zone冷冻干燥仪,美国LABCONCO公司;Nexus傅立叶变换红外光谱仪,美国Nicolet公司;Q500热重分析仪,美国TA公司;ICS3000离子色谱仪,美国Dionex公司;Bruker AV300核磁共振波谱仪,德国Bruker公司。
1.3 方法
1.3.1 分级提取
取多花黄精粉,用石油醚于80℃回流脱脂24 h,回收石油醚,药渣挥干溶剂;取去脂黄精粉30 g,第一步:加入600 mL的蒸馏水80℃提取4 h,过滤得滤液,浓缩至原体积的1/6,然后用4倍体积的乙醇醇沉,静置24 h后离心得沉淀,冷冻干燥得多花黄精多糖样品PCP1;第二步:取第一步中的滤渣,加入0.1%NaOH溶液80℃提取4 h(料液比1∶20,g∶v),过滤得滤液,浓缩至原体积的1/6,用2 M的HCl调节至中性,然后用4倍无水乙醇醇沉,静置24 h后离心得沉淀,冷冻干燥得PCP2;第三、四、五步同二步,分别采用上一步的滤渣,用0.5%、1.0%、2.0%的NaOH溶液提取(料液比1∶20),得多花黄精多糖样品 PCP3、PCP4、PCP5。
1.3.2 单糖组成分析
黄精多糖的单糖含量采用一步酸水解法分析其相应的水解产物含量来确定[9]。称取黄精多糖样品5 mg,加入0.125 mL 72%的硫酸,在室温条件下不断振动,然后加入1.35 mL蒸馏水,稀释为1.475 mL,然后放入121℃烘箱中,加热2.5 h,半小时晃动一次。冷却后,用0.22μm亲水性滤膜过滤,除去不溶物。将滤液稀释50倍后,进高效离子色谱(HPIC)测定单糖组成。高效离子色谱仪配备脉冲安培检测器(PAD)及糖分析专用离子交换分析柱(CarboPacTM PA1,i.d.4 mm × 250 mm,5 μm)。具体分析条件如下:淋洗液浓度为18 mM NaOH,并柱后加碱0.3 M NaOH,流速设为 0.5 mL/min,时间为45 min;然后用0.2 M NaOH洗色谱柱10 min,最后用18 mM NaOH平衡10 min。酸性单糖采用0.4 M NaOH的流动相,流速设为1.0 mL/min分析10 min。采用保留时间定性,外标法计算糖含量。
1.3.3 多糖分子量测定
黄精多糖的分子量测定采用凝胶色谱法(GPC)法[10]。具体分析条件如下:Aquagel-OH(美国Agilent,i.d.7.5 mm ×300 mm,8 μm)色谱柱,示差检测器(RID),淋洗液为含有0.02 M NaCl的5 mM磷酸钠缓冲液,pH 值为7.5,流速为 0.1 mL/min,样品浓度为0.1%。以已知分子量的多糖标准品的保留时间做标准曲线来计算多糖样品的分子量水平。
1.3.4 红外光谱分析
将黄精多糖样品以1∶100比例同溴化钾混合后,在玛瑙研钵中磨至约200目粉末,在红外压片机上制成透明薄片,采用红外光谱仪配备DTGS(氘化硫三肽)热电检测器分析。扫描波长范围为4000~400 cm-1,共扫描64次,分辨率为2 cm-1。以纯溴化钾得到的红外光谱图作为背景。
1.3.5 核磁共振波谱分析
黄精多糖样品用重水(D2O)溶解后在核磁共振仪上进行1H NMR和13C NMR分析,以四甲基硅烷(TMS)为内标物。核磁条件为氢谱(1H NMR):脉冲程序(PULPROG):zg;驰豫延迟(D1):2.00000000 sec;采样通道1H 高功率 90°脉宽(P1):4.00 usec。碳谱(13C NMR):脉冲程序(PULPROG):zgdc;驰豫延迟(D1):2.00000000 sec;采样通道1H高功率90°脉宽(P1):3.00 usec。
1.3.6 热重分析
黄精多糖样品的热重(TGA)分析采用同步热分析仪测定。将15 mg样品置于铝坩锅中,在氮气的环境下,以10℃/min的加热速度从室温加热到600℃,连续记录样品的质量和放热数据而获得样品的热稳定性数据。
2 结果与讨论
2.1 得率与单糖组成分析
通过热水和进一步NaOH溶液提取得到的五个多糖样品分别命名为 PCP1、PCP2、PCP3、PCP4、PCP5。PCP1为白色粉末,碱提的样品PCP2-5为黄褐色粉末。得率和糖分析的结果如表1,水提多糖的得率可以达到40.3%,进一步加入碱液提取滤渣里面的多糖,当 NaOH溶液的浓度由0.1%升至0.5%时,样品的得率从14.2%升高到20.1%,然后随着NaOH溶液浓度的升高,样品得率逐渐下降,当用2.0%的 NaOH提取时,PSP5的得率最小,为6.4%。从表1可以看出,所有样品都含有一定量的阿拉伯糖、半乳糖、葡萄糖、甘露糖和半乳糖醛酸,以及少量的木糖和葡萄糖醛酸,除了甘露糖之外,其他单糖和糖醛酸,在多花黄精的同属植物黄精(P.sibiricum)中均有发现[11]。在单糖组成分析中,水提和碱提的多糖样品呈现出了显著的差异,通过进一步的碱提,阿拉伯糖的相对含量由水提的2.1%增加到20%左右,葡萄糖醛酸的相对含量也由0.5%提高到了7%左右,半乳糖的相对含量也得到了明显提高,可以达到总量的60%左右;而葡萄糖、甘露糖、半乳糖醛酸的相对含量降低了,在PCP4中,他们的相对含量降到了2.7%、6.7%、0.1%。碱提的样品中,随着碱液浓度的增加,葡萄糖和半乳糖醛酸的相对含量逐渐降低,而甘露糖和葡萄糖醛酸的相对含量却在逐渐增加。
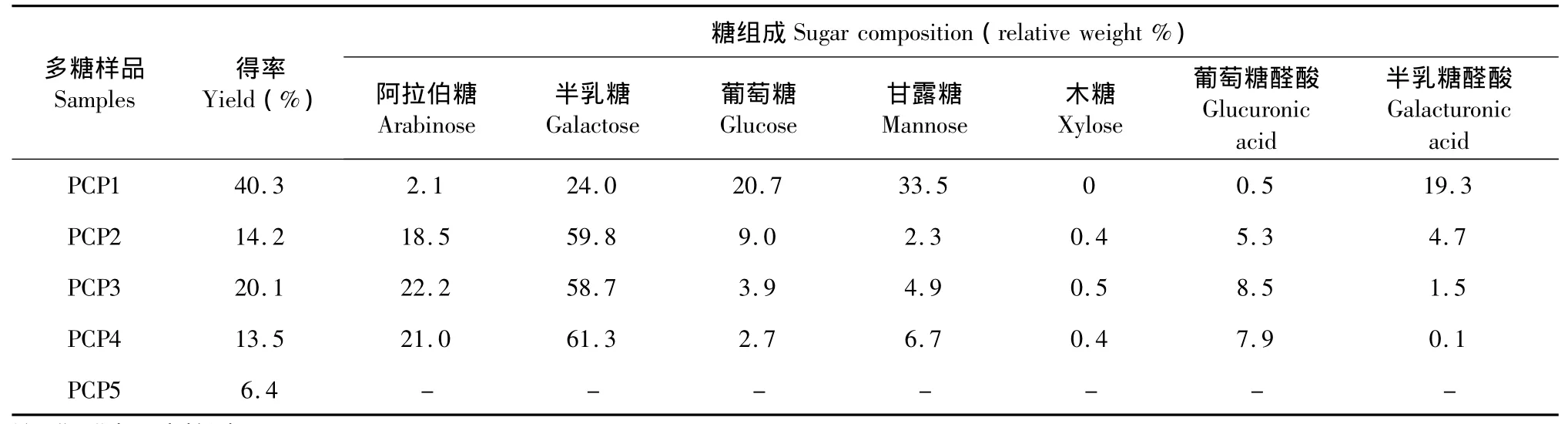
表1 多花黄精多糖得率(质量百分比)及糖组成(相对百分比)测定结果Table 1 Yield(weight%),sugar composition(relative weight%,w/w)of the five polysaccharides isolated from the rhizomes of P.cyrtonema
2.2 分子量及其分布
多糖样品的分子量是由凝胶色谱仪在水相中测定的,所得到的重均分子量、数均分子量以及分散度系数值列于表2中。为了更直观的描述样品PCP1-5之间变化,分子量分布图也示于图1。从表2的数据可以看出,水提样品PCP1的分子量明显小于其他样品,并且与PCP1的分子量分布方式不同的是,进一步碱提得到的样品具有更广泛的分布范围,分散系数较大。
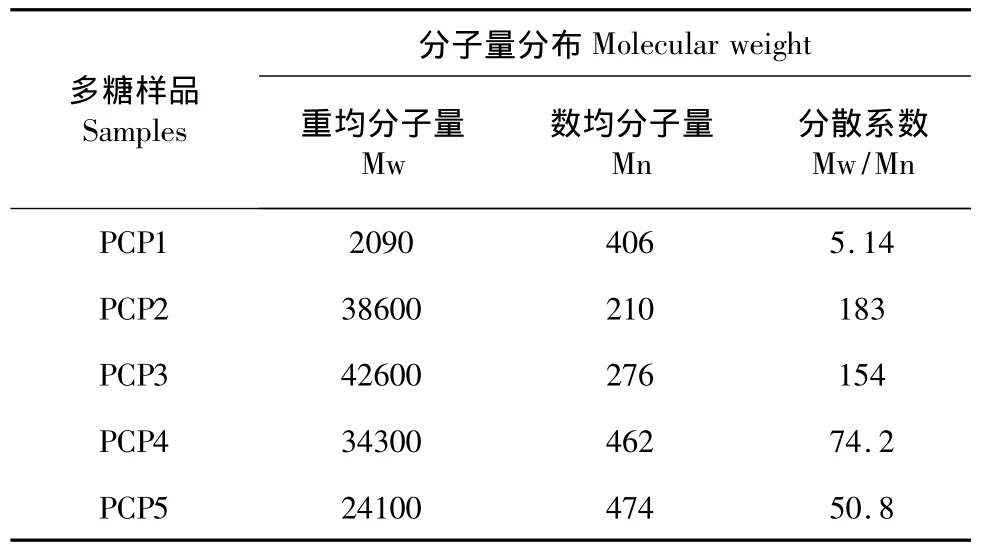
表2 多花黄精多糖重均分子量、数均分子量和分散系数Table 2 Weight average(w),number average(n)molecular weight and polydispersity(w/n)of the five polysaccharides isolated from the rhizomes of P.cyrtonema Hua
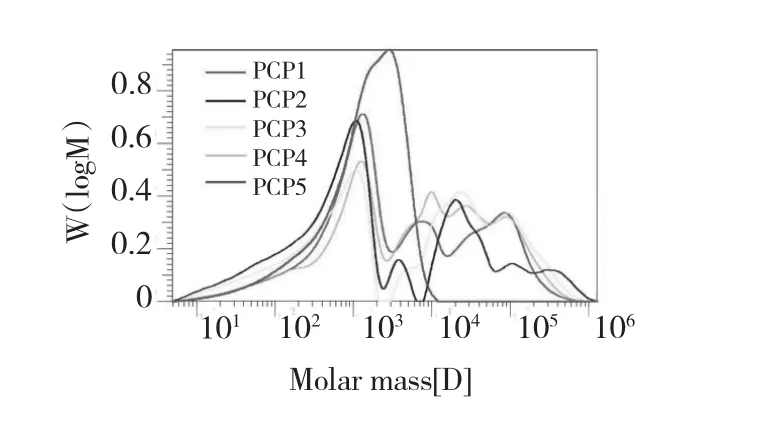
图1 多花黄精多糖的分子量分布图Fig.1 Molecular weight distribution curves of the five polysaccharides isolated from the rhizomes of P.cyrtonema Hua
2.3 红外光谱分析
红外光谱分析结果如图2所示,用于提供更多的多糖结构信息,在3415 cm-1处的强烈吸收峰是由于在氢键中OH的伸缩振动引起的,它表明了多糖链中强有力的分子内和分子间的相互作用。在2930 cm-1处的峰,是由于脂肪族CH2中非对称和对称的C-H键伸缩频率引起的,并且它们是多糖的典型吸收峰[12]。以羧基为特征的糖醛酸可能会引起三个吸收峰[13]:1750 cm-1处的吸收峰是由于质子化了的C=O键的伸缩振动引起的,1620 cm-1和1420 cm-1处的峰是质子化的羧酸COO-基团的吸收峰,因此,PCP1~5都是含有糖醛酸的酸性多糖,同时在1620 cm-1附近的吸收峰,从PCP1到PCP5,它的吸收是逐渐加强的,在水提的样品中主要含半乳糖醛酸,而进一步碱提的样品中含有相对较多的葡萄糖醛酸,这个结果与上述单糖组成分析的结果相符。1045 cm-1附近的强吸收峰证明,单糖是以吡喃糖苷的形式存在的。以上均为多糖的典型结构,说明多花黄精多糖水提的和进一步碱提的样品都是吡喃环酸性多糖。
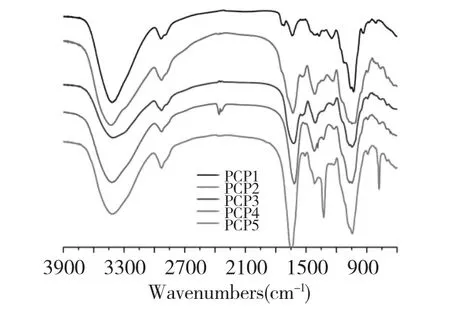
图2 多花黄精多糖的红外光谱图Fig.2 FT-IR spectra of the five polysaccharides isolated from the rhizomes of P.cyrtonema
2.4 核磁波谱分析
由于存在种类较多的连接单元,以致碳谱中的峰重叠现象比较明显,无法精确地归属每种连接单元中C1~C6的化学位移。
PCP1的13C NMR图谱(图3)中 δ(ppm)104.042、δ103.873、δ103.740、δ103.279、δ103.177、δ92.228六个异头碳C1的信号中,在δ103以上的有五个较强的吸收峰,在δ103以下的只有一个弱吸收峰,说明PCP1中的异头碳构型五种为β型,一种为 α 型[14],说明该糖含有六种糖残基。δ81.169、δ80.287、δ76.882、δ74.495、δ72.517、δ62.348、δ60.599处的信号为糖上的其他碳信号。δ27.614和δ23.940处为CH3CON中CH3的共振信号。约δ18处未出现碳信号,说明PCP1中没有鼠李糖的存在,以上分析结果与单糖组成分析结果一致。δ20.355和 δ16.881为-CH3的共振讯号。PCP1的1H NMR图谱(图4)中C1上的质子H1的强吸收峰在 δ4.582,还有一个非常弱的信号大于 δ5.0,说明PCP1的异头碳构型主要是β型,有少量α型,这与13C NMR谱的结果吻合。其他氢的化学位移重叠在δ3.3~3.9区域内,更精确的结构尚待进一步研究。
PCP3和 PCP5的13C NMR图谱(图 3)和1H NMR图谱(图4)比较相近。PCP3的13C NMR图谱中 δ107.661、δ107.625、δ104.530、δ104.570 四个异头碳C1的强吸收峰,和PCP5的13C NMR图谱中δ107.574、δ104.460 两个异头碳 C1 的强吸收峰都在δ103以上,说明PCP3和PCP5的异头碳构型为α型,PCP3含有四种糖残基,而PCP5含有两种糖残基。糖上的其他碳信号重叠在 δ60-84区域内。PCP3和PCP5的1H NMR图谱中C1上的质子H1的δ大于5.0,再次验证了PCP3和PCP5的构型为α型,其他氢的化学位移重叠在δ3.3-3.9区域内。

图3 多花黄精多糖PCP1、PCP3和PCP5的13 C核磁共振波谱图Fig.3 13 C NMR spectra of the polysaccharides PCP1,PCP3 and PCP5 isolated from the rhizomes of P.cyrtonema
2.5 热稳定性分析
多糖的实用性能不仅与他们的化学特性有关,在很大程度上还依赖于他们的热学性能,热分析试验可以测定多种热学参数,帮助我们认识和预测多糖的热稳定性能[15]。多糖样品PCP1~PCP5的热重分析TGA曲线如图5,它记录了多糖在加热的过程中质量的损失情况。多糖样品PCP1~PCP5的TGA曲线都表明降解发生了四个阶段:从室温到115℃为降解的第一阶段,大约有10%的质量损失,主要是由于水分的流失;第二阶段是大分子聚合物的降解,PCP1~PCP5的初始降解温度分别为230、205、205、205和192℃,在此期间PCP1~PCP5的质量损失大约为20%、30%、32%、30%和35%,;第三阶段大约从300℃到500℃,当温度达到530℃时,PCP1~PCP5的质量损失分别为55%、62%、63%、70%和75%;慢慢地随着温度的升高,多糖样品就成为碳化结构。
第二和第三阶段的数据表明多花黄精多糖的降解主要发生在第二阶段和第三阶段,PSP5样品从192℃就开始降解,到243℃时质量损失达到40%,相反PCP1样品初始降解温度在230℃,到第二阶段降解完成,质量损失了30%,PCP2、3、4的热分析曲线相似,介于PCP1和PCP5之间,与进一步碱提的样品相比,水提样品的初始降解温度高,主链的断裂温度高,并且质量损失率小,所以水提多糖的热稳定性明显高于进一步碱提的多糖,并且NaOH溶剂的浓度越高,提取得到的黄精多糖样品热稳定性越差。结合分子量分布曲线图(图1)可以看出,进一步碱提的样品分散度非常高,分子链长短分布不均匀不集中,影响了聚合物的稳定性,这一结果与热分析数据相一致。
3 结论
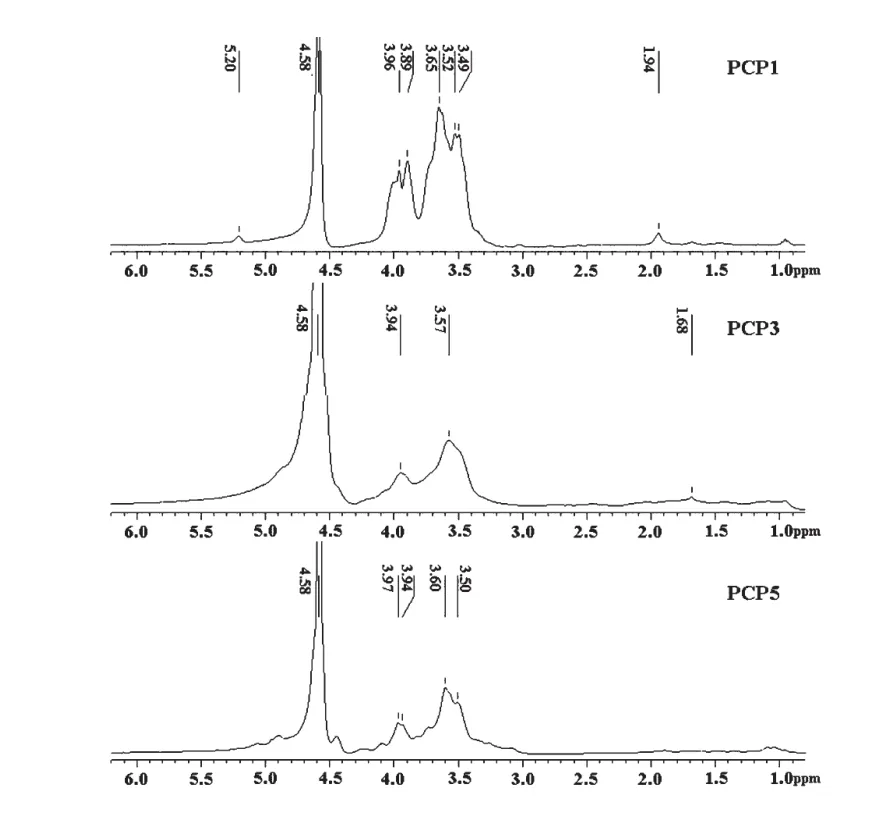
图4 多花黄精多糖PCP1、PCP3和PCP5的1 H核磁共振波谱图Fig.4 1 H NMR spectra of the polysaccharide PCP1,PCP3 and PCP5 isolated from the rhizomes of P.cyrtonema
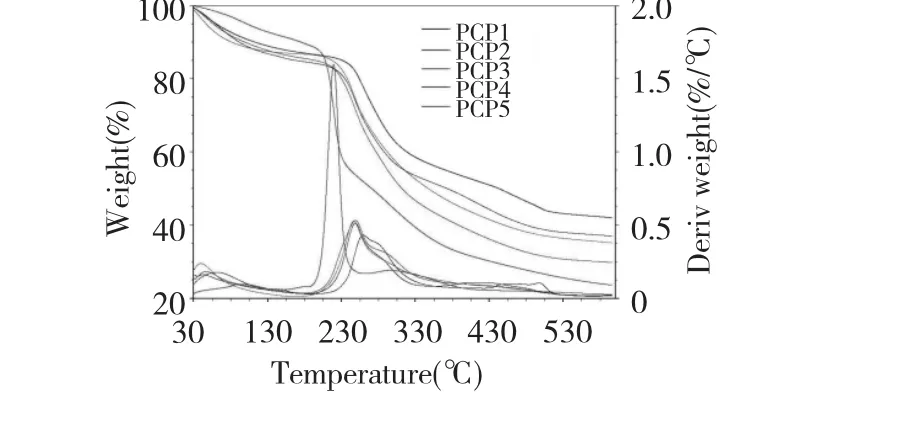
图5 多花黄精多糖的热重分析曲线Fig.5 TGA curves of the five polysaccharides isolated from the rhizomes of P.cyrtonema
本文采用分级提取的方法,用热水和进一步碱液提取多花黄精,得到五种多糖样品(PCP1、PCP2、PCP3、PCP4和PCP5)。单糖组成分析结果表明,水提和进一步碱提得到的样品在单糖相对含量上呈现出了显著的差异,水提的样品中,半乳糖、甘露糖、葡萄糖和半乳糖醛酸的相对含量较高;而进一步碱提的样品中,阿拉伯糖和半乳糖的相对含量得到了很大的提高,可以达到总量的80%,而葡萄糖、甘露糖和半乳糖醛酸的相对含量降低了。红外光谱结果显示多花黄精多糖是含有吡喃环的酸性多糖。
通过水提和进一步碱提得到的五个样品都含有一定量的糖醛酸,糖醛酸的存在可能是许多酸性多糖具有特征生理活性的重要原因之一[16],这为多花黄精多糖进一步进行构效关系的研究提供了理论依据。
分子量和热稳定性分析表明,与水提的样品相比,进一步碱提得到的样品分散度高,分子链长短分布不均匀,热稳定性较差,并且提取时碱液浓度越高,热稳定性越差。核磁共振分析提供了更多的结构信息,13C NMR进一步表明PCP1的异头碳构型主要是β型,有少量α型,含有六种糖残基,而进一步碱提得到的PCP3和PCP5的异头碳构型为α型,PCP3含有四种糖残基,PCP5含有两种糖残基。
1 Chinese Pharmacopoeia Commission(国家药典委员会).Pharmacopoeia of the People’s Republic of China(中华人民共和国药典).Beijing:China Medical Science Press,2004.Vol I,215.
2 Huang ZG(黄赵刚),Liu ZR(刘志荣),Xia Q(夏泉),et al.Comparison of polysaccharide in Polygonatum sibiricum from different places.Lishizhen Med Mater Med Res(时珍国医国药),2003,14:526-527.
3 Jiang H(江华).The study of anti-tumor activity of Rhizoma polygonati.JNanjing Univ Tradit Chin Med(南京中医药大学学报),2010,26:479-481.
4 Gao Y(高英).Research on hypoglycemic effect of traditional Chinesemedicine and extract of active ingredients of Polygonatum sibiricum with lowing glucose.Chongqing:Southwest University(西南大学),MSc.2010.
5 Yan WL(晏为力),Pu Q(蒲蔷),Meng YW(蒙义文).Preparation of sulfates of two Polygonatum polysaccharides&their antiviral activities.Nat Prod Res Dev(天然产物研究与开发),2000,12(5):60-65.
6 Hu JY(胡娇阳),Tang F(汤锋),Cao HQ(操海群),et al.Antifungal activities of Polygonatum cyrtonema extracts against post-harvest pathogens of fruits.Plant Pro(植物保护),2012,38(6):31-34.
7 Zhang XH(张晓红),Gereltu BJH(博·格日勒图),Zhao RGT(昭日格图),et al.Determination of relative molecular mass and composition for Polygonatum sibiricum polysaccharide by high performance liquid chromatography.Chin J Chromatogr(色谱),2005,23:394-396.
8 Wu QR(吴群绒),Hu S(胡盛),Yang GZ(杨光忠),et al.Separation,purification and structural studies of polysaccharides from Polygonatum kingianum.Chem Ind Forest Prod(林产化学与工业),2005,25(2):80-82.
9 Wang K,Yang HY,Xu F,et al.Structural comparison and enhanced enzymatic hydrolysis of the cellulosic preparation from Populus tomentosa Carr.by different cellulose-soluble solvent systems.Bioresour Technol,2011,102:4524-4529.
10 Xu XX(徐晓霞),Li Y(李炎),Liu H(刘华),et al.Determination of molecular weight(Mw)and weight distribution(Mw distribution)in Polygonatum cyrtonema Hua.polysaccharides by HPLC.Sichuan J Physiol Sci(四川生理科学杂志),2008,30:102-103.
11 Liu L,Dong Q,Dong XT,etal.Structural Investigation of Two Neutral Polysaccharides Isolated from Rhizome of Polygonatum Sibiricum.Carbohydr Polym,2007,70:304-309.
12 Leal D,Betty M,Miriam R,et al.FT-IR spectra of alginic acid block fractions in three species of brown seaweeds.Carbohydr Res,2008,343:308-316.
13 Zhao MM,Yang N,Yang B,et al.Structural characterization of water-soluble polysaccharides from Opuntia monacantha cladodes in relation to their anti-glycated activities.Food Chem,2007,105:1480-1486.
14 Bubb WA.2003.NMR spectroscopy in the study of carbohydrates:Characterizing the structural complexity.Concepts in Magnetic Resonance Part A,2003,19:1-19.
15 Akbar J,Iqbal MS,Massey S,et al.Kinetics and mechanism of thermal analysis degradation of pentose-and hexose-based carbohydrate polymers.Carbohydr Polym,2012,90:1386-1393.
16 Lin Q(林启),et al.The Chemical Composition of Chinese Herbal Medicine(中草药成分化学).Beijing:Science Publishing House,1977.113-140.
