ALZHEIMER病PET显像剂研究进展
2014-05-16唐彩华胡孔珍唐刚华
唐彩华,胡孔珍,唐刚华
(1.中山大学附属第一医院 核医学PET/CT中心 广东 广州510080;2.中山大学附属第五医院 核医学科 广东 珠海519000)
Alzhei mer病(AD)是原因不明的渐进性中枢神经系统退变性疾病,是最为常见的痴呆病。临床上首先表现为近期记忆力降低,继而表现持续性智能衰退,失语,判断推理能力丧失,以及运动功能障碍等。AD多在60岁以上发病,在65岁以上的人群里,中重度AD的发病率为5%,而在80岁以上的人群中发病率高达20%,美国大约现有400万以上的AD患者[1]。我国人口渐趋老龄化,AD的发病率将不断提高。确诊AD主要依靠死后尸检发现脑内老年斑、神经原纤维缠结、神经元变性缺失等病变。随着AD临床表现和生物学研究的进一步发展,逐渐将AD视为一个包括轻度认知功能障碍(mil d cognitive i mpair ment,MCI)、可能AD(probable AD)在内的疾病连续过程,这一疾病过程需要多年,AD早期诊断有利于早期治疗和干预,阻止AD的进一步发展,对提高老年人的生活质量,减轻家庭及社会负担具有重要意义。目前,正电子发射断层(PET)显像技术在临床的广泛应用,为活体内早期无创性显像诊断AD提供了途径,而PET显像的成功应用主要依赖于优良的显像剂。本文对近年来应用于AD的PET显像剂的研究进展进行综述。
1 AD的病理变化和形成原因
AD病理改变以老年斑、神经纤维缠结和突触变性、皮质及皮质下神经元变性、缺失为特征,其中特征性改变为神经细胞之间形成大量老年斑和神经细胞内出现神经原纤维缠结。典型老年斑为中心淀粉样蛋白丝聚集,周围有营养不良的神经突起,活化的星形胶质细胞和小胶质细胞围绕而成的致密纤维斑块。老年斑主要成分是β-淀粉样蛋白(Aβ),神经原纤维缠结是由许多互相缠绕的、成对螺旋状结构的细丝组成,其主要成分是过度磷酸化的tau蛋白。
AD的病因不明,可能包括遗传因素、环境毒素及慢性感染等多种原因[2]。目前以淀粉样蛋白级联假说 (amyl oid cascade hypot hesis)[3]被广泛接受,假说认为过度聚集β淀粉样蛋白(Aβ)启动了一系列的病理生理过程,最终导致神经元的死亡和蛋白质的异常聚集,包括淀粉样蛋白斑和神经纤维缠结(NFT)。Aβ是淀粉样前体蛋白 (APP)经过分泌酶切割后的产物,APP是一种跨膜的单链糖蛋白,起始于细胞膜外侧,终止于跨膜区,通过α分泌酶加工通路和β分泌酶加工通路代谢。α通路产生可溶性多肽α-APP,具有神经营养和保护作用;β通路由β分泌酶在APP671与672氨基酸残基之间切断,然后进行γ分泌酶加工,形成β-APP(Aβ)。APP基因突变会使APP加工过程发生改变,形成更多Aβ。Aβ的毒性作用与Aβ产生过剩和可溶性Aβ清除减少有关。Aβ一旦聚集为淀粉样蛋白斑块后就会引起一系列神经毒性连锁反应:包括氧化应激,兴奋性神经毒性,tau蛋白的过度磷酸化继而导致神经纤维缠结,刺激小胶质细胞活化。活化的小胶质细胞可分泌大量细胞毒性物质,如蛋白溶解酶、促炎因子、补体、活性氧代谢产物和一氧化氮等,导致神经细胞变性、凋亡,引起脑萎缩。大量神经细胞的变性和缺失,导致多条神经递质通路包括胆碱能递质系统、5-羟色胺递质系统、多巴胺递质系统、阿片受体系统、组胺系统等的功能下降,从而导致认知和行为能力的下降,临床上表现为痴呆,其大致过程示于图1。从图1中可知,Alzhei mer病形成的多个环节,如糖代谢下降、Aβ蛋白聚集、神经炎症、神经递质系统等均可作为PET显像剂研制的靶点。
2 AD PET显像剂
研究者们根据AD的病理变化及病理生理学变化过程,设计了多种PET显像剂用于AD的诊断及鉴别诊断[4-6]。大致可分为:(1)糖代谢类显像剂;(2)β淀粉样蛋白(Aβ)结合类显像剂;(3)tau蛋白结合类显像剂;(4)神经递质及受体类显像剂;(5)小胶质细胞活化的神经炎症类显像剂;(6)细胞凋亡类显像剂。目前已进入临床研究阶段的显像剂列于表1。

图1 Alzhei mer病形成的淀粉样蛋白级联假说Fig.1The amyloid cascade hypothesis of the f or mation of Alzhei mer’s disease

表1 用于AD显像的PET显像剂Table 1The summary of PET i maging agents For Alzheimer’s disease
2.1 糖代谢类PET显像剂
葡萄糖是人脑代谢的主要能源,18F-FDG是葡萄糖的类似物,是临床上广泛应用的反映细胞内糖代谢水平的PET显像剂。18F-FDG与天然葡萄糖代谢途径类似,均能被细胞膜上的葡萄糖转运体结合后转运到细胞内,在己糖激酶的作用下磷酸化,生成6-PO4-18F-FDG 后,由于结构上的差异,不能进一步代谢而较长时间滞留在细胞内。痴呆病人的大脑皮质神经元变性、丢失而出现萎缩,AD病人18F-FDG PET表现为单侧或双侧顶叶或颞顶叶皮质及扣带回的代谢减低;同时可伴有双侧额叶或额叶的代谢减低;18F-FDG PET可用于AD的诊断、疾病严重程度判断、疗效评估以及和其他能引起痴呆样症状的其他脑退行性性病变鉴别[4-7]。但是对于临床上AD早期病人的诊断尚缺乏特异性。
2.2 β淀粉样蛋白斑结合类PET显像剂
β淀粉样蛋白斑是AD主要的病理学改变。组织学染色剂刚果红、吉姆萨、硫磺素-T能和淀粉样蛋白非特异性的结合而使之显色。20世纪90年代中期,研究者设计了一系列能和Aβ结合的正电子显像剂,其化学骨架主要来源于刚果红和硫磺素-T等组织类染色剂,括氨基萘类、苯噻嗪类、二苯烯类和咪唑吡啶四大类。过去的10年间,很多11C和18F标记的β淀粉样蛋白类显像剂已经进入临床研究。其中11C标记的显像
剂主要包括11C-PIB、11C-SB-13,11C-BF-227、11C
ADZ2184及11C-ADZ4694等。18F标记的β淀粉样 蛋 白 显 像 剂 主 要 有18F-FDDNP、18F-3’-FPi B、18F-ADZ4694 以 及18F-AV-1、18F-AV-45等[4,8],化学结构式示于图2。

图2 用于临床的β淀粉样蛋白斑结合类PET显像剂分子结构式Fig.2The chemical structural for mula of PET imaging agents for beta amyloid plaques
18F具有较长半衰期(110 min)、衰变产生的正电子湮没前在组织中的射程短、图像空间分辨率高等特性,在临床应用方面比11C更有前景。18F-3’-FPIB 又 名18F-Fl utemetamal 或18FGE067,是11C-PIB的类似物,具有和11C-PIB相似的经肝胆排泄的动力学特点[12]。正常人和AD患者的II期临床实验研究表明,18F-3’-FPIB和11C-PIB对同一患者脑内β淀粉样蛋白斑结合能力相似,而且重复性好,提示18F-3’-FPIB比11C-PIB有更好的临床和研究用途[13-14]。18F-AV-1 和18F-AV-45 是 近 年 来 研 发的二苯烯类β淀粉样蛋白显像剂。18F-AV-1又名18F-Florbetaben,能选择性与AD患者脑组织内的淀粉样蛋白斑结合,与NFT、Pick小体、Lewy小体等不结合。18F-Florbetaben PET显像的临床实验表明,18F-Flor betaben可用于鉴别AD、额颞叶痴呆和正常人[15]。18F-AV-45又名18F-Fl or betapir,18F-AV-45的药代动力学性能良好,临床III期实验表明,18F-AV-45对AD患者脑内Aβ斑显像的图像信噪比高[16]。是美国食品药品监督管理局(FDA)批准的第一个用于老年痴呆诊断的放射性药物。此外,在11CADZ4694基础上研制的18F-ADZ4694,对同一AD的显像研究表明,18F-ADZ4694与11C-PIB对AD显像性能一致,由于18F-ADZ4694用半衰期更长18F标记,比11C-PIB更有临床应用前景[17]。
2.3 tau蛋白结合类PET显像剂
神经纤维缠结(NFT)是AD患者脑内另一个重要的病理特征,是由过度磷酸化的tau蛋白组成成对螺旋形纤维(PHF-tau)互相缠绕形成的。tau蛋白是正常神经轴突内微管相关蛋白,能稳定微管、调节细胞骨架的稳定性并能促进神经生长。在病理条件下(如AD),tau蛋白出现异常磷酸化并自我聚集。tau蛋白的异常程度和NFT量与AD患者的认知障碍及神经通路恶化程度密切相关。目前用于临床研究的能与PHF-tau蛋白结合的正电子显像剂有18F-T807和18F-T808、11C-PBB3等,化学结构式示于图3。David 等[18-19]首次将18F-T807、18F-T808应用于 AD的临床研究,18F-T807、18F-T808能特异性的与NFT-tau结合,而不与β淀粉样蛋白斑结合,正常脑组织内结合很低,几乎不和脑白质结合且具有良好的药代动力学性质。临床研究显示,随 AD病情进展,18F-T807、18F-T808在脑内的浓聚逐步增高,是有应用前景的用于AD患者早期诊断的PET显像剂。Masahir o等[20]研制的11C-PBB3是 PBBs(phenyl/pyridinyl-butadienyl-benzot hiazoles/benzot hia-zoliu ms)类与tau蛋白结合的AD类显像剂,在临床PET研究中,11C-PBB3在AD患者脑内海马处浓聚,而此处异常磷酸化的tau蛋白聚集最多的,PET显像发现11C-PBB3和11C-PIB一样其浓聚程度和AD病情进展程度密切相关,11CPBB3可能更有临床应用前景。
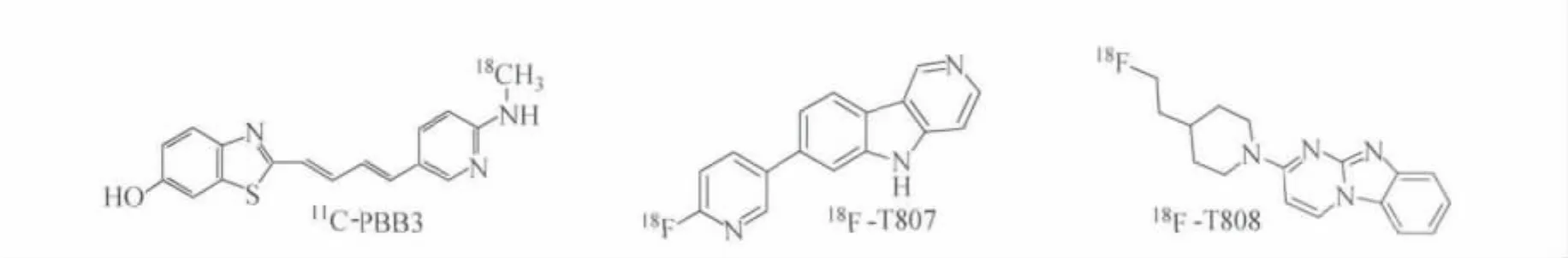
图3 用于临床的tau蛋白结合类PET显像剂分子结构式Fig.3The chemical structural for mula of PET i maging agent f or tau proteins
2.4 神经递质系统相关的PET显像剂
AD患者脑内多条神经递质系统受累,包括胆碱能神经递质系统、5-羟色胺能神经递质系统、肾上腺素能递质系统、阿片受体、以及组胺等神经递质系统,由于神经元的变性、缺失引起相应的神经递质合成减少,神经递质受体功能下调等改变。其中以胆碱能系统最明显,AD的中枢胆碱能系统变化以基底前脑胆碱系统最明显,包括Meynert基底核和内侧隔核,它们投射到海马和大脑皮层的广泛区域,AD患者的基底前脑胆碱能神经元约有90%丧失,神经生物化学研究显示,AD患者乙酰胆碱(ACh)的合成减少,乙酰胆碱酯酶(ACh T)活性下降,且与痴呆的严重程度密切相关。反映乙酰胆碱酯酶(ACh T)活性的PET显像剂主要有11C-MP4 A,11C-MP4P,11C-Donepezil。 Alessandra等[21]用11C-MP4 A对10例遗忘性轻度认知障碍(a MCI)、7例可能性AD(p AD)和有Lewy小体的痴呆(DLB)进行PET显像,结果表明,在AD的早期阶段即a MCI阶段已经出现了广泛的乙酰胆碱酯酶的活性下降。
胆碱能系统缺陷不能单纯理解为含有ACh的神经元缺陷,胆碱能突触前受体在突触传递中起放大作用,且控制其他神经递质的释放。研究表明,AD患者脑内胆碱能神经末梢突触前烟碱型N受体和毒蕈碱型M2受体数量减少,而突触后受体(M1,M3)则相对保存完好,这些受体的变化很可能影响信息传递,导致痴呆的发生。PET显像剂11C-Nicotine和11C-Beztropine分别能和胆碱能神经突触前膜的N受体和M2受体结合而显像,从而能从分子水平上对AD的胆碱能系统功能进行评价[22]。
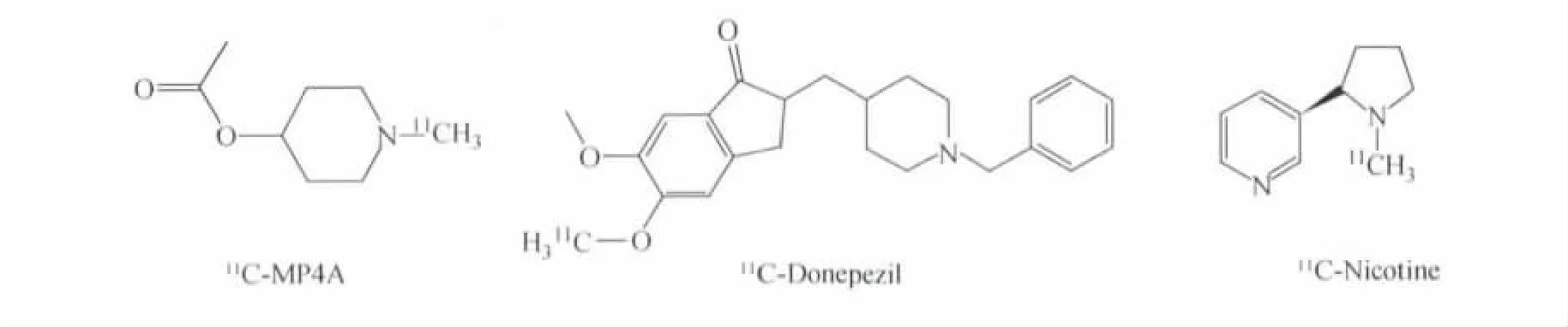
图4 用于临床的胆碱能神经递质系统相关的PET显像剂分子结构式Fig.4The chemical str uctural for mula of PET i maging agent for Cholinergic neurotransmitter systems
5-羟色胺神经递质系统与AD的神经精神症状,尤其是抑郁症状密切相关。在AD中,5-羟色胺神经递质系统功能下降已经被AD尸检病理和临床研究得到证实。尸检病理发现AD大脑皮层、颞叶内带、中缝核的等区域的5-羟色胺神经元丢失、神经突触减少、突触前膜的5-羟色胺转运体(5-HTT)以及突触后膜的5-羟色胺受体(包括5-HT1A、5-HT2A亚型)有明显下降,目前的研究表明,5-HT2A在AD的早期遗忘性认知功能障碍(a MCI)阶段就有下调。11C-DASB和18F-Altanserin是能分别和5-HTT、5-HT2A特异性结合的PET显像剂(分子结构式示于图5),通过PET显像能在活体显示AD脑内5-羟色胺神经递质系统改变。Lisbeth Marber等[23]将11C-DASB和18F-Altanserin用于 AD患者和健康对照者PET显像,结果表明,18F-Altanserin显示的5-HT2A下降在除丘脑外的脑内广泛区域均比正常人明显,而11C-DASB显示的5-HTT在AD脑内下降区域主要位于颞叶内侧和枕叶、前额叶皮质,并且下降的程度不等,提示在AD病程中5-HT2A下调要早于5-HTT。

图5 用于临床的5-羟色胺神经递质系统结合PET显像剂分子结构式Fig.5The chemical str uctural f or mula of PET i maging agent for 5-serotonin neurotransmitter systems
近年来还有一些反映AD脑内其他神经递质系统功能改变的PET显像剂的研究报道,包括能与组胺H1受体结合[24]、肾上腺素A1受体结合[25]、Sig ma 1 受 体 结 合 的[26]其 他 结 合 型 显像剂,提供了观察AD早期脑内病理生理变化的窗口。
2.5 神经炎症类PET显像剂
小胶质细胞介导的慢性炎症在AD的发病过程中起重要作用。尸检病理表明在β淀粉样蛋白斑的周围有活化的小胶质细胞浸润。小胶质细胞属于单核巨嗜细胞系统,活化的小胶质细胞能吞噬沉积的β淀粉样蛋白,在发挥保护作用的同时,持续活化的小胶质细胞能分泌炎症类细胞因子,肿瘤坏死因子α、活性氧代谢产物、一氧化氮等引起慢性炎症,发挥神经毒性作用,促进神经元退行性改变。在神经炎症过程中,小胶质细胞释放的炎症类细胞因子能与星形细胞膜上的细胞因子受体结合,并与细胞溶质型磷酸酶(c PLA2)和分泌型磷酸酶(s PLA2)偶联而使其活化,这些酶的活化后水解细胞膜磷脂上花生四烯酸(AA)。在AD脑内AA的代谢上调,AA的参入系数(K*)增高。11C-AA可以通过测定AD脑内花生四烯酸的K*来评估神经炎症反应程度。Gluseppe Esposito等[27]将11C-AA 应用于8例AD和9例正常对照者脑显像,结果表明,对脑容积进行萎缩校正后,AD患者整个大脑灰质的AA参入系数较对照组提高了26%,尤其在有淀粉样蛋白斑和活化的小胶质细胞皮层、海马和小脑扁桃体区域更明显。
另外,活化的小胶质细胞表达外周苯二氮卓受体(PBR)增加,这种受体是一种相对分子质量量为18 KD的转定位蛋白(TSPO),能和外周苯二氮卓受体特异性结合的PET显像剂,可以直接显示活化的小胶质细胞。目前研制成功的PBR PET显像有11C-PK11195、11C-DAA1106、11CPBR28、11C-DPA713、11C-DAA1106、11C-vinpocetine、11C-DA5216、18F-PBR、18F-DPA714、18FPBR111、18F-FEDAA1106 及18F-PK11195 等,分子结构式示于图6,其中,11C-PK11195目前广泛应用于评价脑内小胶质细胞活化的显像剂,在AD、额颞叶痴呆和Pakinson病等其他神经退行性痴呆中,大脑边缘系统和皮质中均可见11CPK11195摄取增加。最近的一项研究表明,在MCI中,50%的病例11C-PK11195摄取增加[28]。Fu mihiko Yasuno等[29]用11C-DAA1106对 MCI患者进行显像,随访观察发现最终转化为AD的患者脑内11C-DAA1106摄取高于不转化为AD的患者,而且在 MCI脑内的11C-DAA1106摄取高于已经明确诊断为AD的患者,表明小胶质细胞的活化在出现临床痴呆症状之前就已经存在,11C-DAA1106可用监测早期AD病人的疾病进展情况。

图6 部分和外周苯二氮卓受体结合的PET显像剂分子结构式Fig.6The chemical str uctural f or mula of PET i maging agents for peripher al benzodiazepine receptor
2.6 神经细胞凋亡类PET显像剂
根据AD形成的淀粉样蛋白瀑布假说,Aβ聚集为淀粉样蛋白斑块后引起一系列连锁反应最终导致神经细胞发生变性、凋亡,在AD发病过程中,神经元的凋亡将会增加,提示能与凋亡细胞膜上暴露的磷脂酰丝氨酸结合的PET显像剂也可用于AD进行显像。目前这方面研究报道较少。本课题组合成的18F-DPAZn2和 Annexin V一样能和凋亡细胞膜上暴露的磷脂酰丝氨酸结合,对AD转基因鼠进行18F-DPAZn2显像,发现AD转基因鼠脑内18F-DPAZn2摄取较正常鼠增高(相关结果待发表),提示18FDPAZn2可能应用AD显像。
3 结语
总之,由于AD发病机理和病理变化研究取得的成果,大大推动了相关正电子显像剂的研究进展。对于AD的诊断,以糖代谢显像剂18FFDG的应用最早、最成熟;目前,β淀粉样蛋白斑及tau蛋白结合类PET显像剂、神经递质及受体类PET显像剂、小胶质细胞活化类PET显像剂的研发进展迅速,其中,以β淀粉样蛋白斑及tau蛋白结合类显像剂和小胶质细胞活化类PET显像剂最有应用前景,11C、18F标记的很多PET显像剂已经进入临床II、III期实验,有望在不久的将来应用于临床常规检查。神经递质及受体类PET显像剂及凋亡类PET显像剂也可望用于AD PET显像。
但是,尚存在以下主要问题:(1)很多显像剂对于AD的诊断缺乏特异性,其显像结果与其他神经系统退变性疾病部分重叠;(2)进入AD临床研究的PET显像剂较多,但大部分研究病例数较少,缺乏大规模的临床应用研究。因此,在研制新型特异性更高、药代动力学特性更优良的PET显像剂、以及进行更大规模的临床研究方面需要进一步努力,为AD的早期诊断和疗效监测提供更加优良的PET显像剂,为广大AD患者及家人带来福音。
[1]Hebert LE,Scherr PA,Bienias JL,et al.Alzhei mer disease in the US population:Prevalence esti mates using the 2000 census[J].Arch Neurol,2003,60:1 119-1 122.
[2]Gatz M,Reynolds CA,Fratiglioni L,et,al.Role of genes and environ ments f or explaining Alzhei mer disease[J].Arch Gen Psychiatr y,2006,63:168-174.
[3]Selkoe DJ.Toward a co mprehensive theor y f or Alzhei mer’s disease.Hypothesis:Alzhei mer’s disease is caused by the cerebral accumulation and cytotoxicity of amyloid beta-pr otein[J].Ann N Y Acad Sci,2000,924:17-25.
[4]Shankar Vallabhajosula.Positron Emission Tomography Radiophar maceuticals f or Imaging Brain Beta-Amyloid[J].Seminars in Nucl Med,2011,41(4):283-299.
[5]Meredit h N,Braskie,Arthur W,et al.Recent Advances in Imaging Alzhei mer’s Disease[J].Jour nal of Alzhei mer’s Disease,2013,33:313-327.
[6]Kjell N,Christer H,Juha OR,et al.Radiophar maceuticals for positron emission tomography investigations of Alzhei mer’s disease[J].Eur J Nucl Med Mol Imaging,2010,37:1 575-1 593.
[7]Mosconi L.Brain glucose metabolism in the early and specific diagnosis of Alzhei mer’s disease FDGPET studies in MCI and AD[J].Eur J Nucl Med Mol Imag,2005;32:486-510.
[8]Lisheng C,Robert BI,Victor W.Pike Radioligand Develop ment f or PET Imaging ofβ-Amyloid (Aβ)-Current Status[J].Current Medicinal Chemistr y,2007,14:19-52.
[9]Rik O,Nelleke T,Jessica C,et al.Longitudinal imaging of Alzhei mer pat hology using[11C]PIB,[18F]FDDNP and [18F]FDG PET[J].Eur J Nucl Med Mol Imaging,2012,39:990-1 000.
[10]Brück A,Virta JR,Koivune Jn,et al.[11C]PIB,[18F]FDG and MR imaging in patients with mild cognitive i mpair ment[J].Eur J Nucl Med Mol Imaging,2013,40:1 567-1 572.
[11]Anton F,Anders J,Zsolt C,et al.Low backgr ound and high contrast PET i maging of amyloidβwith [11C]AZD2995 and [11C]AZD2184 in Alzheimer’s disease patients[J].Eur J Nucl Med Mol Imaging,2013,40:580-593.
[12]Yukitsuka K,Nobuyuki O,Shozo F,et al.2-(2-[2-Di methylaminothiazol -5-yl]Et henyl)-6-(2-[Fluor o]Ethoxy)Benzoxazole:A Novel PET A-gent for In Vivo Detection of Dense Amyloid Plaques in Alzheimer’s Disease Patients[J].The Jour nal of Nuclear Medcine,2007,48 (4 ) :553-561.
[13]Nelissen N,Van Laere K,Thurfjell L,et al.Phase 1 study of the Pittsburgh compound derivative18F-flutemetamol in healthy volunteers and patients with probable Alzhei mer disease[J].J Nucl Med,2009,50,1 251-1 259.
[14]Shizuo H,Hideto mo Y,Yutaka S,et al.[18F]Flutemetamol amyloid-beta PET imaging compared with[11C]PIB across the spectr u m of Alzhei mer’s disease[J].Eur J Nucl Med Mol Imaging,2014,42(2):290-300.
[15]Victor L,Villemagne RS.Co mparison of11C-Pi B and18F-flor betaben f or Aβi maging in ageing and Alzhei mer’s disease[J].Eur J Nucl Med Mol Imaging,2012,39:983-989.
[16]Camus V,Payoux P,Barr L,et al.Using PET with18F-AV-45 (florbetapir)to quantify brain amyloid load in a clinical environ ment[J].Eur J Nucl Med Mol Imaging,2012,39:621-631.
[17]Christopher CR,Svetlana P.Head-to-Head Co mparison of11C-Pi B and18F-AZD4694 (NAV4694)for b-Amyloid Imaging in Aging and Dementia[J].The Jour nal of Nuclear Medcine,2013,54 (6):880-886.
[18]David TC,Shadfar BA,Katrin S,et al.Early Clinical PET Imaging Results with the Novel PHF-Tau Radioligand [F-18]-T807[J].Jour nal of Alzhei mer’s Disease,2013,34:457-468.
[19]David T,Chiena A,Katrin S,et al.Early Clinical PET Imaging Results wit h the Novel PHF-Tau Radioligand[F18]-T808[J].Journal of Alzheimer’s Disease,DOI 10.3233/JAD-130098.
[20]Masahiro M,Hitoshi S,Tetsuya S,et al.Imaging of Tau Pathology in a Tauopathy Mouse Model and in Alzhei mer Patients Co mpared to Nor mal Controls[J].Neuron 2013,79,1 094-1 108.
[21]Alessandra M,Valentina G,Rosa Maria M,et al.[11C]-MP4 A PET Cholinergic Measurementsin Amnestic Mild Cognitive Impair ment,Probable Alzhei mer’s Disease and Dementiawith Lewy Bodies:A Bayesian Method and Voxel-Based A-nalysis[J].Jour nal of Alzhei mer’s Disease,2012,31:387-399.
[22]Ah madul K,Ove A,Anders W,et al.PET i maging of cortical11C-nicotine binding correlates with the cognitive f unction of attention in Alzhei mer’s disease [J].Psychophar macology,2006,188:509-520.
[23]Lisbeth M,Vibe GF,Jan K,et al.Loss of serotonin 2 A receptors exceeds loss of serotonergic projections in early Alzhei mer’s disease:a co mbined[11C]DASB and[18F]altanserin-PET study[J].Neur obiology of Aging,2012,33:479-487.
[24]Manabu T,Hideki M,Kentaro I,et al.Roles of histamine in regulation of arousal and cognition:f unctional neuroi maging of histamine H1 receptors in human brain[J].Life Sciences,2002,72:409-414.
[25]Fukumitsu N,Ishii K,Kimura Y,et al.Adenosine A(1)receptors using 8-dicyclopropyl methyl-1-[(11)C]methyl-3-propylxanthine PET in Alzheimer's disease[J].Ann Nucl Med,2008,22(10):841-847.
[26]Mishina M,Ohyama M,Ishii K,et al.Low density of sig ma 1 receptors in early Alzhei mer's disease[J].Ann Nucl Med,2008,22(3):151-156.
[27]Giuseppe E,Giampier o G,Jeih-San L,et al.Imaging Neuroinflammation in Alzhei mer’s Disease with Radiolabeled Arachidonic Acid and PET[J].J Nucl Med,2008,49:1 414-1 421.
[28]Adriana T,Claudio P,Modesto de Candia,et al.Targeting of the Translocator Protein 18 k Da(TSPO):A Valuable Approach for Nuclear and Optical Imaging of Activated Microglia[J].Bioconjugate Chemistry,2013,24:1 415-1 428.
[29]Fu mihiko Y,Jun K,Miho O,et al.Increased binding of peripheral benzodiazepine receptor in mild cognitive i mpair ment–dementia converters measured by positr on emission tomography wit h[11C]DAA1106[J].Psychiatry Research:Neuroi maging,2012,203:67-74.
