不同生境红树林青蟹的稳定同位素组成及其产地溯源意义
2014-05-16郭婕敏林光辉
郭婕敏,林光辉
(1.清华大学深圳研究生院 海洋科学与技术学部,深圳518055;2.厦门大学 滨海湿地生态系统教育部重点实验室 环境与生态学院,厦门361005;3.清华大学 地球系统科学研究中心,北京100084)
随着全球人口消费水平的增长,对海产品的消费也不断增加[1],但传统的渔业捕获量已超过了可持续发展的规模[2]。与此同时,海产品人工养殖产量不断增加,已约占全球海产品总量的30%[3]。养殖水产品与野生种相比,养殖种在口感、品质和营养价值等方面与野生种有所不同。同时,在养殖过程中,各类有毒有害消毒剂和抗生素等药物的使用,使养殖水产品的品质和信誉受损。因而在市场销量和价格上都不及野生种,欧盟于2012年发布规定,所有的海产品必须标有来源信息,包括产地和生产方式(野生或人工养殖)[4]。
拟穴青蟹(scyll a parama mosain)是红树林生态系统中重要经济种,在福建和广东等省有已有大面积养殖。青蟹具有肉质含量高、味道鲜美、营养丰富、养殖效益好等特点,颇受国内外养殖者和消费者的青睐,为我国的重要海洋经济养殖蟹类之一。野生和人工养殖的青蟹在外观上很难辨别,目前还没有快速、准确的方法可以区分,市场上经常出现人工养殖的拟穴青蟹被冠名“原生态青蟹”或“野生青蟹”出售,损害了消费者的利益。稳定同位素检测技术结合矿质元素分析,是食品产地溯源的有效方法之一。动物组织的同位素组成受气候、生活环境、代谢类型和食物来源等因素的影响,不同种类及不同地域来源的动物组织同位素组成存在差异,利用这种差异可以区分不同种类的产品及其可能的来源地区[5]。本实验以福建云霄红树林不同生境拟穴青蟹为研究对象,比较了野生与人工养殖、不同组织、不同生长阶段以及不同季节拟穴青蟹的碳、氮稳定同位素组成,探讨控制拟穴青蟹组织同位素组成的可能因素,建立拟穴青蟹稳定同位素特征与产地环境因子的内在联系,为开展拟穴青蟹的产地溯源和产品鉴定提供科学依据。
1 材料和方法
1.1 实验材料
拟穴青蟹的样品分别于2009年10月、2010年4月、2010年11月取自漳江口红树林自然保护区红树林、保护区周边的拟穴青蟹养殖塘、云霄县南市青蟹销售商,样品的具体信息列于表1。
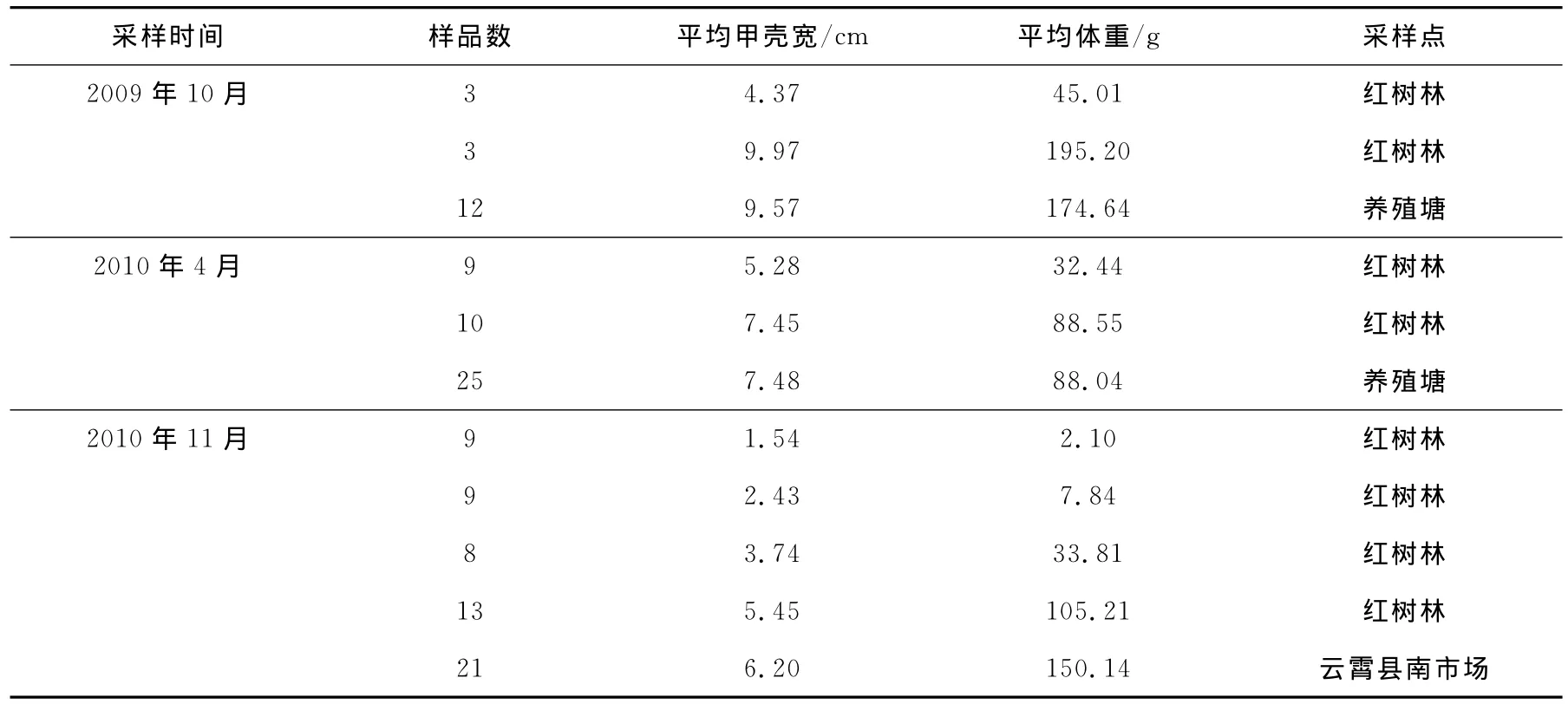
表1 采集的拟穴青蟹样品信息Table 1Sample infor mation f or S.par amamosain used in this study
1.2 样品处理与稳定同位素测定
对于肌肉样品,取其螯部肌肉,用蒸馏水冲洗,冷冻干燥36 h,研磨过60目筛,冷藏保存。对于鳃处理方法与肌肉相同,而蟹类肝脏不易和胰脏分离,因而取肝胰脏组织,用蒸馏水冲洗,冷冻干燥72 h,因其脂肪含量高,冻干之后呈半固体状,研磨混匀,取小部分于1 mL塑料离心管中,密封待测。
样品的稳定同位素比值在中国林科院稳定同位素比率质谱仪实验室测定。稳定碳、氮同位
式中,X 为样品13C或15N。R 为13C/12C或15N/14N。δ13C是相对于PDB(Pee Dee Belenite)标准,而δ15N是相对于大气中的氮气。分析精度:δ13C为0.1‰,δ15N 为0.2‰。
2 结果与讨论
2.1 拟穴青蟹不同器官的δ13 C和δ15 N比较
拟穴青蟹腮、肝胰脏和肌肉组织δ13C和δ15N的比较结果示于图1。由图1可见,δ13C在不同组织间具有显著差异,肝胰脏的δ13C比肌肉和腮低,主要由脂肪含量高造成[6-7]。另外,拟穴青蟹腮组织的δ13C显著高于肝胰组织的δ13C,但显著低于肌肉组织δ13C。动物组织的碳、氮同位素组成,还与组织物质代谢的周转速率有关[8]。周转速率慢的组织,反映较长一段时间动物的摄食历史,而代谢速率快的组织,反映动物短期内的食物组成。海洋无脊椎动物体中,腮的代谢活动较为活跃,腮组织的碳同位素组成可以反映出这种短时间(几小时到1天)改变。而肌肉组织则需要较长时间(几周到1个月)食物的同化不宜指示出较短时间内的食物改变[9]。与碳同位素不同,没有观测到组织间氮同位素比值的差异,因为动物体组织的δ15N主要反映所处的营养级,所以相同生境或养殖方式下同一动物不同器官间δ15N组成不会存在显著差异。
2.2 不同生长阶段拟穴青蟹的δ13 C和δ15 N比较
不同生长阶段拟穴青蟹肌肉组织δ13C和δ15N的比较结果示于图2。个体大小反映了个体的生长阶段。人工养殖所用拟穴青蟹幼苗采自红树林滩涂,甲壳宽约1.5 c m,重量约2 g。野生和人工养殖的成年个体处于同一个发育阶段,个体大小类似但均有较大的差异,甲壳宽约为5~8 c m、重量50~100 g。由图2分析表明,拟穴青蟹个体生长的4个不同阶段δ13C没有显著性差异(P>0.05),均在-15‰左右;δ15N也没有显著差异(P>0.05),约为15‰。有些动物在生长发育过程中,随着个体的增大可能会发生食性和栖息地的改变,如从底栖转变浮游或从河口转移到近海。伴随着这些变化,动物体的碳、氮同位素组成也会相应发生改变。例如,赤蠵龟(Caretta caretta)随着个体的增大,其碳氮同位素值都增大[10]。然而,本研究的拟穴青蟹在不同的生长阶段,碳、氮同位素组成并不存在显著差异,说明拟穴青蟹在幼蟹到成体蟹生活史阶段,食物的同位素组成相对一致,其所处的营养级也没有随着个体的增大而发生变化。拟穴青蟹的食性变化较大的阶段主要是其大眼幼体发育阶段[11],其他阶段一般不发生食性的改变。Demopoulos等[12]对Indo-Pacific红树林区的锯缘青蟹研究表明,红树林内的底上和底内动物是锯缘青蟹的主要食物来源。一般认为,随着个体的增大,δ15N 会随着增加[10],但 Kelly[13]的研究发现,随着动物个体的增大,动物δ15N并没有随着增加,在海洋哺乳类中,反而呈现显著负相关。Lay man等[14]研究也表明,动物组织的δ15N与个体大小间没有相关关系。因此,海洋动物的碳、氮同位素组成是否随个体(或年龄)的增大而改变,应根据种类而定。
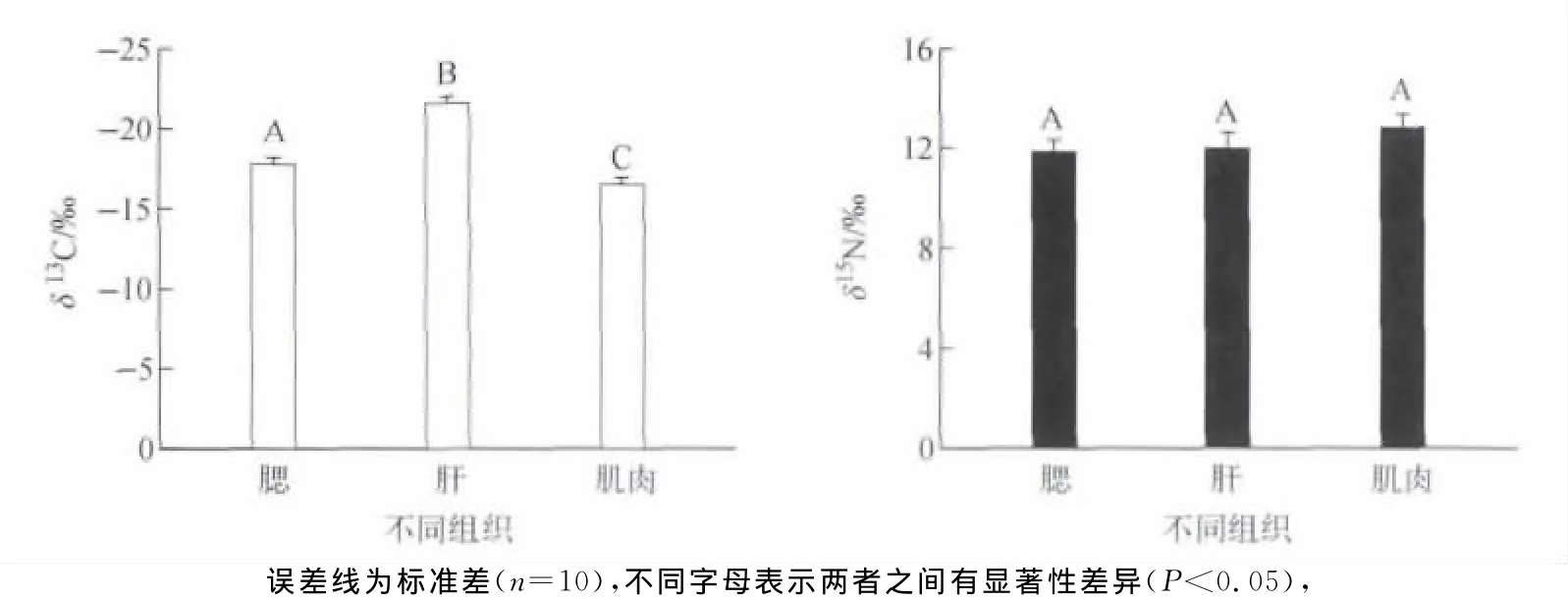
图1 拟穴青蟹腮、肝胰脏和肌肉组织δ13 C和δ15 N的比较Different letters denote significant difference at p<0.05Fig.1Theδ13 C andδ15 N values of gill,liver and muscle tissues of S.par amamosain.
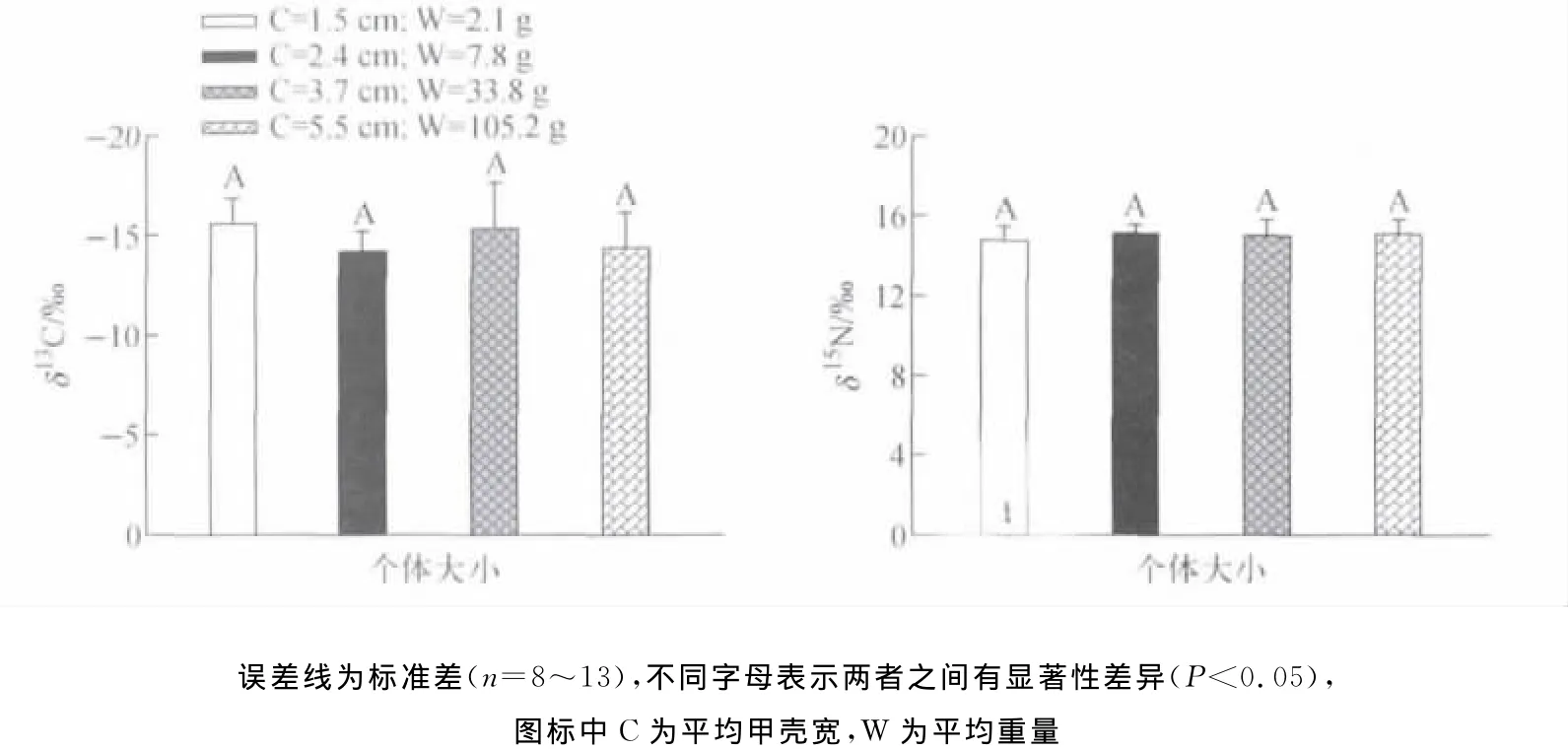
图2 不同生长阶段拟穴青蟹肌肉组织δ13 C和δ15 N的比较C represents average carapace widt h W represents average weight.Different letters denote significant difference at p<0.05Fig.2Theδ13 C andδ15 N values of muscle tissues from different body sizes of S.paramamosain.
2.3 不同生境和季节之间拟穴青蟹δ13 C和δ15 N的比较
比较了不同生境(即红树林区野生和人工养殖塘养殖)拟穴青蟹成体不同采样时间的δ13C和δ15N示于图3。在2009年10月,野生和养殖拟穴青蟹间δ13C差异达极显著水平(p<0.001),养殖塘养殖的拟穴青蟹与红树林区野生拟穴青蟹δ13C均差-3.7‰。然而,在2010年4月,野生和养殖拟穴青蟹δ13C非常接近,均值约为-16‰。在2010年10月,野生和养殖拟穴青蟹δ13C差异性不显著(P>0.05),但野生拟穴青蟹个体间差异较大,分布范围为-12.3‰~-17.2‰,而鱼塘养殖的拟穴青蟹其δ13C较为一致(-17.0‰~-16.0‰)。红树林区野生拟穴青蟹δ13C在取样时间之间存在显著差异(p<0.05),2009年10月与2010年10月红树林区野生拟穴青蟹样品的δ13C均高于4月份。推测这可能是因为4月份温度逐渐开始回升,拟穴青蟹摄食和活动能力开始增强,生长所需要的能量增多,利用了较多的植物性食物。根据野外的观察,春季里红树林生境内蟹类和螺类密度相对较低,拟穴青蟹较多摄食了藻类(δ13C约为-20‰)或互花米草(δ13C约为-15‰),这可以从春季拟穴青蟹的胃含物颜色较绿得到验证。而到了秋季,青蟹处于繁殖期,其摄食活动降低,摄食量低,主要依靠储藏的能量和摄食少量蟹和螺类,因而具有较高的δ13C和δ15N。而人工鱼塘养殖的拟穴青蟹在不同的采样时间上δ13C相对一致,均约为-16‰,反映了养殖青蟹的食物来源比较稳定。在红树林周围青蟹养殖塘中,主要投喂的饵料是商业渔船出海捕获的杂鱼和蛤蜊等,在其整个养殖过程中投喂的饵料不会发生大的改变,使鱼塘养殖的青蟹具有相当稳定的碳、氮同位素比值。2009年10月与2010年4月两次采样间,红树林区野生和养殖塘养殖的拟穴青蟹δ15N无显著性差异(p<0.05),但2010年10月红树林野生的拟穴青蟹δ15N显著高于鱼塘养殖的拟穴青蟹(p<0.001),分别为15.1±0.7‰和12.5±0.5‰。与δ13C类似,野生拟穴青蟹δ15N在不同采样时间之间存在显著差异(p<0.05)。然而,养殖塘养殖的拟穴青蟹δ15N在不同的采样时间上无显著性差异(P>0.05),均值约为13‰。
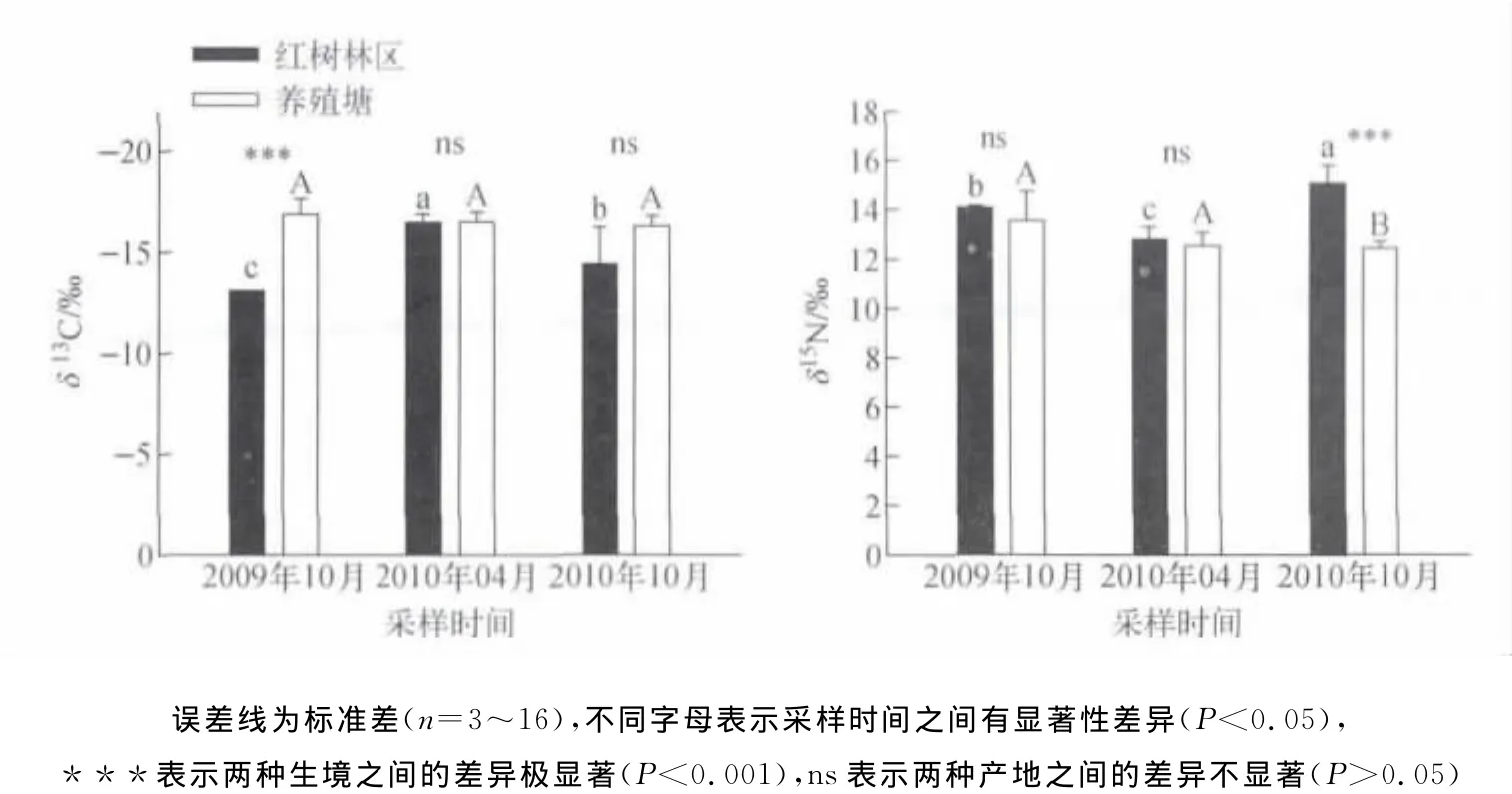
图3 不同采样时间不同生境拟穴青蟹肌肉组织的δ13 C和δ15 N比较Fig.3Theδ13 C andδ15 N values of muscle tissues from wild and f ar med S.paramamosain.Different letters denote significant difference at p<0.05 bet ween sampling ti mes,while***and ns represent highly significant difference at p<0.001 or no significant difference bet ween wild and far med crabs,respectively.
2.4 市场销售的拟穴青蟹产品δ13 C和δ15 N的比较
为了确定不同销售商提供的同一品牌的野生海产品是否具有类似的稳定同位素比值,初步判断是否来自云霄红树林湿地野生生境,比较了2010年10月从云霄南市场4个宣称销售“云霄红树林野生青蟹”的经销商(D1、D2、D3、D4)所购买的拟穴青蟹肌肉组织的δ13C和δ15N,结果示于图4。由图4可见,三个销售商(D1、D3和D4)的青蟹δ13C相近(为-19‰),均显著低于经销商D2的δ13C(-14.9‰)。然而,此次所购买的拟穴青蟹样品δ15N在不同经销商之间无显著性差异(p>0.05),均值约为12‰。虽然不同销售商出售所谓“红树林青蟹”的δ15N比较一致,但δ13C明显不同(图4),说明这些产品不可能都来自云霄红树林湿地。
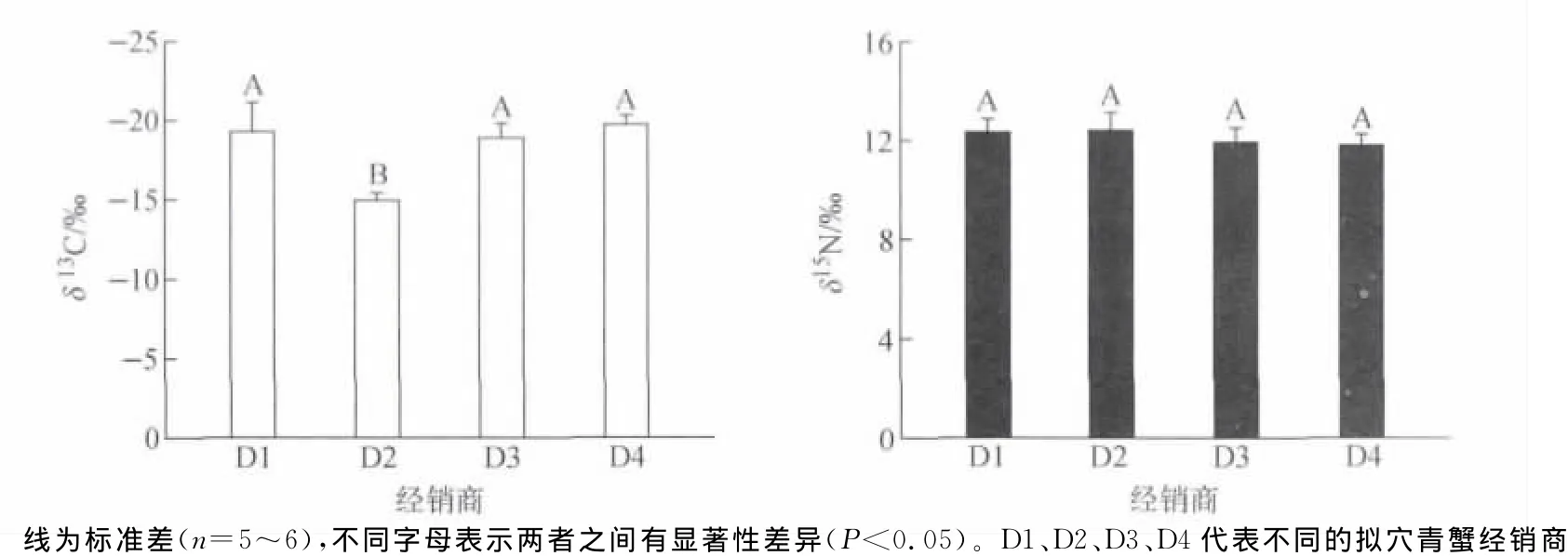
图4 从云霄南市场不同经销商购买的拟穴青蟹肌肉组织δ13 C和δ15 N比较D1、D2、D3、D4 represent different crab dealers.Different letters denote significant difference at p<0.05Fig.4δ13 C andδ15 N values of muscle tissues of S.paramamosain bought from different crab dealers on the market of Yunxiao County.
红树林野生、鱼塘养殖和市场购买拟穴青蟹肌肉组织δ13C频率分布图示于图5。野生拟穴青蟹的δ13C分布范围较广,但整体比养殖和市场购买的样品偏正,可作为区分来自不同养殖方式红树林青蟹的有效途径。养殖塘养殖拟穴青蟹的δ13C分布相对集中,主要分布在-15‰~-18‰间。而市场购买的“野生青蟹”的δ13C主要分布在-20‰左右,但有4个个体值分布在-15‰左右,为图4中D2的样品,其具有比其他经销商高的δ13C。从“红树林青蟹”δ13C和δ15N分布情况(图5和图6)可见,大部分市场产品与养殖塘养殖的拟穴青蟹重叠,说明市场上宣称的“红树林野生青蟹”并不都是真正天然野生青蟹。在人工养殖中,由于天然饵料如杂鱼和贝类等的缺少和较高的成本,市场上不断开发出一些能够满足青蟹生长需求的人工合成饵料,主要组分为陆源植物蛋白和油脂,夹杂家禽牲畜内脏等。
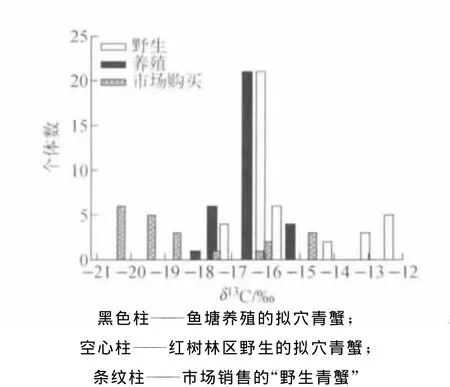
图5 所有测定拟穴青蟹肌肉组织样品的δ13 C分布图Solid bars——far med crabs;Open bars——car bs fro m mangr ove area;Starred bars——mar ket cras labeled as wild crabsFig.5Distribution ofδ13 C values of muscle tissues from all S.par amamosain crabs measured in this study.
因而,人工合成饵料具有相对较低的δ13C和δ15N,这是利用稳定同位素技术区分养殖与野生海产品的科学依据。由于合成饵料的组成复杂,因而其δ13C和δ15N组成变化范围较广,有时也会造成养殖青蟹与野生青蟹的部分重叠(图5和图6),单靠稳定同位素组成的分析不易区分青蟹的产地,需要综合其他一些指标如脂肪含量或金属元素含量等。例如,Shearer等[15](1994)对野生和养殖的鲑鱼研究发现,养殖鲑鱼的脂肪含量比野生的高两倍,Alasalvar等[16](2002)对野生和养殖的鲈鱼研究表明,结合脂肪含量、脂肪酸组成和元素含量可以区分两者。因此,还需要进一步研究野生和养殖的拟穴青蟹在其他指标上的差异,以建立更可靠的产地鉴定方法。
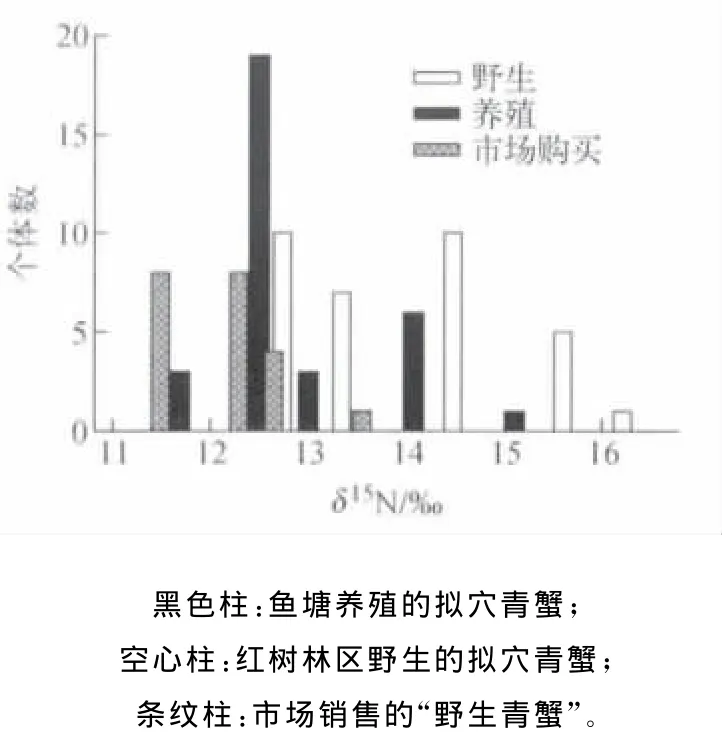
6所有测定拟穴青蟹肌肉组织样品的δ15 N分布图Solid bars:far med crabs;Open bars:carbs from mangrove area;Starred bars:market crabs labeled as“wild crabs”Fig.6Distribution ofδ15 N values muscle tissues from all S.paramamosain crabs measured in this study.
4 结论
拟穴青蟹的碳、氮同位素组成主要受组织的有机物组成、代谢特征和摄食的食物类型的控制,但与个体(或年龄)大小无关。一般情况下,养殖塘人工养殖的拟穴青蟹具有与野生拟穴青蟹不同的碳、氮同位素组成,可以作为区分拟穴青蟹产地的科学依据。然而,在一些特定情况如人工养殖使用成分不固定的饵料,人工养殖的拟穴青蟹与红树林湿地野生的拟穴青蟹在碳、氮同位素组成可能很类似,还需要结合其他指标的测定才能有效区分开来。另外,没有跟踪分析人工养殖饵料的成分组成及其同位素比值变化,还需进一步深入研究。
[1]Delgado CL,Wada N,Rosegrant MW,et al.Fish to 2020:Supply and demand in changing global markets[M].Washington:Inter national Food Policy Research Inst,2003.
[2]Bell JG,reston T,Henderson RJ,et al.Discri mination of wild and cultured Eur opean sea bass(Dicentr archus l abr ax)using chemical and isotopic analyses[J].Journal of agricultural and f ood chemistry,2007,55(15):5 934-5 941.
[3]Sargent J,Tacon A.Develop ment of far med fish:a nutritionally necessar y alter native to meat[J].Proceedings of the Nutrition Society,1999,58(02):377-383.
[4]Kelly S,Heaton K,Hoogewerff J.Tracing the geographical origin of food:The application of multi-element and multi-isotope analysis[J].Trends in Food Science & Technology,2005,16(12):555-567.
[5]林光辉.稳定同位素生态学[M].北京:高等教育出版社,2013:449-483.
[6]De Niro MJ,Epstein S.Influence of diet on the distribution of carbon isotopes in ani mals[J].Geochimica et Cos mochi mica Acta,1978,42(5):495-506.
[7]Post DM,Lay man CA,Arrington DA,et al.Getting to the fat of the matter:models,methods and assu mptions f or dealing with lipids in stable isotope analyses[J].Oecologia,2007,152(1):179-189.
[8]Peterson BJ.Stable isotopes as tracers of or ganic matter input and transfer in benthic food webs:A review [J]. Acta Oecologica,1999,20 (4):479-487.
[9]Michener RH,Kauf man L.Stable isotope ratios as tracers in marine food webs:an update[M].In Stable isotopes in ecology and environ mental science.John Wiley &Sons:New Yor k.2007:238-282.
[10]Hatase H,Takai N,Matsuzawa Y,et al.Size-related differences in feeding habitat use of adult female loggerhead turtles Caretta caretta around Japan deter mined by stable isotope analyses and satellite telemetr y[J].Marine Ecology Pr ogress Series,2002,233:273-281.
[11]艾春香.锯缘青蟹养殖生物学特性及饲料与投喂[J].渔业现代化,2004,4:19-20.Ai CX.Biological property of crab,Scylla serrata and its feeding technique[J].Fisher y Moder nization,2004,4:19-20(in Chinese).
[12]Demopoulos A WJ,Cor mier N,Ewel KC,et al.Use of multiple chemical tracers to define habitat use of indo-pacific mangrove crab,Scylla serrata(Decapoda :Portunidae)[J].Est uaries and Coasts,2008,31(2):371-381.
[13]Kelly JF.Stable isotopes of car bon and nitrogen in the study of avian and mammalian trophic ecology[J].Canadian Jour nal of Zoology,2000,78(1):1-27.
[14]Lay man CA,Winemiller KO,Arringto DA,et al.Body size and trophic position in a diverse tropical f ood web [J].Ecology,2005,86(9):2 530-2 535.
[15]Shearer KD.Factors affecting the proximate composition of cultured fishes with emphasis on sal monids[J].Aquaculture,1994,119(1):63-88.
[16]Alasalvar C,Taylor K,Zubcov E,et al.Differentiation of cultured and wild sea bass (Dicentrarchus labrax):total lipid content,fatty acid and trace mineral co mposition[J].Food chemistr y,2002,79(2):145-150.
