乳头状甲状腺癌术后复发的相关因素分析
2014-05-16邢兰兰陈松李亚明
邢兰兰,陈松,李亚明
(中国医科大学附属第一医院 核医学科,辽宁 沈阳110001)
分化型甲状腺癌(diff erentiated t hyr oid cancer,DTC)包括乳头状癌(papillary thyroid cancer,PTC)和 滤 泡 状 癌 (f ollicular t hyr oid cancer,FTC),占甲状腺恶性肿瘤的90%以上,其中PTC是最常见的甲状腺恶性肿瘤,约占甲状腺恶性肿瘤的75%,且发病率呈逐年上升趋势,尽管多数PTC患者预后较好,但仍有一些PTC患者易早期复发和死亡[1],因此探讨影响PTC复发的危险因素具有重要意义。本文回顾2011年1月至2013年3月于本院就诊的PTC患者的临床资料,分析PTC术后复发的影响因素,为PTC的治疗及预防复发提供参考。
1 资料与方法
1.1 临床资料
回顾性分析2011年1月1日至2013年3月30日就诊69例乳头状甲状腺癌术后患者,手术日期为1997年1月1日至2013年1月30日,患者纳入标准:所有患者均于本院行甲状腺彩超、甲状腺功能测定、甲状腺球蛋白(t hyr oglobulin,Tg)及抗体测定,且于未停用左旋甲状腺素状态下,甲功检查3次或以上。所有患者均符合纳入标准且临床资料完整。术后复发患者31例(复发组),其中男12例,女19例;首诊年龄7~71岁,平均40.65±14.26岁;手术方式为甲状腺全切20例,次全切11例。未复发者38例(未复发组),其中男6例,女32例;首诊年龄22~69岁,平均39.79±11.99岁;手术方式为甲状腺全切19例,次全切19例。PTC患者手术或手术并清甲治疗后3~6个月以上,通过促甲 状 腺 激 素 (thyroid sti mulating hor mone,TSH)刺激下Tg水平联合颈部超声、131I全身显像、肺部CT判断PTC术后是否复发。随访方式为门诊及电话方式,随访时间为3个月~14年。
1.2 方法
采用回顾性分析,对术后复发与未复发患者性别、年龄、肿瘤大小、手术方式、术后未停服左旋甲状腺素时TSH抑制程度、术后是否行清甲治疗行单因素分析,并用多因素Logistic回归方法分析其危险因素。根据2009年美国甲状腺协会(ATA)指南肿瘤T分期,肿瘤直径按≤2 c m、≤4 c m且>2 c m、>4 c m分期,按肿瘤最大径≤2 c m和>2 c m分为两组分析。ATA和欧洲甲状腺协会(ETA)指南建议甲状腺癌高危患者和中危患者初期TSH抑制<0.1 mIU/L,故按<0.1 mIU/L、≥0.1 mIU/L分为两组分析,TSH为手术后或手术并清甲治疗(131I清除甲状腺癌术后残留甲状腺组织)后多次本院检测TSH平均值。按术后是否行清甲治疗分为两组分析,清甲治疗剂量为3.7 GBq(100 mCi)。对两组患者首次手术后复发和转移的危险度进行分析,危险度分层按2009年ATA指南分为低危组、中危组和高危组。

表1 复发组与未复发组临床资料Table 1Recurrence gr oup and non-recurrence group clinical data
1.3 统计分析
采用SPSS 17.0软件进行数据处理和统计分析,TSH抑制程度的单因素分析采用t检验及χ2检验,可能的影响因素单因素分析采用χ2检验,危险因素分析采用多因素Logistic回归向前步进法进行分析,绘制受试者工作特征曲线(receiver operator characteristic cure,ROC 曲线)及采用约登指数法探讨TSH的合适界值。检验水准α=0.05,以p<0.05为差异有统计学意义。
2 结果
2.1 PTC术后复发的单因素分析
PTC术后的单因素分析结果列于表2。患者首次手术后复发和转移的危险度,二组间差异无统计学意义(χ2=2.919,P=0.232)。PTC术后复发与患者年龄、手术方式无统计学意义(P>0.05),而与性别、肿瘤大小、术后TSH抑制程度、术后是否清甲治疗有统计学意义(p<0.05),男性、肿瘤越大、术后TSH 值较高、术后未行清甲治疗的患者复发率较高(p<0.05)。
2.2 TSH平均值分析
未停用左旋甲状腺素状态下,复发组TSH平均值为(0.68±0.76)mIU/L,未复发组 TSH平均值为(0.11±0.12)mIU/L,差异有统计学意义(t=4.084,P=0.000 3)。通过SPSS17.0软件绘制ROC曲线(图1),曲线下面积为0.873,面积的95%可信区间是(0.79,0.96),不包括0.5,TSH值用于评价肿瘤复发有显著意义。根据ROC曲线统计输出结果中各可能临界点灵敏度和特异性计算约登指数,以约登指数最大的界点为临界点,确定本组资料TSH抑制程度评价肿瘤复发的临界点为0.225 3 mIU/L,该点灵敏度为0.742,特异性为0.895,约登指数最大。
2.3 PTC术后复发Logistic回归分析
PTC术后复发危险因素Logistic回归分析列于表3。以PTC复发为因变量、可能的影响因素为自变量进行Logistic回归分析,最后进入方程的因素为肿瘤大小、TSH平均值、术后清甲治疗。肿瘤最大径>2 c m、术后行TSH抑制治疗过程中TSH值较高是肿瘤复发的危险因素,术后清甲治疗是肿瘤复发的保护因素。

表2 PTC术后的单因素分析Table 2Univariate analysis of postoperative PTC
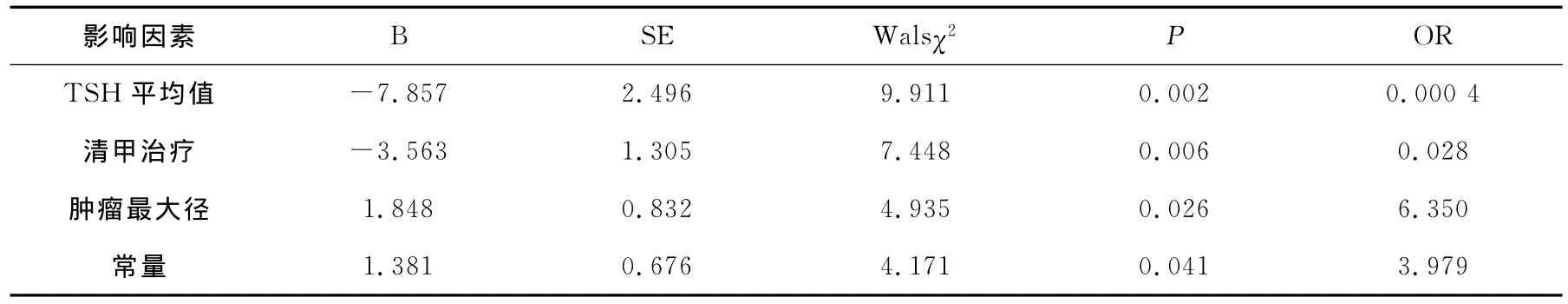
表3 PTC术后复发危险因素Logistic回归分析Table 3PTC recurrence Logistic regression analysis of risk f actors

图1 TSH值判断PTC术后复发的ROC曲线Fig.1The ROC curve of TSH value judgments PTC recurrence
3 讨论
PTC术前检查,如甲状腺核素扫描、CT、MRI和病理组织学检查尚不能完全检测甲状腺癌病灶范围及有无淋巴结转移,加上甲状腺解剖结构复杂及术者经验影响,无法做到彻底清扫,导致PTC术后复发率高[2]。有研究表明[3],对分化型甲状腺癌患者随访30年,发现近30%的患者复发,因此评估患者的术后复发因素非常重要。许多研究都已表明,PTC的复发与性别、年龄、肿瘤大小、诊断时是否有淋巴结转移、手术方式、是否行颈部淋巴结廓清及术后是否行131I清甲治疗等多种因素有关,但对于某些因素研究结论尚不一致。
(1)PTC术后复发与性别的关系。性别对于PTC术后复发及生存率的影响目前仍存在争议。有研究[4]表明,甲状腺癌患者中,男性较女性复发率高,预后差,其原因可能是男性患者中髓样癌较女性患者中多发,但并未提及PTC患者中男女之间的差异。也有研究[5-6]表明性别对分化型甲状腺癌复发无明显影响。本研究单因素分析表明,男性较女性复发率高,但Logistic多因素分析显示男性并不是PTC复发的危险因素,可能与单因素分析未考虑其他因素的影响有关。
(2)PTC术后复发与年龄及手术方式的关系。多数研究发现PTC患者首诊年龄可影响其复发及预后,≥45岁是PTC患者术后复发的危险因素[5,7-8],老年人(>60岁)肿瘤相关的死亡率明显升高。本研究分析PTC术后复发与年龄差异无统计学意义(P>0.05),尚需扩大病例数进一步证实。对于手术方式,2009年美国甲状腺协会(ATA)指出,对已确诊甲状腺癌的患者(细针穿刺细胞学检查或冰冻病理学报告证实),如果结节直径大于1 c m,应行双叶甲状腺全切除术或近全切除术[2]。国外有研究发现术后清甲治疗与未清甲治疗、甲状腺全切除术与次全切除术对复发的影响有明显的统计学差异(P=0.000 3,P=0.002)[13]。但目前对甲状腺癌手术方式与术后复发的关系仍存在争议,国内也有研究表明,手术方式对分化型甲状腺癌的复发无影响[14]。本研究发现甲状腺全切除术与次全切除术之间无统计学差异(P>0.05),与国外文献尚不一致,可能与国内外科术者对术式的选择有关。
(3)PTC术后复发与肿瘤大小及术后是否清甲治疗的关系。研究表明,肿瘤最大径≥4 c m、多中心性癌灶及颈部淋巴结转移的机会越大,造成手术难以彻底清扫,导致复发率增加[9]。本研究以肿瘤最大径2 c m为界,单因素分析显示肿瘤最大径>2 c m与≤2 c m两组间差异有统计学意义,Logistic回归分析显示肿瘤最大径进入方程,原发肿瘤较大者更易复发,与文献一致[10-11]。PTC术后131I清甲不仅有利于通过血清Tg和131I全身显像监测疾病进展,并且清甲后的131I全身显像、单光子发射计算机断层成像(SPECT)/CT融合显像等有助于对PTC进行再分期,尚可能治疗潜在的PTC病灶。Mazzaferri等[12]研究了首次治疗时无远端转移的患者,术后经131I清甲的肿瘤复发和死亡率明显低于仅行甲状腺素替代治疗或未行任何治疗者,回归分析表明甲状腺剩余组织131I清除是降低肿瘤复发和死亡的独立变数。本研究单因素显示术后清甲组与未清甲组间有明显统计学差异(P=0.000 05),术后未清甲患者明显较术后清甲患者易复发,多因素分析也表明术后清甲治疗是PTC患者的保护因素,可见术后行清甲治疗可能降低PTC患者的复发。
(4)PTC术后复发与未停服左旋甲状腺素状态下TSH抑制程度的关系。
分化型甲状腺癌术后TSH抑制治疗已成为其治疗过程非常重要的一部分,而对于其抑制程度美国和欧洲临床指南尚未达成共识,而国内尚无临床指南。Hovens等[15]的回顾性研究发现,当TSH抑制到<0.1 mI U/L时,与TSH≥1 mI U/L相比较,分化型甲状腺癌的复发率、转移率显著降低,TSH 在0.1~0.4 mIU/L时,癌肿的相关死亡和复发没有明显差异,而TSH>2 mIU/L时则与癌肿的相关死亡和复发相关。也有研究发现,甲状腺癌术后TSH抑制治疗患者中,与TSH长期维持在1 mIU/L或更高水平相比,TSH抑制到≤0.05 mIU/L水平的患者有更低的复发率[16]。探讨TSH抑制程度对于判断PTC术后复发的分界值,绘制了ROC曲线,曲线下面积为0.873,TSH值对评价PTC术后复发比较准确,TSH抑制程度评价肿瘤复发的临界点为0.225 3 mIU/L,且本研究分析复发组与未复发组间患者复发和转移危险度无统计学差异,可见,术后未停服左旋甲状腺素状态下,如采用TSH=0.225 3 mIU/L做为肿瘤复发的界值,其灵敏度为0.742,特异性为0.895。本研究单因素分析,复发组与未复发组间TSH抑制程度有显著差异(P=0.000 3),且TSH≥0.1与TSH<0.1两组间差异有统计学意义(P=0.000 01),TSH<0.1 时复发率较低,与Hovens等[15]的观点相同。对于TSH<0.1的亚组分析,尚需扩大样本量进一步分析。本研究属回顾性分析,数据量偏小,大样本的、前瞻性的研究将更有意义。
4 小结
本研究中,单因素和多因素分析均显示肿瘤大小、术后TSH抑制程度、术后是否行清甲治疗为可能影响肿瘤复发的因素,综合上述结论,PTC患者如术后常规行清甲治疗、无明显禁忌时TSH抑制到较低的程度可能降低肿瘤的复发。
[1]Mazzaferrll EL,Jhing SM.Long-ti me i mpact of initial surgical and medical therapy on papillary and f ollicular thyroid caller[J].Am J Med,1994,97(5):418-428.
[2]Cooper DS,Doherty GM,Haugen RR,et al.Revised American Thyroid Association management guidelines for patients with thyroid nodules and differentiated thyroidcancer[J].Thyroid,2009,19(11):1 167-1 214.
[3]张志文.甲状腺癌的影像学诊断进展[J].医学影像学杂志,2011,21(4):622-625.Zhang Zhi wen.Advances in diagnostic i maging of thyr oid cancer[J].Jour nal of Medical Imaging,2011,21(4):622-625(in Chinese).
[4]Duntas L,Grab-Duntas BM.Risk and prognostic factor for differentiated thyroid cancer[J].Hell J Nucl Med,2006,9(3):156-162.
[5]Gilliland FD,Hunt WC,Morris DM,et al.Prognostic Factors f or Thyroid Carcinoma.A population-based study of 15,698 cases fro m t he Surveillance,Epidemiology and End Results (SEER)program 1973-1991[J].Cancer,1997,79(3):564-573.
[6]Siironen P,Louhi mo J,Nordling S,et al.Prognostic factors in papillar y thyroid cancer:an evaluation of 601 consecutive patients[J].Tumour Biol,2005,26(2):57-64.
[7]Konturek A,Barczyński M,Nowak W,et al.Prognostic factors in differentiated thyroid cancera 20-year sur gical outco me study[J].Langenbecks Arch Sur g,2012,397 (5):809-815.
[8]Gulcelik MA,Gulcelik NE,Kur u B,et al.Prognostic factor deter mining survival in differedtiated thyroid cancer[J].J Sur g Oncol,2007,96(7):598-604.
[9]姚宏斌,林志雄,蒋忠祥.甲状腺癌术后复发的相关因素分析[J].浙江临床医学,2012,14(4):415-416.Yao Hongbin,Lin Zhixiong,Jiang Zhongxiang.A-nalysis of recurrence factor of thyroid cancer[J].Zhejiang Clinical Medicine Jour nal,2012,14(4):415-416(in Chinese).
[10]Holler T,Theriault J,Payne RJ,et al.Pr ognostic factors in patients with multiple recurrences of well-differentiated thyroid carcino ma[J].J Sur g Oncol,2009,(i mpress).
[11]Vaisman F,Shaha A,Fish S,et al.Initial therapy with either thyroid lobectomy or total thyroidectomy without radioactive iodine remnant ablation is associated with very low rates of str uct ural disease recurrence in properly selected patients wit h differentiated thyr oid cancer[J].Clin Endocrinol,2011.
[12]Mazzaferri EL.Thyroid remnant131I ablation f or papillar y and f ollicular thyroid carcinoma[J].Thyroid,1997,7(2):265-271.
[13]Cushing SL,Pal me CE,Audet N,et al.Pr ognostic factor in well differentiated t hyr oid carcinoma[J].Lar yngoscope,2004,114(12):2 110-2 115.
[14]曹俐,陈周,李定军.分化型甲状腺癌术后复发因素分 析 [J].中 国 中 医 药 咨 询,2010,2(17):240-241.Cao Li,Chen Zhou,Li Dingjun.Analysis of recurrence factor of differentiated thyroid cancer[J].China's traditional Chinese medicine infor mation,2010,2(17):240-241(in Chinese).
[15]Hovens GC,Stokkel MP,Kievit J,et al.Associations of serum thyrotropin concentrations with recurrence and death in differentiated thyroid cancer[J].J Clin Endocrinol Metab,2007,92(7):2 610-2 615.
[16]Pujol P,Daures JP,Nsakala N.Degree of thyrotropin suppression as a pr ognostic deter minant in differentiated thyroid cancer[J].J Clin Endocrinol Metab,1996,81(12):4 318–4 323.
