同位素标记敌百虫-甲氧基-D6和敌敌畏-甲氧基-D6的合成
2014-05-16杨维成吕靖齐庆瑞盛立彦李美华杨超罗勇
杨维成,吕靖,齐庆瑞,盛立彦,李美华,杨超,罗勇
(1.上海化工研究院 技术开发中心 上海200062;2.新疆教育学院 职业教育分院,乌鲁木齐830046)
目前,国内针对动物源食品有机磷残留的检测方法中,敌百虫、敌敌畏的检测方法虽各自不同[4-7],归纳起来通用的检测方法主要有:高效液相色谱法 (HPLC)[8-9]、气 相 色 谱 法 (GC)[15-13]、毛细管电泳法[14]、气相色谱-串联质谱法(GC/MS)[15-16]、液相色谱-串联质谱法(LC/MS)等方法[17-21]。其中,LC/MS法是近年发展起来的一种新技术,可在一级质谱(MS)条件下,获得较强的待测物准分子离子峰,并可借助MSn(n=2~10),对准分子离子峰进行多级裂解,进而获得丰富的结构信息[22-23]。此方法可以有效克服敌百虫(GC/MS检测时)热分解造成的实验误差,前处理方法也对分析结果造成较大偏差。
同位素稀释质谱法(isotope dilution mass spectr o metr y,IDMS)是检测食品、饲料中残留的有效方法,采用与被测物质具有相同分子结构的稳定性同位素(15N,13C,2H等)标记的化合物作为内标物质,用LC/MS进行检测,可准确定量。发达国家对于食品、饲料中的残留均要求用质谱法检测,并规定判定标准,如欧盟的2002/657/EC指令。目前,国内80%以上的各类农残检测方法均使用同位素稀释质谱法,通过添加稳定同位素内标试剂,可有效消除样品在处理步骤中所引起的回收率差异,从而避免因为样品处理过程中的损失对检测结果造成的偏差,显著提高目标化合物的回收率和方法稳定性。稳定同位素内标的特性与LC/MS的高灵敏度和处理复杂样品的能力结合,使色谱/同位素稀释质谱技术成为测量微量及痕量有机物的基准方法,应用越来越广泛。
本研究结合敌百虫、敌敌畏工业合成路线[24-27],在避免同位素丰度稀释的前提下,以CD3OD为标记起始原料,经与三氯化磷酯化得到亚磷酸二甲酯(I),再进一步与三氯乙醛加成得到敌百虫-甲氧基-D6(II)。敌百虫-甲氧基-D6继续碱解脱去一分子氯化氢,重排后生成敌敌畏-甲氧基-D6(III),可用于同位素内标试剂。
1 实验部分
1.1 试剂与仪器
CD3OD:上海化工研究院自制,丰度99.5%;敌百虫(纯度97.0%)、敌敌畏(纯度95.0%):Dr.Ehrenstorfer Gmb H 生产,标准品;其余试剂均为市售分析纯或化学纯,未进一步处理。
高效液相色谱:日本Shi madzu公司;超高液相质谱联用仪:美国Themo Fisher Scientific公司;红外吸收光谱仪:美国Nicolet公司;核磁共振仪:瑞士Br uke公司。
1.2 敌敌畏-甲氧基-D6 的合成
1.2.1 亚磷酸二甲酯-D6(D7)的合成
2.树立现代治理理念。互联网精神与现代治理理念具有内在契合性,地方政府治理要坚定共享共治、开放透明、自由平等、民主法治的理念,超越威权思维,乘着 “互联网+”东风,向建设法治政府、透明政府、有限政府、服务型政府的目标扎实迈进。要以公众为中心、以治理效能为导向,促进公共产品和公共服务的 “互联网+”大发展。要充分接纳各治理主体的自主性并充分发挥其创造性,处理好政府、企业、社会之间关系,广泛整合治理资源,培育有机的治理生态。要以规则为准绳,不断规范政府治理行为,树立良好的政府形象。
将5.40 g(0.15 mol)CD3OD溶于18.5 mL的二氯甲烷中,6.86 g(0.05 mol)PCl3溶于10 mL二氯甲烷,在0~2℃下向CD3OD溶液中滴加PCl3溶液,滴加时间为0.5 h。滴加结束后,迅速升温至69℃,在该阶段溶液回流并有大量气泡产生,保温50 min后,待气体产生停止后终止反应。旋蒸后减压蒸馏,收集71~75℃(720 mm Hg)的馏分,称量后计算收率为84.5%,化学纯度在98%以上,氘同位素丰度为98.4%。LC-MS-ESI-:[M+H]+=117、118。
1.2.2 同位素标记敌百虫-甲氧基-D6的合成
往圆底烧瓶中加入6.58 g(45 mmol)三氯乙醛,在70℃下滴加5.0 g(43 mmol)同位素标记的亚磷酸二甲酯,30 min后滴加结束。迅速升温至80℃并保温2 h至反应结束,将产品转移进行结晶,得到的固体称重为11.66 g,粗收率大于100%。产品进行5次重结晶后,总收率(以CD3OD计)为57.7%,化学纯度为98.5%,氘同位素丰度为98.4%。
1.2.3 同位素标记敌敌畏-甲氧基-D6的合成
取6.2 g(24 mmol)敌百虫-甲氧基-D6重结晶样品溶于44 g蒸馏水中,再加入20 mL苯,在5℃的水浴下滴加5%Na OH溶液30 mL,5 min之内滴加结束,升温至40℃,保温1 h,反应结束后分液、干燥、旋蒸,得到粗产品4.23 g,最后减压蒸馏得到产品3.2 g,计算总收率(以CD3OD计)为47.3%,经检测化学纯度为98.2%,氘同位素丰度为98.2%。
1.3 纯度分析
采用气相色谱分析亚磷酸二甲酯纯度。色谱柱:SPB-5柱;载气:N2,0.10 MPa;分流进样,进样温度:200℃;FID检测器,检测温度:220℃;氢气:0.15 MPa;空气:0.15 MPa;柱温:120℃~200℃。
采用岛津LC-20 AT高效液相色谱仪进行敌百虫、敌敌畏化学纯度分析,敌百虫分析:Kr o masil-C18柱(46 mm ×150 mm);流动相:V(乙腈)∶V(水)=1∶1;检测波长:205 n m;流速:1.0 mL/min。
敌敌畏分析:Kro masil C18柱(46 mm ×150 mm);流动相:V(乙腈)∶V(水)=1∶1;检测波长:211 n m;流速:1.0 mL/min。
1.4 结构鉴定
采用红外、核磁和液质联用进行结构确定。红外分析条件:KBr压片。核磁测试条件:400 Hz,CDCl3溶剂。质谱检测条件:电喷雾(ESI)离子源;采用正离子模式,喷雾电压3 500 V、鞘气12 bar、辅助气5 bar、毛细管温度275℃、Q1分辨率0.7 a mu。
2 结果与分析
2.1 同位素标记前体的制备
以甲醇和水为原料进行亚磷酸二甲酯的合成,其反应剧烈,历程复杂,反应条件对收率影响很大。为提高甲醇的利用率,选择四因素:温度(X1),时间(X2),投料比(X3),溶剂量(X4),采用均匀设计进行实验优化,均匀设计结果列于表1。利用DPS软件数据处理系统二次多项式逐步回归分析,得回归方程:

表1 亚磷酸二甲酯均匀设计结果Table 1 Unifor m design and experi mental results of di methyl phosphite
Y=315.527 913 5-121.374 981 86 X3+14.872 108 925 X3*X3-0.000 487 692 744 6 X4*X4-0.730 052 611 8 X2*X3。
相关系数R=0.099 41,F=63.501 7,显著水平P=0.003 1<0.05,剩余标准差S=1.336 4,调整后相关系数R=0.986 3,Dur bin-Watson统计量d=2.550 770 82。说明该方程能很好地拟合亚磷酸二甲酯的合成过程。
经过均匀设计得到较优的配实验工艺,其效果需要进行检验。本实验以计算所得最佳工艺条件:温度69℃,时间0.83 h,投料比3.0,溶剂量19 mL进行实验验证,实际收率为84.5%。基本与理论预测值吻合,说明此方程具有较好的指导意义。
2.2 敌百虫合成工艺选择
Javidan[26]等,采用微波加热方式,在 Al2O3催化剂作用下,合成得到敌百虫,取得较好的效果,参考此方法,并与常规加热方式进行对比,控制投料摩尔比n[(Me O)2PH]∶n(三氯乙醛)=1∶1.05,实验结果列于表2。由表2可知,采用常规加热方式时,只需适当延长反应时间,其收率也可达到微波加热反应的水平,同时发现,当体系中不含催化剂Al2O3时,收率反而有所提高,此现象与文献[26]结果有别。最终选择不使用催化剂反应,初收率达到99%以上。高效液相色谱(HPLC)检测产品纯度为85%,需要进一步分离提纯。

表2 敌百虫合成实验结果Table 2Synthetic exploration of trichlorfon
2.3 敌百虫分离提纯
根据敌百虫在不同溶剂中的溶解度差别,选择复合溶剂进行重结晶。经过五次重结晶实验后,敌百虫提纯达到101.58%(标样纯度97.0%),经校正后,化学纯度为98.5%,可以作为内标应用。
2.4 碱量对敌敌畏合成的影响
通过敌百虫碱解的方法合成敌敌畏,碱量大小对敌敌畏收率影响显著,碱量太少会影响反应速率,而碱量太多则会促进敌敌畏进一步水解生成磷酸二甲酯和二氯乙醛。因此,本实验在文献[27]基础上,通过改变Na OH用量,考察其对合成敌敌畏的影响,实验结果列于表3,当Na OH与敌百虫的摩尔比为1.3∶1时,敌敌畏合成的收率达到81.1%。

表3 碱量对敌敌畏合成的影响Table 3Synthetic opti mization of dichlor ophos s
2.5 丰度实验
在优化条件下,按照丰度实验投料量,进行了多次验证实验,同时对所需实验装置进行彻底清洗,避免丰度稀释。使用CD3OD(氘丰度99.5%)为原料,按照实验获得的优化条件进行了同位素标记敌百虫-甲氧基-D6和敌敌畏-甲氧基-D6的合成。以消耗的CD3OD计算,同位素标记敌百虫-甲氧基-D6和敌敌畏-甲氧基-D6的收率分别为总收率为57.7%和47.3%,化学纯度均高于98.0%,氘同位素丰度均高于98.0%。
2.6 结构鉴定
合成得到的产品经MS、NMR、IR进行结构鉴定。敌百虫和敌敌畏多级碎片质量简图示于图1。
同位素标记敌百虫-甲氧基-D6,化学纯度为98.5%,氘 同 位 素 丰 度 为 98.4%。LC-MSESI-:[M + H]+= 263、265、267;1H NMR(400 MHz,CDCl3)δ4.52 (d,J= 11.9 Hz,1 H);13C NMR (101 MHz,CDCl3)δ97.65、97.54(1C,C-Cl),δ80.66 -76.69(1C,C-OH),δ 54.28~53.12(2C,C-D);FT-IR (KBr)ν/c m-1:3 354.9,2 898.6,2 585.0,2 269.8,2 206.6,2 156.4,2 081.1,1 876.2,1 819.3,1 373.9,1 250.8,1 203.7,1 047.9,1 019.4,917.0,835.7,812.5,782.0,710.4,619.5,522.8,468.0,438.0。
同位素标记敌敌畏-甲氧基-D6,化学纯度为98.2%,氘 同 位 素 丰 度 为 98.2%。LC-MSESI-:[M+H]+=227、229、231,1H NMR (400 MHz,CDCl3),δ7.00 (d,J= 5.3 Hz,1 H);13C NMR (101 MHz,CDCl3),δ133.65~133.61(1C,C-H),δ113.99~113.85(1C,C-Cl),δ 54.83~53.92(2C,C-D);FT-IR (KBr)ν/c m-1:3 076.0,2 264.1,2 080.8,1 645.0,1 282.5,1 151.3,1 112.7,1 049.1,972.0,919.0,837.0,806.1,734.8,655.7。
以上数据与目标化合物结构式相符,表明所合成的化合物即为目标化合物。
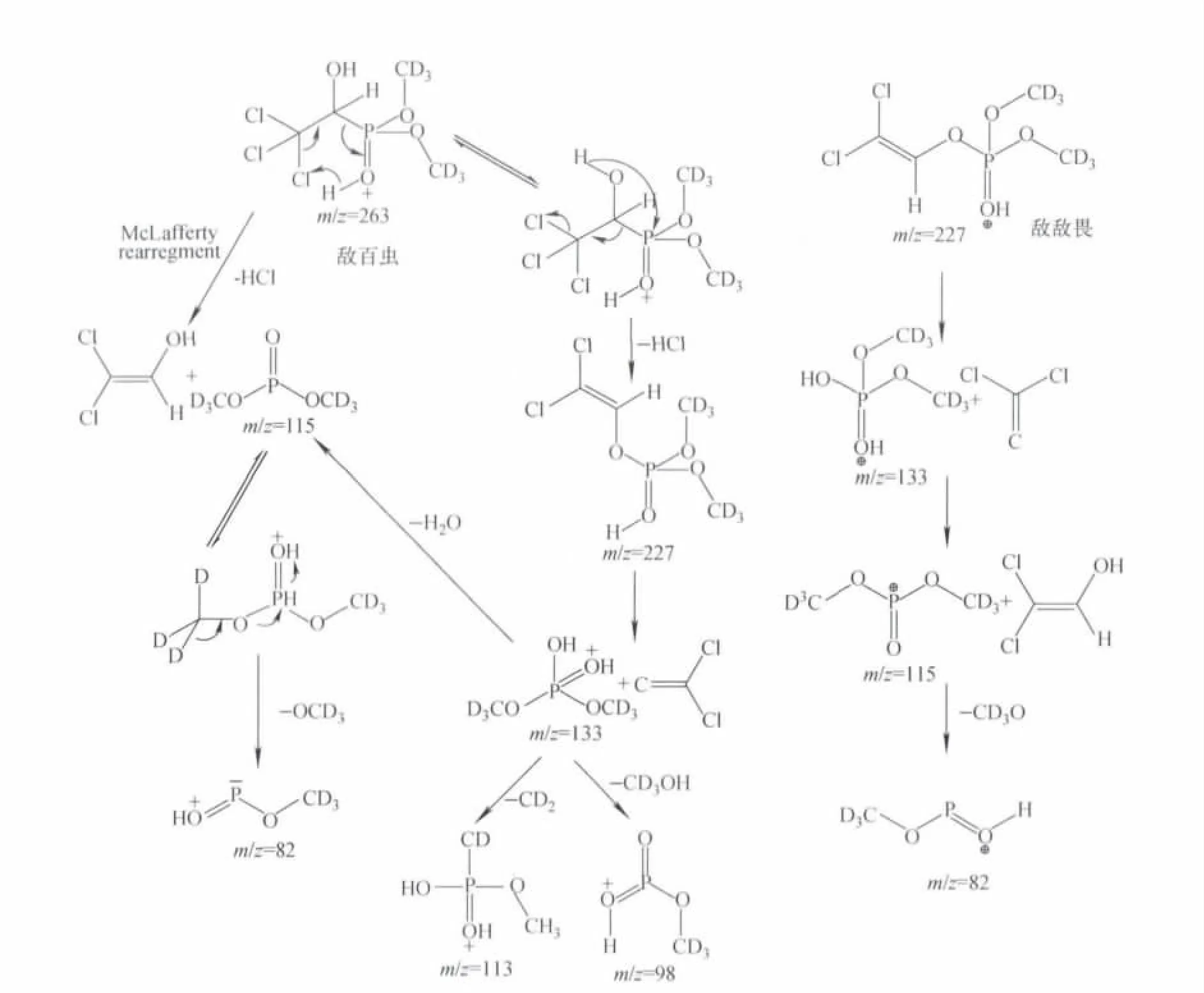
图1 敌百虫、敌敌畏多级碎片质量简图Fig.1 Multistage fragment mass diagram of trichlorf on and dichlorophos
3 讨论
在同位素有机合成中,由于同位素原料价格昂贵,因此衡量其合成路线优劣的主要因素是同位素原子的利用率、产物的化学纯度和同位素丰度,尤其是氘化合物的同位素丰度,易与外界中氢发生交换,造成丰度稀释。在合成中,一般选择待标记分子的骨架或者其稳定基团,以避免同位素丰度的稀释。实验中,以甲基作为氘原子的引入基团,采用CD3OD作为基础试剂,选择合适的反应条件,合成敌百虫-甲氧基-D6和敌敌畏-甲氧基-D6,并对合成过程中多个关键步骤进行了优化,提高了最终产物的纯度和收率。
中间体稳定同位素标记亚磷酸二甲酯的分子离子峰为m/z=117、118,说明在合成过程中,甲氧基上6个H被D取代,而合成得到的部分亚磷酸二甲酯分子中P-OD中的D也被环境中H取代,即合成产品中包含亚磷酸二甲酯-[D6]和亚磷酸二甲酯-[D7],其比例约为1∶3.9。
目标产物同位素标记敌百虫-甲氧基-D6和敌敌畏-甲氧基-D6的分子离子峰与相应的分子式的相对分子质量一致,其同位素丰度经计算分别为98.4%、98.2%,通过目标产物的二级质谱图,确认了敌百虫、敌敌畏裂解规律(见图1),为目标化合物在食品安全检测中做内标应用奠定了基础。
在1H NMR谱图中,-OCH3的特征吸收峰明显消失,说明目标产物中2个-OCH3中的6个H原子被D原子取代。在同位素标记的敌百虫1H NMR谱图中,-OH也同时消失,说明-OH上的H原子也同样被D原子取代,但在MS谱图中,显示只有-OCH3的H被取代,其原因可能是-OD的D原子较活泼,在进行质谱测试时,直接发生交换,变为普通H原子。在IR谱图中,目标产物分子式的各官能团的吸收峰都比较明显。
4 小结
(1)以同位素标记物CD3OD为标记前体,利用有机合成方法,通过甲基化、碱解等步骤,以良好收率合成出稳定同位素标记敌百虫-甲氧基-D6和敌敌畏-甲氧基-D6,并有效避免了氘同位素丰度的稀释。
(2)优化合成工艺条件。氘同位素标记敌百虫-甲氧基-D6总收率为57.7%,氘同位素标记敌敌畏-甲氧基-D6总收率为47.3%。
(3)产品经高效液相色谱(HPLC)、质谱(MS)检测,化学纯度大于98.0%,氘同位素丰度高于98.0%,未出现同位素明显稀释现象,可作为同位素内标应用于食品安全检测。
[1]陈静,张军,易亮衡,等.一起有机磷农药残留致食物中毒的调查分析[J].中国卫生检验杂志,2002,12(3):384-384.Chen Jing,Zhang Jun,Yi Liangheng,et al.A suver y of food poisoning of organophosphorus pesticides residues[J].Chinses Jour nal of Health Laboratory Technology,2002,12(3):384-384(in Chinese).
[2]Liu CY,Chang PA,Wu YJ.Trichlorf on inducesapoptosis in SH-SY5 Y neuroblasto ma cells via the endoplas mic reticulu m[J].Chemico-biological interactions,2009,181(1):37-44.
[3]葛志荣,马随军.主要贸易国家和地区食品中农兽药残留限量标准:农兽药卷[M].中国标准出版社,2004.
[4]中国国家标准化管理委员会.GB/T 5009.20-2003食品中有机磷残留的测定[S].北京:中国标准出版社,2003.
[5]中国国家标准化管理委员会.GB/T 5009.161-2003动物食品中有机磷农药多组分残留的测定[S].北京:中国标准出版社,2003.
[6]SN 0125-1992.出品肉及肉制品中敌百虫残留的检验方法[S].北京:中国标准出版社,1992.
[7]中华人民共和国农业部.农业部783号公告,水产品中敌百虫残留量的测定气相色谱法 [S].北京:中国农业出版社,2006.
[8]Hai-Zhen Zhu,Yan-Mei Cui,Xiu-Wen Zheng,et al.Deter mination of trace trichlorf on by high perfor mance liquid chro matography with UV detection based on its catalytic effect on sodiu m per borate oxidizing benzidine[J].Analytica Chi mica Acta,2007,584,166-171.
[9]Bar kat Ali Khan,Abid Farid,Muhammad Ra?que Asi,et al.Deter mination of residues of trichlorf on and di methoate on guava using HPLC[J].Food Chemistr y,2009,114,(1):286-288.
[10]Longobardi F,Solfrizzo M,Co mpagnone D,et al.Use of electrochemical biosensor and gas chro matography f or deter mination of dichlorvos in wheat[J].Jour nal of Agricultural and Food Chemistr y,2005,53(24):9 389-9 394.
[11]Car deal ZD,Paes CMD.Analysis of or ganophosphor us pesticides in whole milk by solid phase micro-extraction gas chromatography method[J].Jour nal of Environ mental Science and Health Part B,2006,41(4):369-375.
[12]Yaqoob MA,Mu mtaz MW,Mukhtar H,et al.Deter mination of organophosphorous pesticide residue in water samples using gas chr omato-graphyelectron capture detector[J].Chemistry-An Asian Jour nal,2008,20(3):2 064-2 068.
[13]叶玫,余颖,贺学荣,等.气相色谱法测定水产品中敌百虫、敌敌畏残留量[J].上海海洋大学学报,2010,19(4):489-494.Ye Mei,Yu Ying,He Xuerong,et al.Deter miation of trichlorf on and dichlorvos residues in fishery products by gas chro matography[J].Jour nal of Shanghai Ocean University,2010,19(4):489-494(in Chinese).
[14]阀木旺.胶束毛细管电泳法测定有机磷农药的研究[J].化学工程与装备,2008,10:129-134.Que Mu wang.St udy of the deter mination of organophsphorus pesticides using micellar electrokinetic capillary chromatography(MEKC)[J].Chemical Engineering &Equip ment,2008,10:129-134(in Chinese).
[15]Garrido A,Gonzalez-Rodrguez MJ,Arrebola FJ,et al.Potentiality of gas chro matography-triple quadrupole mass spectrometry in vanguard and rear guard methods of pesticides residues in vegetables[J].Analytical Chemistry,2005,77(7):4 640-4 648.
[16]于慧娟,蔡友琼,李庆,等.气相色谱-质谱法研究敌百虫在气相色谱分析过程中产生的分解产物[J].色谱,2006,24(1):23-25.Yu Huijuan,Cai Youqiong,LI Qing,et al.Ministry of agriculture supervision and testing center f or aquatic pr oducts[J].Chinese Jour nal of Chro matography,2006,24(1):23-25(in Chinese).
[17]Grimalt S,Sancho JV,Pozo J,et al.Analytical Study of Trichlorfon Residues in Kaki Fr uit and Cauliflower Samples by Liquid Chromatography?Electrospray Tandem Mass Spectro metr y[J].Journal of Agricultural and Food Chemistry,2006,54:1 188-1 195.
[18]Blasco C,Font G,Pico Y.Co mparison of microextrac-tion procedures to deter mine pesticides in oranges by liquidchro matography-mass spectro metry[J].Journal of Chromatography A,2002,970(1-2):201-212.
[19]Grimalt S,Sancho JV,Pozo OJ,et al.Analytical study of trichlorf on residues in kaki fr uit and cauliflower samples by liquid chr omatography-electrospray tandem mass spectro metry[J].Jour nal of Agricult ural and Food Chemistr y,2006,54(4):1 188-1 195.
[20]Wang GM,Dai H,Li YG.Si multaneous deter mination of residues of trichlorfon and dichlorvos in ani mal tissues by LC-MS/MS[J].Food Additives and Contaminants,2010,27(7):983-988.
[21]查玉兵,杨春亮,林玲,等.超高效液相色谱-质谱法测定水产品中敌百虫的含量[J].食品科学,2011,32(8):278-280.Zha Yubing,Yang Chunliang,Lin Ling,et al.Deter mination of trichlorphon residues in aquatic products using UPLC-MS/MS[J].Food Science,2011,32(8):278-280(in Chinese).
[22]顾景凯,钟大放,陈笑艳,等.LC/MSn法鉴定乙氧苯柳胺在家兔体内的主要代谢产物[J].高等学校化学学报,2000,2l(5):690-693.Gu Jingkai,Zhong Dafang,Chen Xiaoyan,et al.I-dentification of major metabolites of etofesalamide in rabbits by liquid chromatography/ion trap mass spetro metr y[J].Chemical Jour nal of Chinese Universities,2000,2l(5):690-693(in Chinese).
[23]Jeannot R,Sabik H,Sauvar d E,et al.Application of liquid chr o matography with mass spectro metr y co mbined with photodiode array detection and tandem mass spectr ometr y f or monitoring pesticides in surface waters[J].Journal of Chromatography A,2000,879(1):51-57.
[24]汪正宏,王学文,芦文斌.高纯度敌敌畏的合成[J].湖北化工,1998,15(1):42-42.Wang Zhenghong,Wang Xuewen,Lu Wenbin.Synthesis of high purity?DDVP [J].Hubei Chemical,1998,15(1):42-42(in Chinese).
[25]杜辉.敌敌畏敌百虫清洁生产工艺[J].现代农药,2006,5(5):20-21.Du Hui.Cleaner Production of Dichlorvos and Trichlorf on[J].Moder n Agrochemicals,2006,5(5):20-21(in Chinese).
[26]Javidan A,Banan AR.Microwave synthesis of trichlorf on and its analogues[J].Phosphor us,Sulf ur,and Silicon,2004,179(11):2 253-2 258.
[27]王金祥.改进敌敌畏生产工艺,提高产品收率[J].安徽化工,1981,3:1-6.Wang Jinxiang.Improve production process of dichlorvos,i mprove product yield[J].Anhui Chemical,1981,3:1-6(in Chinese).
