黄连生物碱促小鼠睡眠实验研究
2014-05-15邹宗尧王燕枝胡慭然王德珍李学刚
邹宗尧,王燕枝,胡慭然,夏 爽,王德珍,庞 婕,李学刚,2,3
(1.西南大学药学院,2.重庆市药效评价工程技术研究中心,3.重庆市药物过程与质量控制工程技术研究中心,重庆 400715)
黄连始载于《神农本草经》,为毛茛科植物黄连(Coptis Chinesis Franch)、三角叶黄连(Coptis deltoidea C.Y.Cheng et Hisao)或云连(Coptis teeta Wall)的干燥根茎。其性味苦、寒,归心、胃、脾、肝、胆、大肠经,具有清热燥湿、泻火解毒的功能。《本草纲目》明确记载黄连具有治疗“孕妇心烦,不能睡眠”的作用;临床上,黄连常作为治疗失眠复方的主药,如黄连阿胶汤、交泰丸等[1]。主要用于治疗心肾不足、阴虚火旺等症状,具有静心、安神的功效,被广泛用于神经衰弱[2]、失眠等病症。黄连的活性成分为黄连生物碱,主要为小檗碱、黄连碱、巴马汀、表小檗碱和药根碱等[3]。目前,关于小檗碱的镇静安神和促进睡眠方面的研究工作较多[4-6],但对黄连其他生物碱在促进睡眠方面的研究却鲜有报道。本研究在已获得黄连主要生物碱单体的基础上[7],系统比较了5种黄连主要生物碱单体对小鼠睡眠及其神经递质的影响。
1 材料
1.1 仪器 ZZ-6小鼠自主活动测试仪(成都泰盟科技有限公司);精密电子天平(德国赛多利斯仪器系统有限公司);Direct-Q3超纯水系统(德国默克密理博仪器有限公司);高速匀浆机(美国VWR国际有限公司);Avanti J-301高速冷冻离心机(美国贝克曼库尔特有限公司);LC-6AD高效液相色谱仪RF-10AXL荧光检测器(日本岛津公司)。
1.2 试剂与药品 醋酸钠、甲醇为色谱纯,分别购自阿拉丁和天津市科密欧化学试剂有限公司。其他试剂为分析纯,水为超纯水;地西泮片(天津力生制药股份有限公司,批号20120310);戊巴比妥钠片(北京化学试剂公司,批号120812);标准品DA、NE和5-HT(美国Sigma公司,批号分别为1001423402、1001171997、1001344074);PCPA(东京化成工业株式会社);小檗碱、黄连碱、巴马汀、表小檗碱和药根碱由西南大学药用资源化学研究所提供。
1.3 动物 SPF级昆明种♀小鼠315只,体质量(20±2)g,购于重庆市中药研究院实验动物研究中心,生产许可证号SCXK(渝)2012-0006。自由饮食平衡1周,光照节律 ∶12 L-12 D(7∶00-19∶00),温度(20±2)℃,湿度(55±15)%。
2 方法
2.1 分组与给药 小鼠按体重随机分为7组:对照组、地西泮组、小檗碱组、黄连碱组、巴马汀组、表小檗碱组和药根碱组,每组10只。地西泮组ig 2.25 mg·kg-1·d-1,各黄连生物碱组 ig 75 mg·kg-1·d-1,对照组则灌胃等体积的生理盐水,连续给药5 d。
2.2 自主活动次数测试 末次给药后,将小鼠放入自主活动仪中,待其适应环境3 min后,分别记录其0、1、2、3 h时,小鼠5 min内的自主活动次数。
2.3 阈上剂量戊巴比妥钠诱导小鼠睡眠实验 小鼠分组与给药同“2.1”项。末次给药1 h后,每只ip阈上剂量的戊巴比妥钠60 mg· kg-1,给药容积0.01 ml·g-1。给药后立刻记时并观察和记录小鼠睡眠的潜伏期(从注射戊巴比妥钠后到小鼠翻正反射消失的时间段)和睡眠期(从翻正反射消失到翻正反射恢复的时间段)[8]。
2.4 阈下剂量戊巴比妥钠诱导小鼠睡眠实验 小鼠分组与给药同“2.1”项。末次给药1 h后,每只ip给予阈下剂量的戊巴比妥钠30 mg· kg-1,给药容积0.01 ml· g-1,观察并记录小鼠发生睡眠只数[9]。
2.5 小鼠脑组织神经递质的检测
2.5.1 分组与给药 分组:小鼠按体重随机分为7组:对照组、模型组、小檗碱组、黄连碱组、巴马汀组、表小檗碱组和药根碱组,每组10只。造模:除对照组ip生理盐水外,其余各组连续2 d ip 300 mg·kg-1PCPA。给药:各黄连生物碱组同“2.1”项,对照组及模型组灌胃等体积的生理盐水,连续给药5 d。
2.5.2 脑组织取材及处理 末次给药1 h后,将其断头处死,迅速在冰盘上剥离出小鼠的下丘脑,并称重,吸取冰冷的 0.4 mol·L-1的 HClO4,冰浴下匀浆5 min,涡旋2 min,低温高速离心2次(4℃,14 000 r·min-1,10 min),取上清液经 0.2μm滤膜过滤,作为进样品。
2.5.3 色谱条件 色谱柱:依利特Hypersil ODS2 C18柱(4.6mm×200mm,5μm);流动相0.1mol·L-1的醋酸钠缓冲液(含 0.1 mmol·L-1的 EDTA-2Na,pH 5.1)与色谱甲醇体积比 9∶1,进样量 20 μl/次,流速 1 ml·min-1,柱温 30℃,发射波长 330 nm,激发波长290 nm。
2.6 统计学处理 采用SPSS 17.0 for Windows软件进行单因素方差统计分析,多组间比较采用LSD-t检验,数据用¯±s表示。
3 结果
3.1 对小鼠自主活动的影响 如Tab 1所示,与对照组相比,地西泮组在给药后1、2、3 h明显减少小鼠自主活动的站立次数(P<0.01)。小檗碱组和黄连碱组在给药后均能降低小鼠活力(P<0.05)。其余各组在不同的时间段差异均无统计学意义(P>0.05)。
3.2 对阈上剂量戊巴比妥钠诱导小鼠睡眠的影响
Fig 1、2所示,与对照组相比,小檗碱组和地西泮组能缩短小鼠睡眠潜伏期,同时明显延长小鼠的睡眠时间(P<0.01)。黄连碱组潜伏期缩短了30.0%(P<0.01),睡眠期延长了 27.9%(P<0.05)。其余各组的小鼠睡眠潜伏期和睡眠时间差异无显著性(P>0.05)。
Tab 1 Com parison of times of spontaneousmotor activity in juvenilem ice among groups(x¯±s,n=10)

Tab 1 Com parison of times of spontaneousmotor activity in juvenilem ice among groups(x¯±s,n=10)
*P<0.05,**P<0.01 vs control.
Group After administration 0 h 1 h 2 h 3 h Control 64.2±10.5 58.4±9.3 60.5±9.4 65.6±8.2 Diazepam 62.6±11.5 32.6±6.2** 35.3±7.2** 38.3±5.4**Bererine 61.8±9.3 38.7±7.8* 42.3±6.7* 44.9±7.8*Coptisine 63.0±9.7 40.1±9.7* 42.8±8.6* 46.6±9.5*Palmatine 62.5±11.4 65.8±12.5 69.4±8.4 74.7±10.2 Epiberberine 60.2±8.1 59.4±8.9 63.8±11.0 59.2±9.3 Jatrorrhizine 63.7±10.3 60.2±8.1 58.9±7.2 60.3±9.6
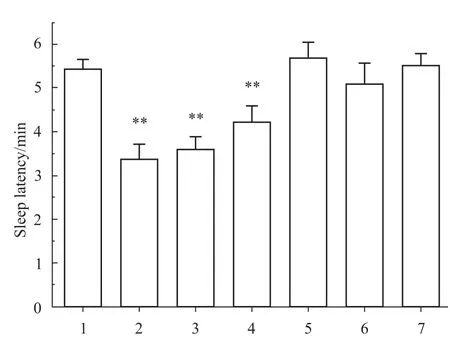
Fig 1 Effect of five Coptidis alkaloids period of sleep latency of pentobarbital in suprathreshold dose on juvenilem ice(n=10)1:Control;2:Diazepam;3:Bererine;4:Coptisine;5:Palmatine;6:Epiberberine;7:Jatrorrhizine.**P<0.01 vs control.
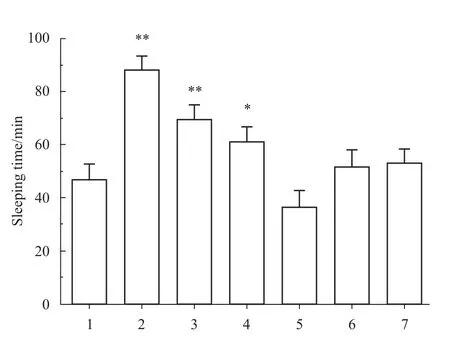
Fig 2 Effect of five Coptidis alkaloids period of sleeping time of pentobarbital in suprathreshold dose on juvenilem ice(n=10)1:Control;2:Diazepam;3:Bererine;4:Coptisine;5:Palmatine;6:Epiberberine;7:Jatrorrhizine.*P<0.05,**P<0.01 vs control.
3.3 对阈下剂量戊巴比妥钠诱导小鼠睡眠的影响Tab 2结果显示,腹腔注射阈下剂量戊巴比妥钠的对照组小鼠无翻正反射消失,阳性药物地西泮组翻正反射行为几乎全部消失,小檗碱组和黄连碱组的翻正反射消失率明显增加。提示小檗碱和黄连碱有明显协同戊巴比妥钠促进小鼠睡眠的作用。

Tab 2 Effect of five Coptidis alkaloids on sedative and hypnotic function of pentobarbital sodium with a subthreshold dose in m ice(n=15)
3.4 对小鼠下丘脑神经递质含量的影响 Fig 3为3种神经递质的高效液相色谱图,此条件下供试品溶液中的各神经递质和杂峰相互间分离良好[10]。

Fig 3 HPLC graph of three neurotransm ittersA.Standard;B.Sample;1:NE;2:DA;3:5-HT
从Tab 3可知,与对照组相比,模型组的NE和5-HT含量极大减少(P<0.01)。小檗碱组和黄连碱组的NE明显降低(P<0.05);与模型组相比,小檗碱组和黄连碱组的NE和5-HT含量明显增加(P<0.01);但各组间的 DA含量无差异(P>0.05)。
Tab 3 Change of the hypothalam ic neurotransm itters content in juvenilem ice among groups(±s,n=10,ng·g-1)
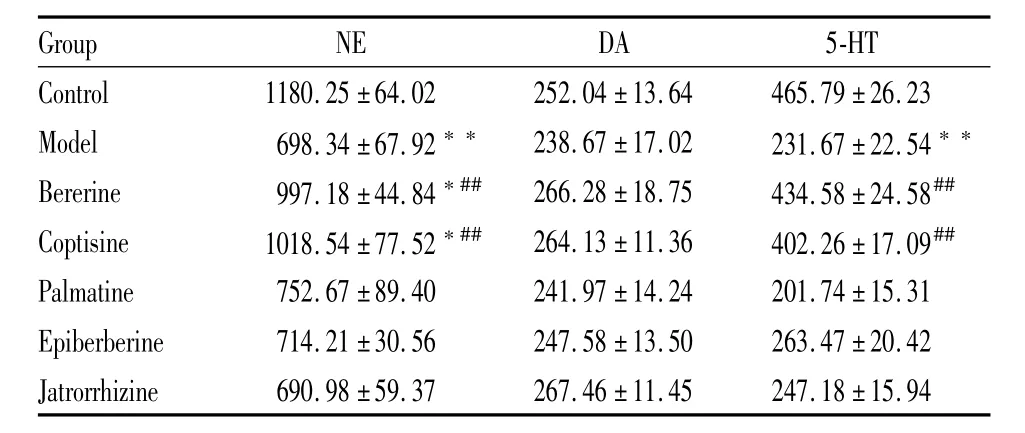
Tab 3 Change of the hypothalam ic neurotransm itters content in juvenilem ice among groups(±s,n=10,ng·g-1)
*P<0.05,**P<0.01 vs control;##P<0.01 vs model
Group NE DA 5-HT Control 1180.25±64.02 252.04±13.64 465.79±26.23 Model 698.34±67.92** 238.67±17.02 231.67±22.54**Bererine 997.18±44.84*## 266.28±18.75 434.58±24.58##Coptisine 1018.54±77.52*## 264.13±11.36 402.26±17.09##Palmatine 752.67±89.40 241.97±14.24 201.74±15.31 Epiberberine 714.21±30.56 247.58±13.50 263.47±20.42 Jatrorrhizine 690.98±59.37 267.46±11.45 247.18±15.94
4 讨论
黄连的使用在我国拥有悠久的历史。出自张仲景《伤寒论》的方剂黄连阿胶汤在现代临床上被广泛用于治疗神经衰弱、失眠[11]等病症。现代药理研究发现,黄连中小檗碱高剂量时可抑制小鼠大脑皮层兴奋过程[12]。据徐锦堂等[13]研究表明,黄连具有中枢抑制作用。本研究结果显示,5种黄连生物碱中,小檗碱和黄连碱均能明显减弱小鼠自主活动能力,明显缩短阈上剂量戊巴比妥钠诱导小鼠睡眠的潜伏期,延长其睡眠时间,并增加阈下剂量戊巴比妥钠小鼠的入睡率,提示小檗碱和黄连碱均具有镇静、协同戊巴比妥钠促睡眠作用,但黄连碱的药效作用低于小檗碱。此外,巴马汀、表小檗碱和药根碱对小鼠睡眠无明显作用。
目前研究显示,下丘脑 -垂体 -肾上腺素(HPA)轴与睡眠相关,可通过HPA轴与DA和5-HT相互作用[14],来维持相关因子的正常水平,改善睡眠状态。在促睡眠的物质基础研究中发现,睡眠与NE、DA和5-HT等在内的诸多神经递质关系密切。DA是促觉醒类的神经递质,多巴胺能神经元在睡眠-觉醒中起到重要的调节作用[15]。在神经递质含量测定中,本研究中各组别之间DA含量差异无统计学意义,因而在下丘脑中DA可能未参与小鼠的睡眠作用。据文献报道[16],下丘脑部位直接对睡眠进行调控。在注射了5-HT合成抑制剂 PCPA小鼠的下丘脑中,其5-HT含量明显减少,HPA轴呈兴奋状态。各组小鼠的昼夜节律紊乱,小鼠白昼睡眠行为几乎消失,表明PCPA小鼠失眠模型造模成功。现代药理研究表明,5-HT增多与促睡眠有关[17]。文献报道,大鼠下丘脑视前区5-HT含量增加可引起中枢性疲劳,并促进睡眠,而NE主要以兴奋中枢和觉醒功能为主,两者之间存在相互抑制作用[18-19]。本研究结果显示,小檗碱组和黄连碱组的NE和5-HT与模型组相比明显升高(P<0.01),其HPA轴受到抑制,5-HT与对照组相比无差异(P>0.05),但 NE的含量低于对照组(P<0.05),即在给予受试药物后,小鼠下丘脑中5-HT含量的升高相对抑制了NE含量恢复到正常水平,符合文献报道。综上所述,黄连生物碱中小檗碱和黄连碱可能通过抑制HPA轴,增加PCPA小鼠失眠模型下丘脑中5-HT和NE的含量,来发挥一定的镇静、催眠的作用。5种黄连生物碱中,小檗碱促小鼠睡眠作用强于黄连碱,而表小檗碱、药根碱和巴马汀对小鼠睡眠无明显影响。
参考文献:
[1] 冯奕斌,罗伟权,朱世清.从黄连及其复方古今临床应用,发掘现代临床新应用[J].中国中药杂志,2008,33(10):1221-5.
[1] Feng Y B,LuoW Q,Zhu SQ.Explore new clinical application of Huanglian and corresponding compound prescriptions from their traditional use[J].China J Chin Mat Med,2008,33(10):1221-5.
[2] 孙 蓉,黄 璐.黄连阿胶汤治疗神经衰弱60例[J].现代医药卫生,2003,19(9):1162-3.
[2] Sun R,Huang L.Rhizoma Coptidis gelatin soup to treatneurasthenia 60 cases[J].Mod Med Health,2003,19(9):1162-3.
[3] 匡艳辉,朱晶晶,王智民,彭新君.黄连属药用植物化学成分和质量控制的研究进展[J].中国药学杂志,2008,43(15):1121-5.
[3] Kuang Y H,Zhu J J,Wang Z M,Peng X J.The research progress of chemical constituents and quality control ofmedical plant Rhizoma Coptidis[J].Chin Pharm J,2008,43(15):1121-5.
[4] Kulkarni SK,Dhir A.Berberine:a plant alkaloid with therapeutic potential for central nervous system disorders[J].Photother Res,2010,24(3):317-24.
[5] 李 波,朱维良,陈凯先.小檗碱及其衍生物的研究进展[J].药学学报,2008,43(8):773-87.
[5] Li B,Zhu W L,Chen K X.Advances in the study of berberine and its derivatives[J].Acta Pharm Sin,2008,43(8):773-87.
[6] 盛亚男.交泰丸镇静催眠的有效成分研究[D].广州中医药大学,2010.
[6] Shen Y N.The study of sedative hypnotic active ingredients of jiaotai pill[D].Guangzhou Univ Chin Med,2010.
[7] Chen H Y,Ye X L,Cui X L,et al.Cytotoxicity and antihyperglycemic effect of minor constituents from Rhizoma Coptis in HepG2 cells[J].Fitoterapia,2012,83(1):67-73.
[8] Erden B F,Ulak G,Yildiz F,etal.Antidepressant,anxiogenic,and antinociceptive properties of levofloxacin in rats and mice[J].Pharm Biochem Behav,2001,68(3):435-41.
[9] 符敬伟,乔 卫,陈朝晖.酸枣仁总生物碱镇静催眠作用的实验研究[J].天津医科大学学报,2005,11(1):52-4.
[9] Fu JW,QiaoW,Chen ZH.Study on sedative hyponotic effectof total alkaloid form Semen Zizyphi Spinosae[J].J Tianjin Med Univ,2005,11(1):52-4.
[10]鲁燕侠,崔 佳,蔺兴遥,等.RP-HPLC-荧光检测法测定小鼠脑组织中5种神经递质的含量[J].解放军药学学报,2003,19(4):262-3.
[10]Lu Y X,Cui J,Lin X Y,et al.The content determination of the five transmitters in rat brain by RP-HPLC method with fluorescence detector[J].Pharm JChin PLA,2003,19(4):262-3.
[11]刘洁萍,仝小林.黄连阿胶汤治疗脑部阴虚火旺之失眠[J].实用中医内科杂志,2002,16(1):25.
[11]Liu JP,Qiong X L.Rhizoma Coptidis gelatin soup to treat insomnia of Yin deficiency fire on brain[J].JPract Tradit Chin Inter Med,2002,16(1):25.
[12]侯家玉.中药药理学[M].北京:中国中医药出版社,2002:46.
[12]Hou JY.Pharmacol Chin Mat Med[M].Beijing:China P Tradit Chin Med,2002:46.
[13]徐锦堂,王立群,徐 蓓.黄连研究发展[J].中国医学科学院报,2004,26(7):704-7.
[13]Xu JT,Wang LQ,Xu B.The research and developmentof Rhizoma Coptidis[J].Acta Acad Med Sin,2004,26(7):704-7.
[14]全世建,何树茂,钱莉莉.交泰丸交通心肾治疗失眠作用机理研究[J].辽宁中医药大学学报,2011,13(8):12-4.
[14]Quan S J,He SM,Qian L L.Study onmechanism of jiaotaipills on treatment of insomnia by communication between heartand kidney[J].JLiaoning Univ TraditChin Med,2011,13(8):12-4.
[15]Monti JM,MontiD.The involvementof dopamine in themodulation of sleep and waking[J].Sleep Med Rev,2007,11(2):113-33.
[16]孟德欣,牟 丽,黄 民,等.下丘脑Hypocretin神经肽在大鼠缰核对睡眠-觉醒调节中的作用[J].吉林大学学报:医学版,2009,35(2):214-7.
[16]Meng D X,Mou L,Huang M,et al.Effect of hypocretin neuropeptide in hypothalamus participating in regulation of habenular nucleus on sleep-wakeness process[J].J Jilin Univ(Med Ed),2009,35(2):214-7.
[17]靳新宇,库宝善,姚海燕,等.5-HT1A和5-HT2受体功能与觉醒,睡眠成分关系的研究 [J].中国药理学通报,2000,16(2):208-11.
[17]Jin X Y,Ku B S,Yao H Y,etal.Relationship between the function of5-HT1A,2 receptorsand waking-sleeping stages[J].Chin Pharmacol Bull,2000,16(2):208-11.
[18]Zhang J,Wang X,Wang M.Influence of time-varying magnetic field on the release of neurotransmitters in raphe nuclei of rats[C].Engineering in Medicine and Biology Society,2006:6214-6.
[19]Soares D D,Coimbra C C,Marubayashi U.Tryptophan-induced central fatigue in exercising rats is related to serotonin content in preoptic area[J].Neurosis Lett,2007,415(3):274-8.
