6-羟基-1H-吲唑抑制Tau磷酸化对MPP+诱导凋亡的SH-SY5Y细胞保护作用的研究
2014-05-15朱雯婷梁小凤饶进军王文雅
朱雯婷,梁小凤,饶进军,王文雅
(南方医科大学药学院临床药理研究所,广东广州 510515)
帕金森(Parkinson’s disease,PD)是中、老年人常见的一种中枢神经系统锥体外系功能障碍的慢性进行性疾病。其主要病理表现是黑质多巴胺(DA)神经元选择性变性死亡,中枢神经递质DA含量减少[1]。导致这一病理改变的确切病因目前仍不清楚,可能是多种因素共同作用的结果。研究表明,神经元凋亡在PD等神经退行性疾病的发病机制中起着关键作用[2]。因此,研究神经元凋亡的信号通路将为揭示神经元凋亡提供一个理论基础。多条信号传导通路,如c-Jun氨基末端激酶通路[3]、细胞周期再激活、p53的激活[4]、Bcl-2家族蛋白以及通过GSK-3/Tau通路的信号通路等介导了PD黒质神经元凋亡。Tau磷酸化是多条PD相关神经元凋亡信号通路的汇合点[5],Tau蛋白是中枢神经系统中重要的微管相关蛋白,其功能受磷酸化调节。在1-甲基-4-苯基-1,2,3,6-四氢吡啶(1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine,MPTP)/1-甲基-4-苯基吡啶离子(1-methyl-4-phenylpyridinium,MPP+)诱导的PD模型中(离体的细胞模型和整体的动物模型),黑质多巴胺能神经元内Tau蛋白(Ser396)异常磷酸化[6]。
既然Tau磷酸化与PD的发病机制相关,并且有研究表明抑制Tau磷酸化可以减少神经元的凋亡[7]。我们筛选了一系列能够抑制Tau磷酸化的化合物,发现6-羟基-1H-吲唑具有神经保护作用。6-羟基-1H-吲唑是一种有机化合物,其化学结构如Fig 1所示。用MPP+作用于人神经母细胞瘤细胞SHSY5Y制作PD的细胞模型,观察6-羟基-1H-吲唑对MPP+诱导凋亡的SH-SY5Y细胞是否具有作用,并探讨其可能的机制。

Fig 1 Structure of 6-Hydroxy-1H-indazole
1 材料与方法
1.1 细胞 人神经母细胞瘤细胞SH-SY5Y由中山大学中山医学院药理教研室惠赠。
1.2 药品 高糖 DMEM(Dulbecco’smodified eagle medium)培养基购自 Hyclone。6-羟基-1H-吲唑、Hoechst33258、四氮唑盐(MTT)、MPP+均购自 Sigma,在细胞实验中,6-羟基-1H-吲唑用DMSO溶解,配成100×的储备液,直接加到培养基中,使终浓度分别为 0.001、0.01、0.1、1、10和100μmol·L-1。MPP+用无血清的DMEM培养基配成100×1 mmol·L-1储备液,加到培养基中。
1.3 抗体 特异性磷酸化Tau(Ser396)的羊多克隆抗体和特异性酪氨酸羟化酶(tyrosine hydroxylase,TH)的兔多克隆抗体均购自Santa Cruz。
1.4 仪器 CO2组织培养箱(美国Forma Scientific公司);超净工作台(苏州仪器四厂);倒置光学显微镜(日本Nikon公司);冷冻离心机(德国Eppenddorf公司);酶标仪(BIO-RAD公司);电泳仪(BIO-RAD公司);半干转膜仪(BIO-RAD公司)。
1.5 SH-SY5Y细胞培养 SH-SY5Y细胞用含10%胎牛血清的高糖 DMEM培养基在37℃、5%CO2、饱和湿度的培养箱中培养。消化传代接种在96或24孔细胞培养板,待细胞贴壁后,加入不同浓度的6-羟基-1H-吲唑,2 h后加入 MPP+,培养48 h之后,按文献报道的方法进行,以MTT法检测6-羟基-1H-吲唑对 SH-SY5Y细胞的保护作用;以 Hoechst33258染色法[8]观察 6-羟基-1H-吲唑对细胞核典型凋亡形态学的影响;以ABC法观察6-羟基-1H-吲唑对细胞内TH含量的影响;MPP+处理8 h后,做TH和磷酸化Tau的免疫荧光双染[9],观察6-羟基-1H-吲唑对MPP+诱导的Tau过磷酸化的影响。在倒置荧光显微镜下随机拍照。
1.6 免疫印迹 弃培养液,用预冷的PBS漂洗细胞2次,每孔加入细胞裂解液 SDS 2 g、Tris碱0.7571 g、溴酚蓝 0.01 g、DTT 0.771 g、去离子水 90 ml、甘油10ml150μl冰面上裂解20 min,超声粉碎DNA 12 s后,(95~100)℃水浴中煮沸5 min,冷却后置于高速离心机以4℃、12 000 r·min-1离心10 min。考马斯亮蓝法进行蛋白定量。以10%SDS-聚丙烯酰胺凝胶电泳分离,半干电转移法转移至PVDF膜,室温下用封闭液封闭1 h后加入用封闭液稀释的一抗4℃过夜,d 2取出室温孵育二抗2 h,ECL显色液两种显色底物1∶1等体积混合显色,压胶片曝光,β-actin作为内参照。扫描胶片,运用gerpro analyzer对Western blot条带进行半定量分析,目的蛋白的条带的密度与β-actin相比,用相对光密度(relative optical density,ROD)来表示。
1.7 统计学处理 实验结果以¯x±s表示,应用SPSS 13.0统计软件进行统计学分析。
2 结果
2.1 MPP+浓度依赖性地诱导SH-SY5Y细胞凋亡
MPP+对SH-SY5Y细胞的毒性成浓度依赖性,在200μmol·L-1MPP+作用 SH-SY5Y细胞48 h后,与空白组细胞相比,其细胞存活率降至(47.80±0.84)%(P<0.01)(Fig 2)。

Fig 2 MPP+induces SH-SY5Y cells apoptosis in a dose-dependentmannerCells were treated with various concentrations(0.002~1 mmol·L-1)of MPP+for 48 h.The cell viability was analyzed by the conventional MTT reduction assay.**P<0.01 vs control.
2.2 MPP+诱导SH-SY5Y细胞内 Tau蛋白过度磷酸化 Western bolt结果显示 200μmol·L-1MPP+处理2 h之后,p-Tau(Ser396)水平开始升高,在8 h达到高峰,随后逐渐下降。表明MPP+作用SH-SY5Y细胞会导致Tau蛋白过度磷酸化(Fig 3)。

Fig 3 MPP+induces hyperphosphorylation of Tau(Ser396)in cultured SH-SY5Y cellsSH-SY5Y cellswere treated with 200μmol·L-1 MPP+ for 0,2,4,8,16 and 24 h respectively.The levels of p-Tau(Ser396)were detected by Western blotwith the specific antibodies.**P<0.01 vs control group.
2.3 6-羟基-1H-吲唑对 MPP+诱导凋亡的 SHSY5Y细胞具有保护作用 提前2 h加入0.001、0.01、0.1、1、10和 100μmol·L-16-羟基-1H-吲唑,200μmol·L-1MPP+孵育48 h,细胞存活率与空白组 相 比 分 别 为 (70.36±0.36)%、(67.86±3.77)%、(67.57±3.11)%、(63.84±1.43)%、(61.22±0.54)%和(59.86±1.34)%(P<0.01)(Fig 4A)。用ABC法检测细胞内残余多巴胺神经元的数目,与溶剂对照组相比,MPP+导致多巴胺能神经元大量丢失,而0.1μmol·L-16-羟基-1H-吲唑会明显的抑制因MPP+毒性所引起的TH阳性细胞数目的减少(Fig 4C,D)。0.1μmol·L-16-羟基-1H-吲唑在不加MPP+的情况下单独作用于细胞,与空白组相比细胞存活率的改变没有统计学意义(Fig 4B)。
2.4 6-羟基-1H-吲唑对 MPP+诱导的SH-SY5Y细胞的凋亡具有抑制作用 用Hoechst 33258染色检测细胞内细胞核的凋亡情况。在溶剂对照组内,细胞核形态正常(Fig 5A)。在200μmol·L-1MPP+处理48 h之后,引起了细胞核体积缩小(白色箭头显示核固缩)(Fig 5B),在用0.1μmol·L-16-羟基-1H-吲唑预处理2 h之后,核固缩明显减轻(Fig 5C)。
2.5 6-羟基-1H-吲唑对 MPP+诱导的SH-SY5Y细胞内Tau蛋白过磷酸化水平的影响 免疫荧光双染发现在溶剂对照组,TH-阳性细胞内有微弱p-Tau(Ser 396)的表达,双染的SH-SY5Y细胞呈现黄色;MPP+处理8 h后,TH-阳性细胞内 p-Tau(Ser396)水平明显升高,双染细胞显示橙红色;0.1μmol·L-16-羟基-1H-吲唑预处理 2 h后,细胞内 p-Tau(Ser396)水平明显下降,双染细胞显示黄色(Fig 6)。
Western blot的结果显示 MPP+处理8 h后,0.1 μmol·L-16-羟基-1H-吲唑使细胞内 p-Tau(Ser396)表达水平与MPP+组比较明显降低(Fig 7)。

Fig 4 Effect of 6-Hydroxy-1H-indazole on MPP+-induced decrease in SH-SY5Y cell viabilityA:Cell viability exposed to MPP+ with or without6-hydroxy-1H-indazole.Cells were pretreated with various concentrations(0.001-100μmol·L-1)of6-hydroxy-1H-indazole for2 h and then treated with 200μmol·L-1 MPP+for48 h;B:Cellswere treated with 200μmol·L-1 MPP+in absence or presence of0.1μmol·L-1 6-hydroxy-1H-indazole for 48 h as described;C:Quantification of TH-positive cellswas carried outas described in the Materials and Methods;D:Immunocytochemistry staining of TH-positive cells,a)vehicle treated(control);b)MPP+treated;c)along with 6-hydroxy-1H-indazole 0.1μmol·L-1.Note themarked reduction in TH-positive cell after treated with 200μmol·L-1 MPP+.6-hydroxy-1H-indazole at 0.1μmol·L-1 significantly protected TH-positive neurons from death induced by MPP+ exposure(×200).##P<0.01 vs control;**P<0.01 vs MPP+.
3 讨论
PD是一种常见的神经退行性疾病,PD患者的黑质致密部会出现路易小体和路易神经突起,多巴胺能神经元发生凋亡。路易小体最初是在神经纤维缠结中被发现的,聚集的过磷酸化的Tau蛋白是神经纤维缠结的主要成分,构成毒性分子,可猎获神经元中其他正常的微管蛋白,使微管结构崩解,神经元退变[10],推测Tau蛋白磷酸化和PD黑质神经元凋亡有一定的关系。在PD患者的脑部神经突触富集的地方发现Tau的Ser396位点过度磷酸化,同时伴随着α-突触核蛋白的磷酸化[11],进一步确定Tau蛋白磷酸化在PD的发病机制中起着重要的作用。

Fig 5 Nuclear-stained figures of 6-Hydroxy-1H-indazole inhibitory effect on SH-SY5Y cells apoptosis induced by MPP+A:Control,vehicle-treated cells;B:200μmol·L-1 MPP+induced apoptosis;C:Alongwith 6-Hydroxy-1H-indazole0.1μmol·L-1.Note nuclear condensation and heterochramatin clumping,the typical apoptotic morphology in b,but few in a and c(×200).
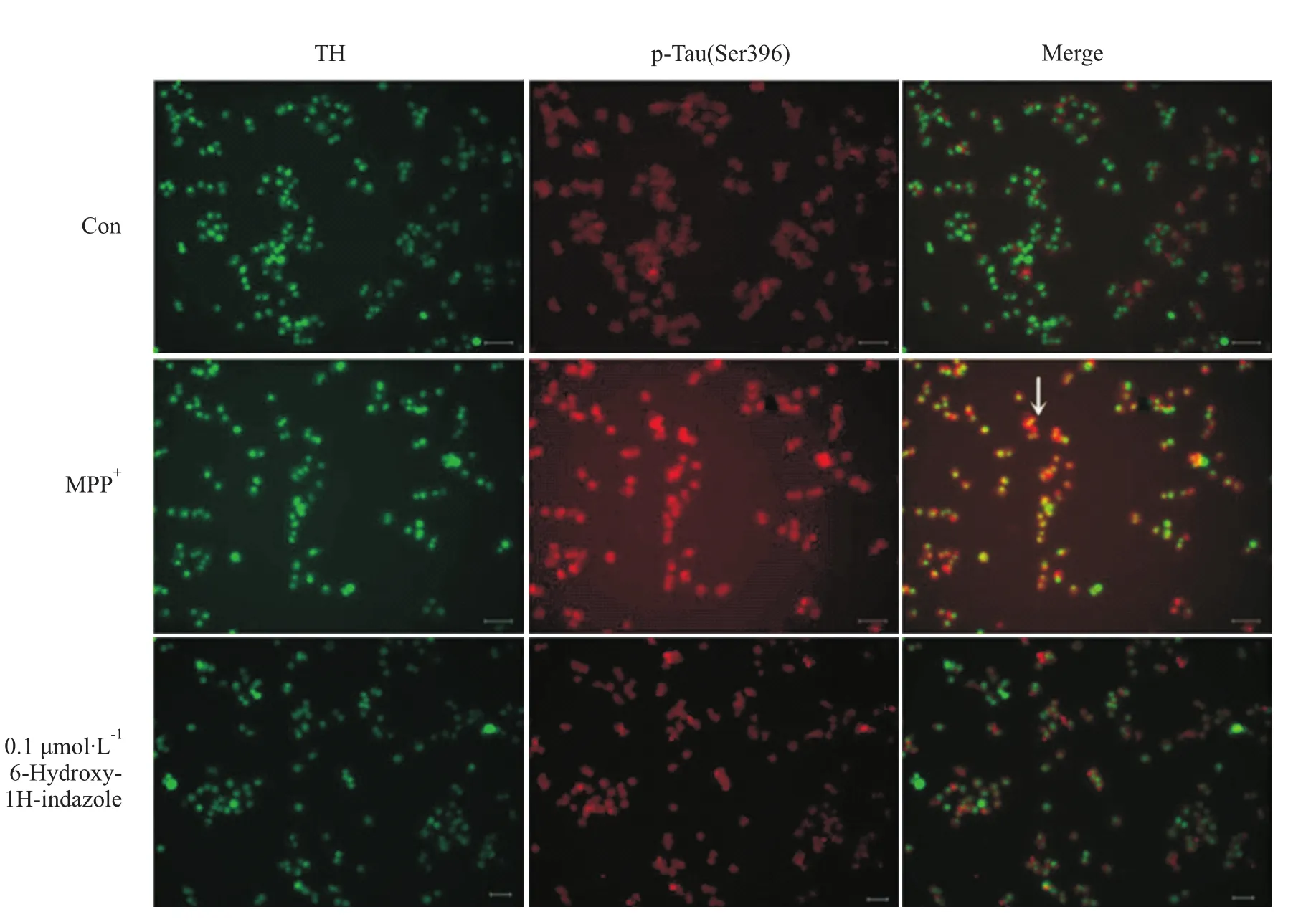
Fig 6 6-Hydroxy-1H-indazole attenuates MPP+-induced hyperphosphorylation of Tau(Ser396)in cultured SH-SY5Y cellsDetection of p-Tau(Ser396)expression by immunocytochemicalwas at8 h after MPP+treatment in cultured SH-SY5Y cells.Specific TH-antibody was used to detect dopaminergic neurons.Vehicle-treated cultures showed low phosphorylative levels on Tau(Ser396)(red)in TH positive cells.Note more Tau(Ser396)were phosphorylated in MPP+treated cells,resulting in neurons stainingwith salmon pink(white arrow),and MPP+-increased Tau(ser396)phosphorylation in TH positive neurons could be prevented by 0.1μmol·L-1 6-Hydroxy-1H-indazole(×200).
人神经母细胞瘤细胞SH-SY5Y是一种具有多巴胺能神经元和胆碱能神经元特征的细胞[12]。TH是一种非血红素铁蛋白,体内TH主要分布于中枢儿茶酚胺(catecholamines,CA)能神经元、外周交感神经节非肾上腺素能神经元、交感神经纤维、肾上腺髓质非肾上腺素能和肾上腺素能细胞。在脑内,TH催化CA类神经递质体内合成的起始步骤,即L-酪氨酸羟化形成 L-多巴(L-DOPA)的反应。与参与CA合成步骤的其他催化酶相比,TH含量最少、合成速率最低、催化活性最弱且底物专一性最强,因而被认为是包括DA在内的CA合成的限速酶。TH同时还是脑内多巴胺神经元的蛋白标志,TH免疫组织化学方法(TH-IR)常被用于显示DA能神经元细胞体及其突起。因此我们在实验中使用TH的免疫细胞化学方法标示SH-SY5Y细胞。大量研究证实动物注射MPTP可以复制出黑质多巴胺能神经元选择性退化的过程,并且出现PD类似的行为和病理特征,同时其活性代谢产物MPP+能够诱导体外培养的多巴胺能神经元凋亡,所以现在MPP+体外作用于SH-SY5Y细胞已经被广泛运用于药物筛选[13]。实验结果显示,MPP+可导致SH-SY5Y细胞的存活率降低,且呈现浓度依赖性,IC50为(193±3.1)μmol·L-1,其中 200μmol·L-1的 MPP+作用SH-SY5Y细胞48 h后,细胞的存活率为(47.80±0.84)%(P<0.01),因此选取 48 h和 200μmol·L-1MPP+作用于SH-SY5Y细胞作为PD的细胞模型。
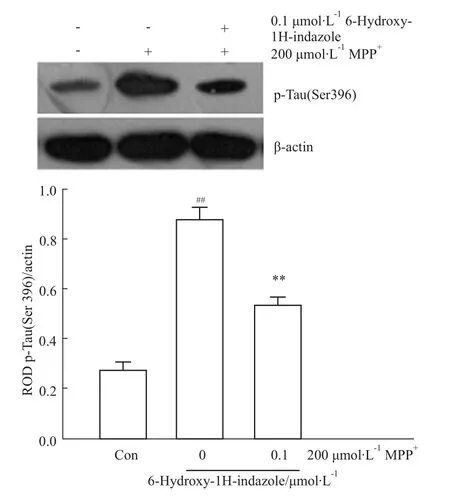
Fig 7 6-Hydroxy-1H-indazole decreases p-Tau(Ser396)which was increased by MPP+SH-SY5Y cells were treated with 200μmol·L-1 MPP+ for 8 h.The levels of p-Tau(Ser396)were detected by Western blot with the specific antibodies.##P<0.01 vs control;**P<0.01 vs MPP+.
我们在先前的实验中亦证实,色霉素A3(chromo-mycin A3)是一个抗癌药物,抑制 Tau(Ser396)磷酸化,进而抑制MPP+诱导的体外培养的多巴胺能神经元的凋亡[14]。特异性的GSK-3β抑制剂ARA014418可降低Tau磷酸化,对PD动物起治疗作用[9]。研究也发现,Rho激酶 (ROCK)抑制剂通过抑制CDK5对Tau的磷酸化而改善全脑缺血模型鼠的学习和空间记忆能力[15]。上述实验结果提示:抑制Tau蛋白磷酸化可以减少神经元的凋亡。因此我们通过美国一个专利(US7629374B2,USE OF AMINOINDAZOLE DERIVATIVES FOR THE INHIBITION OF TAU PHOSPHORYLATION),选择一些结构类似物,筛选发现氨基吲唑衍生物能够抑制Tau蛋白磷酸化,进一步发现6-羟基-1H-吲唑的保护作用。用 0.1μmol·L-16-羟基-1H-吲唑作用 SHSY5Y细胞2 h后再孵育MPP+48 h,发现细胞的存活率明显增高,为(63.84±1.43)% (P<0.01)。同时细胞单独用 0.1μmol·L-16-羟基-1H-吲唑在不加MPP+情况下作用,发现其细胞的存活率与溶剂对照组间的差异没有统计学意义,说明药物本身没有毒性。TH的ABC染色发现,在单独MPP+作用的组别,TH阳性细胞的数目明显减少,而用0.1 μmol·L-16-羟基-1H-吲唑作用的组别均可保护性干预MPP+对多巴胺能神经元的毒性,减少TH阳性细胞数目的死亡。Hoechst 33258染色结果显示,单用MPP+组的细胞核内可见浓染致密的颗粒块状荧光,而在用6-羟基-1H-吲唑处理的细胞内,细胞呈弥散的均匀荧光,说明6-羟基-1H-吲唑能明显的减轻MPP+诱导的细胞凋亡。
Western blot免疫印迹检测发现200μmol·L-1的MPP+会引起 p-Tau(Ser396)蛋白的水平升高,2 h、4 h水平逐步升高,在8 h时达到顶峰,然后随着时间的延长反而降低。因此选择MPP+作用于SHSY5Y细胞8 h这个时间点,用酪氨酸羟化酶(TH)和p-Tau(Ser396)的荧光双染进一步来证实,6-羟基-1H-吲唑对TH阳性细胞内Tau(Ser396)的磷酸化水平的影响。结果发现6-羟基-1H-吲唑可以明显地降低TH-阳性细胞内Tau(Ser396)的磷酸化,从而对MPP+诱导凋亡的SH-SY5Y细胞具有保护作用。
综上所述,MPP+诱导细胞凋亡伴随着Tau的过磷酸化,而6-羟基-1H-吲唑可明显对抗MPP+的神经毒作用,并且抑制了Tau磷酸化。这提示:通过药物干扰改变Tau蛋白的磷酸化水平可能是治疗PD的一种新策略,而6-羟基-1H-吲唑可以发挥这样的作用。我们计划继续研究6-羟基-1H-吲唑抑制Tau磷酸化的机制,并且通过用MPTP注射动物来制造PD动物模型,观察6-羟基-1H-吲唑是否能够降低MPTP对黑质多巴胺能神经元的损耗,并且改善行为学的损伤,由此进一步证明,6-羟基-1H-吲唑是一个可以通过调节Tau蛋白的代谢来达到治疗效果的化学物质。
参考文献:
[1] Schneider S A,Obeso JA.Clinical and pathological features of parkinson′s disease[J].Curr Top Behav Neurosci,2014[Epub ahead of print].
[2] Venderova K,Park D S.Programmed cell death in Parkinson's disease[J].Cold Spring Harb Perspect Med,2012,2(8)pii:a009365.doi:10.1101/cshperspect.a009365.
[3] Rodriguez-Blanco J,Martin V,Garcia-Santos G,et al.Cooperative action of JNK and AKT/mTOR in 1-methyl-4-phenylpyridinium-induced autophagy of neuronal PC12 cells[J].JNeurosciRes,2012,90(9):1850-60.
[4] Zhu G,Wang X,Wu S,LiQ.Involvementof activation of PI3K/Akt pathway in the protective effects of puerarin against MPP+-induced human neuroblastoma SH-SY5Y cell death[J].Neurochem Int,2012,60(4):400-8.
[5] Lei P,Ayton S,Finkelstein D I,et al.Tau protein:relevance to Parkinson’s disease[J].Int J Biochem Cell Biol,2010,42(11):1775-8.
[6] Duka T,Sidhu A.The neurotoxin,MPP+,induces hyperphosphorylation of Tau,in the presence of alpha-Synuclein,in SHSY5Y neuroblastoma cells[J].Neurotox Res,2006,10(1):1-10.
[7] Himmelstein D S,Ward SM,Lancia JK,et al.Tau as a therapeutic target in neurodegenerative disease[J].Pharmacol Ther,2012,136(1):8-22.
[8] 黄 琼,越茂松,季秋虹,等.曲古抑菌素A对SH-SY5Y细胞缺氧/缺糖损伤的保护作用[J].中国药理学通报,2013,29(10):1395-400.
[8] Huang Q,Yue M S,JiQH,etal.Neuroprotective effects of TSA against oxygen-glucose deprivation in SH-SY5Y cells[J].Chin Pharmacol Bull,2013,29(10):1395-400.
[9] Wang W,Yang Y,Ying C,et al.Inhibition of glycogen synthase kinase-3beta protects dopaminergic neurons from MPTP toxicity[J].Neuropharmacology,2007,52(8):1678-84.
[10]Buchman A S,Shulman JM,Nag S,et al.Nigral pathology and parkinsonian signs in elders without Parkinson disease[J].Ann Neurol,2012,71(2):258-66.
[11]Muntane G,Dalfo E,Martinez A,Ferrer I.Phosphorylation of tau and alpha-synuclein in synaptic-enriched fractions of the frontal cortex in Alzheimer′s disease,and in Parkinson's disease and related alpha-synucleinopathies[J].Neuroscience,2008,152(4):913-23.
[12]Xie H R,Hu L S,Li G Y.SH-SY5Y human neuroblastoma cell line:in vitro cellmodel of dopaminergic neurons in Parkinson′s disease[J].Chin Med J(Engl),2010,123(8):1086-92.
[13]Hare D J,Adlard PA,Doble PA,Finkelstein D I.Metallobiology of 1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine neurotoxicity[J].Metallomics,2013,5(2):91-109.
[14]王文雅,黎明涛,饶进军,朱小南.色霉素对多巴胺能神经元的保护作用[J].中国药理学通报,2010,26(4):522-6.
[14]Wang W Y,LiM T,Rao J J,Zhu X N.The protective action of chromomycin on dopaminergic neurons[J].Chin Pharmacol Bull,2010,26(4):522-6.
[15]Castro-Alvarez JF,Gutierrez-Vargas J,Darnaudery M,Cardona-Gómez G P.ROCK inhibition prevents tau hyperphosphorylation and p25/CDK5 increase after global cerebral ischemia[J].Behav Neurosci,2011,125(3):465-72.
