苯磺酸氨氯地平印迹聚合物的合成、性能及应用
2014-05-14许文静张文生张社利
许文静,张文生,张社利
(焦作师范高等专科学校 理工学院,河南 焦作 454000)
苯磺酸氨氯地平(化学名为3-乙基-5-甲基-2-(2-氨乙氧甲基)-4-(2-氯苯基)-1,4-二氢-6-甲基-3,5-吡啶二羧酸酯苯磺酸盐)为第三代双氢吡啶类钙拮抗剂,因其具有服药量低、药效维持时间长、不良反应少和保护靶器官等优点,是理想的长效降压药物,也是目前临床上治疗冠心病和高血压的重要药物[1-2]。
常用的分离检测苯磺酸氨氯地平的方法包括:高效液相色谱法[3]、紫外分光光度法[4]、反相高效液相色谱法[5]和高效毛细管电泳法[6]等,其中高效液相色谱法是分离检测苯磺酸氨氯地平的标准方法。对于生物试样(如血浆等),常用萃取法提取其中的目标物进行测定,但该方法耗费溶剂较多、对环境有污染且测试时间长[7]。
分子印迹聚合物是一种人工合成的以待分离分子为模板、具有分子识别功能的聚合物[8-10],具有结构预定性、分子识别性、稳定性好及使用寿命长等优点,在生物活性物质、农药残留和环境污染物等的选择性富集、分离和检测方面有广泛的应用前景[11-13]。
本工作以苯磺酸氨氯地平为模板分子、丙烯酸(AA)为单体、乙二醇二甲基丙烯酸酯(EGDMA)为交联剂,利用本体聚合法合成了苯磺酸氨氯地平印迹聚合物(MIPs)。利用FTIR、SEM和静态吸附等方法分析了MIPs的结构及吸附性能,并将其作为分散剂应用于血浆中苯磺酸氨氯地平的富集分离。
1 实验部分
1.1 试剂和仪器
苯磺酸氨氯地平:纯度大于98%,常州瑞明药业有限公司;AA:分析纯,上海化学试剂公司;EGDMA:分析纯,广州双键贸易有限公司;偶氮二异丁腈(AIBN):分析纯,广州化学试剂公司;氯仿、丙酮、甲醇、乙酸:分析纯,天津市科密欧化学试剂有限公司。
Quonxe 2000 型扫描电子显微镜:FEI公司;LC-20AT型液相色谱仪:岛津公司;Lambda 35型紫外可见分光光度计、Spectrum 100型傅里叶变换红外光谱仪:PE公司;RFJ型小型安培瓶熔封机,吉首市中诚制药机械厂。
1.2 本体聚合合成MIPs
取苯磺酸氨氯地平0.567 1 g(1 mmol)溶于10 mL氯仿溶剂中,加入AA 0.274 5 g(4 mmol),振荡60 min;再分别加入交联剂EGDMA 3.76 mL(20 mmol)和AIBN 0.035 0 g,超声振荡20 min后通入氮气,熔封;然后置于60 ℃水浴中振荡恒温反应24 h;所得块状聚合物经粉碎后筛分,置于索氏抽提器中用甲醇与乙酸的混合溶液(体积比9∶1)抽提洗涤,直至抽提液用紫外可见分光光度计检测无分子吸收;最后用甲醇将聚合物洗涤至中性,用丙酮反复沉降,除去过细粒子,80 ℃下真空干燥24 h即得到MIPs。
非印迹聚合物(NIPs)的制备按上述方法进行,但不加苯磺酸氨氯地平。
1.3 分析方法
用傅里叶变换红外光谱仪分析MIPs和NIPs的结构,KBr压片;用扫描电子显微镜对真空干燥后的MIPs和NIPs的表面形貌进行观察。HPLC分析以Inertsil DOS-SP(4.6 mm×150 mm×5 μm)为分离柱,流动相为甲醇-乙腈-水的混合物(体积比为70∶22∶8),流量1.0 mL/min,检测波长237 nm,柱温25 ℃,进样量10 μL,采用标准曲线法定量。
1.4 MIPs对苯磺酸氨氯地平的吸附性能研究
1.4.1 吸附动力学实验
称取0.5 g MIPs或NIPs,加入质量浓度为200 mg/L的苯磺酸氨氯地平水溶液,在25 ℃恒温摇床中密闭振荡24 h,从振荡开始计时,分别在1,5,15,30 min 及1,3,5,7,9 h时抽取吸附液,离心分离,取上清液,用紫外分光光度计在237 nm处测定吸光度,考察MIPs或NIPs对苯磺酸氨氯地平分子的吸附动力学。
1.4.2 静态吸附实验
精确称取50 mg MIPs和NIPs各10份,置于150 mL磨口锥形瓶中,分别加入50 mL不同质量浓度的苯磺酸氨氯地平水溶液,在25 ℃恒温摇床中密闭振荡24 h后,离心分离,取上清液于237 nm 处测定其吸光度。吸附量(Q)计算公式如下:

式中,ρ0为苯磺酸氨氯地平初始质量浓度,mg/L;ρe为苯磺酸氨氯地平平衡质量浓度,mg/L;V为溶液体积,L;m为MIPs或NIPs的质量,g;M为苯磺酸氨氯地平的相对分子质量,567.05;Q1为摩尔吸附量,μmol/g;Q2为质量吸附量,mg/g。
1.5 MIPs用作固相分散剂
按文献[7]报道的方法制备血浆,然后准确移取0.5 mL血浆于50 mL烧杯中,加入一定量的苯磺酸氨氯地平标准溶液,混合均匀,再加入0.5 g MIPs,充分搅拌上述混合物,使待测血浆和苯磺酸氨氯地平均匀分散在MIPs中并自然风干形成固相基质。在5 mL的注射器中,下端垫一层滤纸,将上述固相基质装入,并轻轻敲实,上面加盖一层滤纸,压紧。用4 mL正己烷分2次洗涤烧杯和玻璃棒并将洗涤液淋洗注射器,弃去淋出液。再用4 mL甲醇分2次洗涤烧杯和玻璃棒并用洗涤液洗脱注射器,然后用2 mL甲醇洗脱注射器。收集3次洗脱液,浓缩至干后,溶于1.0 mL甲醇-乙腈-水的混合物(体积比为70∶22∶8)中,进行HPLC分析。
2 结果与讨论
2.1 FTIR的表征结果
MIPs和NIPs的FTIR谱图见图1。
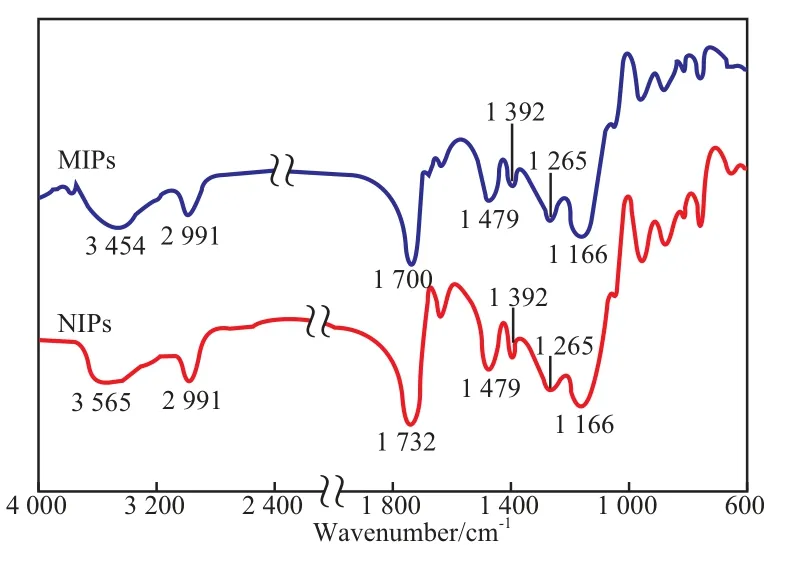
图1 MIPs和NIPs的FTIR谱图Fig.1 FTIR spectra of MIPs and NIPs.
从图1可看出,2 991 cm-1处的吸收峰归属于C—H键的伸缩振动;1 479,1 392 cm-1处的吸收峰归属于C—H键的面内弯曲振动;1 265,1 166 cm-1处的吸收峰归属于C—O键的伸缩振动。NIPs的FTIR谱图中,归属于C—H键的伸缩振动吸收峰出现在3 565 cm-1处;归属于键的伸缩振动吸收峰出现在1 732 cm-1处。而在MIPs的FTIR谱图中,上述吸收峰分别移至3 454 cm-1和1 700 cm-1处,峰形与NIPs相比略有变化。表征结果显示,MIPs和NIPs的吸收峰具有相似的峰型和基本相同的峰位置,说明苯磺酸氨氯地平分子与AA和EGDMA分子之间的作用力为分子间作用力和氢键。
2.2 MIPs的形态分析
MIPs和NIPs的SEM照片见图2。从图2可看出,两者均具有不规则形貌的特征,这是由于制作过程中的粉碎研磨导致的。从图2a可看出,MIPs表面突起多而明显。对比图2c和d可看出,MIPs的表面粗糙,孔穴多而大;而NIPs的表面较致密,孔穴少而小。表征结果显示,在MIPs中形成了与苯磺酸氨氯地平分子相匹配的立体孔穴。这种带有苯磺酸氨氯地平分子印迹的立体孔穴有利于提高吸附性能,从而提高了MIPs对苯磺酸氨氯地平的吸附性和选择性。

图2 MIPs和NIPs的SEM照片Fig.2 SEM images of MIPs and NIPs.
2.3 MIPs的吸附动力学
MIPs和NIPs对苯磺酸氨氯地平的吸附动力学曲线见图3。由图3可知,MIPs和NIPs对苯磺酸氨氯地平的吸附量均在起始阶段迅速增加,MIPs在前15 min内的吸附量即达到292 μmol/g,为平衡吸附量的97%,接近吸附平衡状态;NIPs在15 min内的吸附量达到215 μmol/g,为平衡吸附量的90%,也接近吸附平衡状态。MIPs比NIPs的吸附量提高了36%,说明MIPs比NIPs对苯磺酸氨氯地平的吸附量大、吸附平衡时间稍短、吸附性能好。

图3 MIPs和NIPs对苯磺酸氨氯地平的吸附动力学曲线Fig.3 Adsorption kinetics curves of amlodipine besylate on MIPs and NIPs.
2.4 MIPs的吸附等温线及Scatchard分析
MIPs和NIPs对苯磺酸氨氯地平的吸附等温线见图4。从图4可看出,随苯磺酸氨氯地平初始质量浓度从40 mg/L增至220 mg/L,MIPs对苯磺酸氨氯地平的吸附量从32.2 mg/g增至124.2 mg/g,而NIPs对苯磺酸氨氯地平的吸附量从22.9 mg/g增至96.6 mg/g。实验结果表明,MIPs对苯磺酸氨氯地平的吸附量明显高于NIPs。这是因为,在印迹过程中苯磺酸氨氯地平分子在MIPs中留下了与之空间结构相匹配的具有多重作用点的立体空穴,这种空穴对苯磺酸氨氯地平具有高度亲和力和特异识别性,而NIPs中功能团的分布是任意的,没有形成与苯磺酸氨氯地平分子在空间结构上互补的分子识别位点,对苯磺酸氨氯地平没有特异选择性。

图4 MIPs与NIPs对苯磺酸氨氯地平的吸附等温线Fig.4 Adsorption isotherms of amlodipine besylate on MIPs and NIPs.
为考察M I P s表面位点的分布特征,用Scatchard等温吸附模型分析了MIPs的吸附等温线(见式(3)):

式中,KD为亲和位点的平衡离解常数;Qmax为最大表观吸附量,mg/g。
苯磺酸氨氯地平在MIPs上的 Scatchard 吸附等温线见图5。从图5可看出,Q/ρe~Q呈2条斜率不同的直线,说明MIPs中主要存在2种不同类型的亲和位点。由斜率和截距可求得这2种亲和位点的KD和Qmax:高亲和位点的KD1=129.70 mg/L,Qmax1=309.49 mg/g;低亲和位点的KD2=8.56 mg/L,Qmax2=71.39 mg/g。实验结果表明,MIPs表面2种亲和位点对苯磺酸氨氯地平的最大表观吸附量分别为309.49 mg/g和71.39 mg/g。
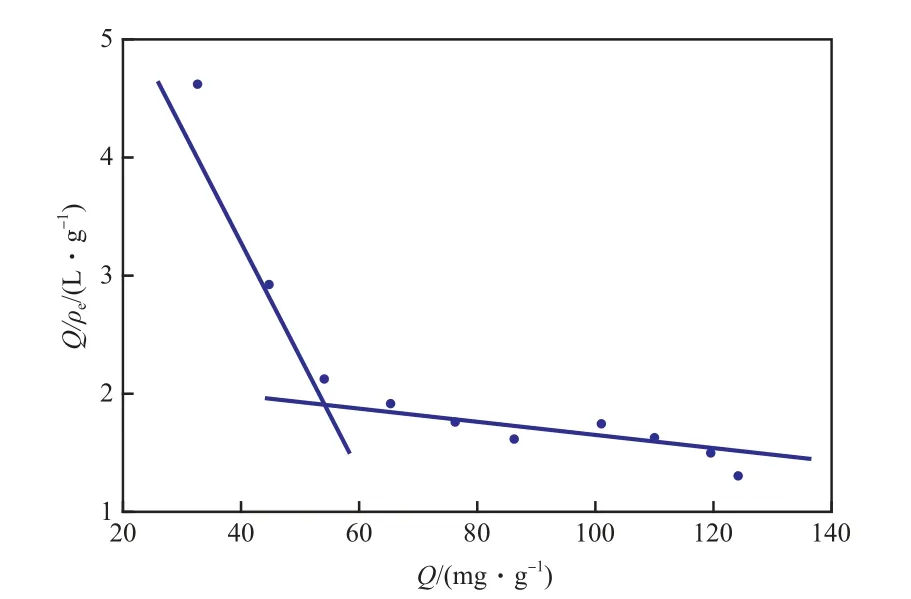
图5 苯磺酸氨氯地平在MIPs上的 Scatchard 吸附等温线Fig.5 Scatchard adsorption isotherms of amlodipine besylate on MIPs.
2.5 MIPs富集分离血浆中苯磺酸氨氯地平
利用MIPs分散剂将含苯磺酸氨氯地平的血浆制成固相基质,经前处理后可在HPLC上检测血浆中的苯磺酸氨氯地平的含量。分散剂处理后血浆的HPLC谱图见图6。从图6可看出,保留时间为3.9 min的吸收峰归属于苯磺酸氨氯地平。以MIPs为分散剂时苯磺酸氨氯地平的加标回收率为95.4%,而以NIPs为分散剂时的加标回收率较低,血浆中的杂质不会干扰目标化合物的测定。对图6中B谱线的峰面积积分,得线性回归方程y=23 022.1x-5.731,线性范围0.5~20.0 μg/L,线性相关系数r=0.999 9,相对标准偏差RSD=1.4%,最低检测限0.5 μg/L,定量限为1.7 μg/L,符合生物试样的分析要求。应用结果表明,MIPs可对血浆中的苯磺酸氨氯地平进行有效地富集分离,且溶剂用量少,加标回收率高,操作简单易行。
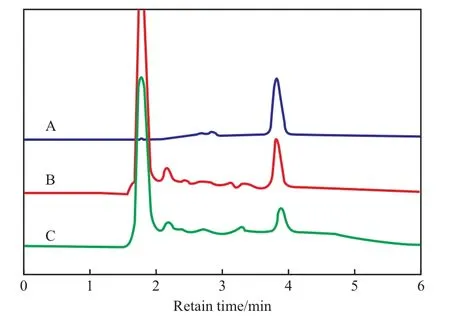
图6 分散剂处理后血浆的HPLC谱图Fig.6 HPLC analysis of blood plasma after treatment with dispersants.
3 结论
1)以苯磺酸氨氯地平为模板分子、AA为单体、EGDMA为交联剂,采用本体聚合法合成了MIPs。MIPs具有与苯磺酸氨氯地平分子相匹配的孔穴,且孔穴中含有与苯磺酸氨氯地平空间结构相匹配的识别位点,从而增加了MIPs对苯磺酸氨氯地平的吸附性和选择性。
2)MIPs对苯磺酸氨氯地平的吸附量比NIPs对苯磺酸氨氯地平的吸附量提高了36%。MIPs表面存在2种不同性质的亲和位点,对苯磺酸氨氯地平的最大表观吸附量分别为309.49 mg/g和71.39 mg/g。
3)MIPs可对血浆中的苯磺酸氨氯地平进行有效地富集分离,加标回收率95.4%,血浆中的杂质不会干扰目标化合物的测定,最低检测限0.5 μg/L,定量限为1.7 μg/L,符合生物试样的分析要求,且溶剂用量少,操作简单易行。
[1]Rosenthal T,Gavras I. Fixed-Drug Combinations as First-Line Treatment for Hypertension[J]. Prog Cardiovasc Dis,2006,48(6):416 - 425.
[2]Julius S,Kjeldsen S E,Weber M,et al. Outcones in Hypertensive Patients at High Cardiovascular Risk Treated with Regimens Based on Valsartan or Amlodipine:The VALUE Randomized Trial[J]. Lancet,2004,363(9426):2022 -2031.
[3]赖可,晁若冰,李楠,等. HPLC测定复方氨氯地平胶囊的含量[J]. 华西药学杂志,2010,25(6):748 - 749.
[4]Rahman N,Singh M,Hoda M N. Application of Oxidants to the Spectrophotometric Determination of Amlodipine Besylate in Pharmaceutical Formulations[J]. Ⅱ Farmaco,2004,59(11):913 - 919.
[5]胡在林. 反相高效液相色谱法测定苯磺酸氨氯地平胶囊的含量和有关物质[J]. 中国药业,2011,20(12):28 - 29.
[6]李志伟,赵云超,齐建敏. 高效毛细管电泳法测定缬沙坦苯磺酸氨氯地平[J]. 河北大学学报:自然科学版,2012,32(2):149 - 153.
[7]王悦.苯磺酸氨氯地平分散片健康人体药动学和相对生物利用度研究[D]. 郑州:郑州大学,2007.
[8]Han M,Kane R,Goto M,et al. Discriminate Surface Molecular Recognition Sites on a Microporous Substrate:A New Approach[J]. Macromolecules,2003,36(12):4472 - 4477.
[9]Iberer G,Hahn R,Jungbauer A. Monoliths as Stationary Phases for Separating Biopolymers:Fourth-Generation Chromatography Sorbents[J]. LC GC,1999,17(11):998 - 1005.
[10]Ma Yue,Zhang Ying,Zhao Man,et al. Eff i cient Synthesis of Narrowly Dispersed Molecularly Imprinted Polymer Microspheres with Multiple Stimuli-Responsive Template Binding Properties in Aqueous Media[J]. Chem Commun,2012(48): 6217 - 6219.
[11]Poole C F. New Trends in Solid-Phase Extraction[J]. TrAC Trends Anal Chem,2003,22(6):362 - 373.
[12]Pichon V,Haupt K. Affinity Separations on Molecularly Imprinted Polymers with Special Emphasis on Solid Phase Extraction[J]. J Liq Chromatogr Related Technol,2006,29(7/8):989 - 1023.
[13]黄红萍,游勇基. 分子印迹固相萃取-液相色谱法测定喘息灵胶囊中盐酸克仑特罗的含量[J]. 药物分析杂志,2012,32(2):233 - 236.
