松花粉硫酸酯化多糖调控小鼠T细胞[Ca2+]i的研究
2014-05-14李娜娜
李娜娜,刘 铭,耿 越
松花粉具有很高的营养、保健及药用价值,具有提高机体免疫力、调节代谢、调血脂和养颜等功效,在国内外已被广泛地应用于保健品、药品、化妆品和饲料添加剂等领域[1]。本实验室前期工作发现松花粉多糖尤其是其酯化多糖的免疫调节作用非常明显[2]。多糖经硫酸酯化修饰后,由于硫酸基团的空间位阻和静电排斥效应等改变了多糖原来结构,提高了硫酸酯化多糖水溶性,具有抗病毒、抗肿瘤、调节免疫系统和抗凝血等生物活性[3]。钙离子是机体中多种生理活动不可或缺的离子,细胞质内钙离子浓度升高是T细胞被活化引起的最早变化之一[4]。T淋巴细胞内 Ca2+浓度的上升主要通过CRAC通道来实现[5],此外还可能通过P2X嘌呤受体[6]、电压门控的钙离子通道[7]来介导 Ca2+内流作用。但目前对硫酸酯化多糖与Ca2+的关系研究较少,对其作用机制尚不了解,其如何作用于T细胞表面,进而影响胞内钙离子浓度仍需进一步研究。本实验分别选用几种钙离子信号通路的抑制剂来研究松花粉酯化多糖组分SPPM60-D对小鼠脾脏T淋巴细胞[Ca2+]i调控的可能信号通路,为马尾松花粉多糖的实际应用提供科学依据。
1 材料与仪器
1.1 材料与试剂 破壁马尾松(Pinus massoniana)花粉(破壁率高于95%)由烟台新时代健康产业集团提供。水煮醇沉法提取马尾松花粉粗多糖。三氯乙酸法除蛋白,不同浓度的乙醇分级沉淀,得60%乙醇组分PPM60,Sephacryl S-400HR分离纯化得组分D,经氯磺酸-吡啶法硫酸酯化得SPPM60-D,红外光谱证实酯化成功。硫酸钡比浊法测定SPPM60-D中硫含量,代入公式后算出取代度为1.202。尼龙毛柱法分离小鼠脾脏T淋巴细胞。
胎牛血清(TBD,天津);RPMI 1640(Gibco,美国);2-APB、MTT、U73122、LY294002(Sigma,美国),Fura-2/AM、F127(Dojin,日本);维拉帕米(verapamil,Ver)注射液(上海禾丰制药有限公司);TAK-242(Invitrogen,美国);小鼠 IL-2、IL-4检测试剂盒(四正柏生物技术有限公司,北京);Anti-Mouse-CD3 FITC(eBioscience,美国);尼龙毛(Kisker,德国)。
1.2 仪器 二氧化碳培养箱(NUAIRE,美国),高压蒸汽灭菌锅(新华医疗器械厂),COIC型倒置显微镜(重庆光学仪器厂),荧光分光光度计(Cary E-clipse,美国),5804R离心机(Eppendorf,德国),Stat-Fax-2100型酶联免疫检测仪(Awareness,美国)。
2 方法
2.1 多糖及其酯化多糖对T淋巴细胞增殖的影响常规方法制备小鼠脾脏细胞后,尼龙毛柱法分离纯化小鼠T细胞,台盼蓝染色测定活细胞比率>93%,细胞液中加入FITC荧光标记的抗小鼠CD3单克隆抗体,用流式细胞仪检测,T细胞纯度达74.6%。用RPMI 1640培养液调整T细胞浓度为2×109个·L-1,分别设置空白对照组、阳性对照组及200 mg·L-1的PPM60-D和SPPM60-D实验组,MTT法测定T细胞增殖作用。
2.2 T细胞内钙离子浓度的测定[8]制备2×109个·L-1小鼠脾脏T细胞悬液,在CO2培养箱中预温5 min后加入终浓度为1 pmol·L-1的 Fura-2/AM,在 37℃恒温避光孵育45 min,1 000 r·min-1离心5 min后,倒掉上清液,用RPMI 1640完全培养液冲洗2~3次,实验组分别加入终浓度为10 mg·L-1的 ConA和 200 mg·L-1的 PPM60-D、SPPM60-D。测定条件:激发狭缝与发射狭缝宽度均设为10 nm,发射波长设为500 nm,用340/380 nm双波长交替来测定荧光比值。作用5 min后荧光强度比值为R值,随后加入终浓度为0.1%的Triton X-100破坏细胞膜,此时测定的为最大荧光比值Rmax,5 min时加入EGTA使其终浓度为10 mmol·L-1,测定最小荧光比值Rmin。[Ca2+]i计算公式如下:
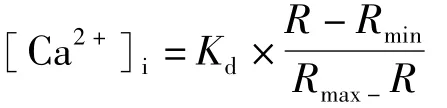
生理条件下,Kd=224 nmol·L-1,[Ca2+]i的单位为 nmol·L-1。
2.3 PPM60-D及SPPM60-D与抑制剂对T细胞内[Ca2+]i的影响 T细胞处理同“2.2”,实验组分别加入200 mg·L-1的 PPM60-D或 SPPM60-D。抑制剂组分别加入终浓度为1 mg·L-1的TAK-242,终浓度为 20μmol·L-1的 2-APB、LY294002,终浓度为10μmol·L-1的 U73122,终浓度为 10 mg·L-1的维拉帕米(Ver)孵育后,再加入 PPM60-D或SPPM60-D。钙离子浓度测定同“2.2”。
2.4 PPM60-D及SPPM60-D对T细胞细胞因子产生的影响 取分离的脾脏T淋巴细胞悬液,调细胞密度2×109个·L-1,设置空白对照组,ConA(终浓度 10 mg·L-1)组,PPM60-D及 SPPM60-D(200 mg·L-1)组,TAK-242及 2-APB抑制剂组,置于CO2培养箱中培养48 h后,1 200 r·min-1离心10 min,取上清放入EP管中,-20℃保存备用。参照试剂盒的相关操作步骤检测上清中的细胞因子。
2.5 统计学处理 实验数据采用SPSS 17.0统计学软件进行统计分析,结果以¯x±s表示,组间比较采用F检验。
3 结果
3.1 对T细胞增殖的影响 如Fig 1所示,用SPPM60-D培养T淋巴细胞48 h后,对T细胞增殖能力明显高于PPM60-D的作用(P<0.01)。

Fig 1 Influences of PPM60-D and SPPM60-D on the proliferation of T lymphocytes(48h)(n=3)
3.2 PPM60-D、SPPM60-D对 T细胞内[Ca2+]i的影响 与对照组相比,LPS和SPPM60-D分别使T细胞内[Ca2+]i升高 211.5%、201.8%(Fig 2),而PPM60-D则无明显作用。

Fig 2 Influences of ConA,PPM60-D and SPPM60-D on[Ca2+]i level in T lymphocytes(n=3)
3.3 T细胞钙离子通路抑制剂对其胞内[Ca2+]i的影响 结果显示,TLR-4抑制剂TAK-242对T细胞内[Ca2+]i并无明显抑制作用,结果见Fig 3。说明SPPM60-D不是通过TLR-4发挥作用的。
PI3K的抑制剂LY294002使SPPM60-D促进[Ca2+]i升高率降为96.1%,抑制率为35%。说明除了PI3K之外还有其他信号分子介导SPPM60-D引起的T细胞内[Ca2+]i的升高。
另外L-型钙离子通道的抑制剂Ver、PLC的抑制剂U73122和CRAC通道的抑制剂2-APB都能降低SPPM60-D引起的 T细胞内[Ca2+]i的升高,升高率与SPPM60-D相比分别降为104.2%、55.1%、48.6%(Fig 3),抑制率分别为 32.3%、48.6%、50.77%。说明SPPM60-D引起的T细胞内钙离子浓度的升高主要是通过CRAC通道介导的,L-型钙离子通道也起一定作用,但不是主要通道。
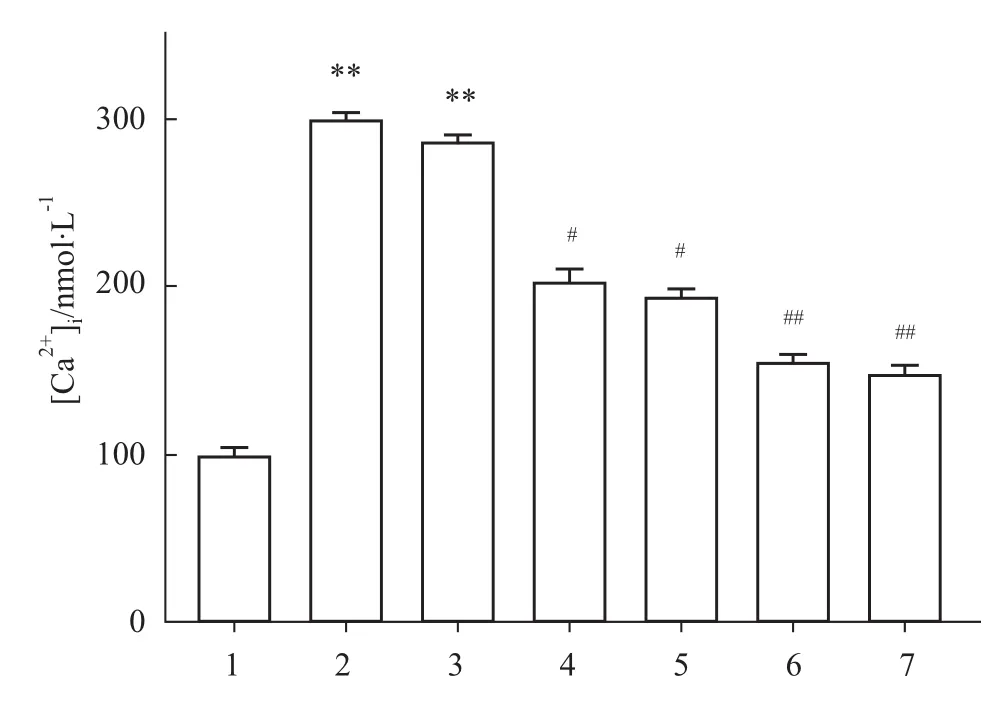
Fig 3 Influences of SPPM60-D on[Ca2+]i level in T lymphocytes with TAK242/Verapamil/LY294002/U73122/2-APB(n=3)
3.4 PPM60-D及SPPM60-D对T细胞细胞因子产生的影响 SPPM60-D作用后与对照组相比可使IL-2和IL-4分泌量分别升高6.94倍和5.95倍,且上清中IL-4的浓度要高于IL-2的浓度,而PPM60-D的作用效果不明显。而加入TLR4的抑制剂TAK-242后,IL-2和IL-4的分泌水平与非抑制剂组相比并无明显降低,加入CRAC的抑制剂2-APB后,IL-2和IL-4的分泌水平与无2-APB组相比明显下降(Fig 4、Fig 5),SPPM60-D诱导的细胞因子分泌水平上升与TLR4信号通路关系不大,而受细胞内钙离子信号通路影响较大。
4 讨论

Fig 4 Influences of PPM60-D and SPPM60-D with/without inhibitors TAK242,2-APB on cytokine IL-2 in T lymphocytes supernatant(n=3)

Fig 5 The influence of PPM60-D and SPPM-D with/without inhibitors TAK242,2-APB on cytokine IL-4 in T lymphocytes supernatant(n=3)
本实验室前期关于PPM60和SPPM60两种多糖对多种细胞内钙离子浓度的作用做过大量研究。夏瑜等[9]研究发现SPPM60对离体蟾蜍心脏有正性肌力作用,而维拉帕米可以抑制上述作用,猜测SPPM60的正性肌力作用可能是通过作用于心肌细胞上的L-型钙离子通道从而增加钙离子内流实现的。刘媛等[10]研究发现PPM60明显抑制心肌细胞内钙离子浓度的升高,而SPPM60对胞内钙离子却有促进作用,用Ver处理,SPPM60的正向作用被抑制。说明PPM60和SPPM60对兴奋性细胞的活性影响存在很大区别,硫酸化修饰可以明显增强多糖的生物学活性。刘媛等[11]发现SPPM60能明显提高小鼠脾细胞胞内钙离子浓度,提高率达188.4%,而PPM60作用并不明显,Ver可部分抑制酯化多糖促钙离子浓度升高的作用。在细胞外液无钙离子时,IP3R抑制剂低分子肝素(LMWH)可以拮抗SPPM60促进内钙的释放;毛华等[8]研究发现SPPM60-A能明显提高脾细胞内钙离子浓度,而Ver和LMWH均可使SPPM60-A促[Ca2+]i升高率有所降低,除此之外用TLR4、PI3K、PLC的抑制剂分别处理脾细胞,结果对SPPM60-A促[Ca2+]i升高率都有不同程度的降低,推测钙离子信号通路为SPPM60A-TLR4-PI3K-PLC-IP3R-Ca2+。因此我们推测在兴奋性细胞中,[Ca2+]i的上升可能主要是通过L-型钙离子通道介导的胞内钙离子浓度的上升,而在非兴奋性细胞中,介导[Ca2+]i升高的通路相对更复杂,除了可能通过L-型钙离子通道外,还可能通过内钙释放引起外钙内流的方式升高胞内钙离子浓度。前期工作研究对象是脾脏混悬细胞,本实验结果显示,Con-A与SPPM60-D都能明显升高纯化T细胞内[Ca2+]i。
Song等[12]研究发现,脂多糖LPS可以通过与膀胱上皮细胞表面Toll样受体4(TLR4)结合,激活胞内信号通路,促进IL-6的表达。Caramalho等[13]研究表明,TLR4、TLR5、TLR7和 TLR8可以在C57BL/6小鼠CD+4CD+25细胞(Treg)表达,有研究发现调节性T细胞只占整个CD+4T细胞的5%-6%[14]。关于小鼠Th1和Th2细胞TLR-4和TLR-2表达情况未见报道。Miao等[15]研究硫酸多糖聚甘古酯(SPMG)对胸腺T淋巴细胞影响时,证明SPMG是通过与T细胞表面的TCR/CD3复合物结合而发挥作用的。
本实验选用TLR-4抑制剂TAK-242处理T细胞时,对SPPM60-D增加T细胞内钙离子浓度没有明显作用。进一步证明SPPM60-D与脾脏T细胞的结合不是依赖TLR-4的作用,猜测主要依靠与T细胞表面TCR/CD3复合物的结合而激活细胞内信号通路。
目前对钙离子内流通路研究发现主要有以下几种:钙离子释放激活钙离子通道(Ca2+release-activated Ca2+channels,CRAC)、P2X嘌呤受体通道、瞬时受体电位通道、电压门控钙离子通道[16]。CRAC通道阻滞剂2-APB可以部分抑制SPPM60-D引起的T细胞内钙离子浓度的升高。但没有降到空白水平,说明还有其他通路介导钙离子内流。
特异性免疫中大多数细胞因子是由活化的 T淋巴细胞产生的,而细胞因子具有调节天然免疫和适应性免疫,促进造血以及刺激细胞活化、增殖或分化等功能[17]。实验结果表明,SPPM60-D可以明显促进IL-2、IL-4的产生,并且这种促进作用与SPPM60-D促进T细胞外Ca2+大量内流有很大关系,Ca2+通路可能激活了T细胞相关基因的表达,从而提高了IL-2、IL-4的分泌水平。而这种细胞因子的高水平或许能进一步激发和促进NK细胞、B淋巴细胞等其他免疫细胞的功能,从而进一步提高整体的免疫功能。
总之,本实验证实了硫酸酯化后的SPPM60-D对T淋巴细胞有明显的激活作用,促进增殖、升高[Ca2+]i以及促进细胞因子的产生。推测SPPM60-D可能是通过T细胞表面TCR/CD3受体作用,诱导PI3K的激活,PI3K的活化又激活PLC,使PIP2产生IP3与DAG两个信号分子,IP3作用于胞内内质网钙库上的IP3R,引起钙库钙离子的释放到胞质,少量的Ca2+通过SOC诱导大量Ca2+的跨膜内流,从而导致T淋巴细胞[Ca2+]i的上升,如Fig 6。

Fig 6 Speculated calcium signal pathway induced by SPPM60-D
与未酯化的PPM60-D相比,SPPM60-D具有明显的促进T淋巴细胞增殖及增强活性的作用。这种变化是由多糖一级结构还是空间结构的变化所引起,T淋巴细胞如何识别、接受硫酸酯化多糖,还需进一步更深入的研究。
参考文献:
[1] 王 敏.松花粉的成分及药理作用研究进展[J].安徽医药,2008,12(4):357-9.
[1] Wang M.The research of component and pharmacological action of pine pollen[J].Anhui Med Pharm J,2008,12(4):357-9.
[2] 耿 越,刘 辉,石丽花,等.马尾松花粉多糖硫酸酯化前后生物活性的比较研究[J].中国生化药物杂志,2010,31(2):98-102.
[2] Geng Y,Liu H,Shi L H,et al.Comparative study on bio-activity of polysaccharide from Pinus massoniana pollen and its sulfated derivative[J].Chin J Biochem Pharm,2010,31(2):98-102.
[3] 邹明畅,崔飞伦,倪鸿昌,等.多糖硫酸酯抗肿瘤作用的研究进展[J].现代中药研究与实践,2008,22(3):56-9.
[3] Zou M C,Cui F L,Ni H C,et al.The research of anti-tumor effect of sulfated polysaccharides[J].Res Pract Chin Med,2008,22(3):56-9.
[4] Potter A J,Grossmann A,Rabinovitch P S,et al.The effect of in vitro phorone exposure on glutathione content and T cell antigen receptor(CD3)-stimulated calcium mobilization in murine splenic T lymphocytes[J].Toxicol In Vitro,1997,11(4):355-63.
[5] Zweifach A,Lewis R S.Mitogen-regulated[Ca2+]current of T lymphocytes is activated by depletion of intracellular[Ca2+]stores[J].Proceed Nat Acad Sci,1993,90(13):6295-9.
[6] Yip L,Woehrle T,Corriden R,et al.Autocrine regulation of T-cell activation by ATP release and P2X7 receptors[J].FASEB J,2009,23(6):1685-93.
[7] Badou A,Jha M K,Matza D,et al.Critical role for theβregulatory subunits of Cav channels in T lymphocyte function[J].Proc Natl Acad Sci,2006,103(42):15529-34.
[8] 毛 华,楚慧丽,刘月冉,等.马尾松花粉硫酸酯化多糖调控脾细胞[Ca2+]i的研究[J].中国药理学通报,2012,28(10):1460-4.
[8] Mao H,Chu H L,Liu Y R,et al.Influences of sulfated polysaccharide from pine(Pinus massoniana)pollen on the regulation of[Ca2+]iin splenocytes[J].Chin Pharmacol Bull,2012,28(10):1460-4.
[9] 夏 瑜,石丽花,刘 媛,等.马尾松花粉多糖及其酯化物对离体蟾蜍心肌生理特性的影响[J].天然产物研究与开发,2009,21(2):231-4.
[9] Xia Y,Shi L H,Liu Y,et al.Effects of pine pollen polysaccharide and its sulfate on the physiological characteristics of isolated toad cardiac muscle[J].Nat Prod Res Dev,2009,21(2):231-4.
[10]刘 媛.马尾松花粉多糖硫酸酯结构解析及对心肌细胞钙离子通道的调控作用[D].山东师范大学,2009.
[10] Liu Y.Structure analysis of a polysaccharide sulfate from pinus massoniana pollen and its modulation on[Ca2+]channel in myocardial cells[D].Shandong Normal University,2009.
[11]刘 媛,赵 红,蔡 云,等.马尾松花粉多糖硫酸酯化前后对小鼠脾细胞钙离子浓度的影响[J].药物生物技术,2011,18(5):396-8.
[11]Liu Y,Zhao H,Cai Y,et al.Effects of polysaccharide from masson pine pollen and its sulfated derivative on the cytosolic[Ca2+]iin mice splenocytes[J].Pharm Biotechnol,2011,18(5):396-8.
[12]Song J,Duncan M J,Li G,et al.A novel TLR4-mediated signaling pathway leading to IL-6 responses in human bladder epithelial cells[J].PLoSPathog,2007,3(4):e60.
[13] Caramalho I,Lopes-Carvalho T,Ostler D,et al.Regulatory T cells selectively express toll-like receptors and are activated by lipo-polysaccharide[J].J Exp Med,2003,197(4):403-11.
[14]Sakaguchi S,Sakaguchi N,Shimizu J,et al.Immunologic tolerance maintained by CD2+5CD4+regulatory T cells:their common role in controlling autoimmunity,tumor immunity,and transplantation tolerance[J].Immunol Rev,2002,182(1):18-32.
[15]Miao B,Li J,Fu X,et al.T-cell receptor(TCR)/CD3 is involved in sulfated poly-mannuroguluronate(SPMG)-induced T lymphocyte activation[J].Int Immunopharmacol,2005,5(7):1171-82.
[16]Lewis R S.Calcium signaling mechanisms in T lymphocytes[J].Annu Rev Immunol,2001,19(1):497-521.
[17]金伯泉,赵修竹,王成济.细胞和分子免疫学[M].科学出版社,2001:131-203.
[17]Jin B Q,Zhao X Z,Wang CJ.Cellular and Molecular Immunology[M].Science Press,2001:131-203.
