匹多莫德对动脉粥样硬化NF-κB/IκB和TNF-α及IL-6表达的影响
2014-05-13宋德海王振波郑波董圣军程玲
宋德海,王振波,郑波,董圣军,程玲
(滨州医学院附属医院药学部,滨州 256603)
匹多莫德对动脉粥样硬化NF-κB/IκB和TNF-α及IL-6表达的影响
宋德海,王振波,郑波,董圣军,程玲
(滨州医学院附属医院药学部,滨州 256603)
目的 探讨匹多莫德对动脉粥样硬化患者外周血核因子-κB(NF-κB/IκB)和炎性因子肿瘤坏死因子-α (TNF-α)及白细胞介素(IL)-6 mRNA和蛋白表达的影响。方法选取颈动脉粥样硬化患者62例,采用随机数字表法分为两组,各31例;对照组常规治疗,治疗组在对照组的基础上加用匹多莫德口服液。分别于治疗前后超声检测患者颈动脉厚度;并抽取患者空腹肘静脉血,以RT-PCR和Western blot实验测定全血NF-κB/IκB、TNF-α及IL-6的mRNA与蛋白表达水平。结果治疗前,两组患者的颈动脉厚度差异无统计学意义(P>0.05);治疗后,治疗组显著小于对照组(P<0.05)。治疗前,治疗组患者的外周血NF-κB、IκB、TNF-α及IL-6的mRNA与蛋白表达水平差异无统计学意义(P>0.05);治疗后,两组患者的外周血NF-κB、TNF-α及IL-6 mRNA与蛋白表达水平均有所降低,且治疗组显著低于对照组(P<0.05);IκB表达水平有所上升,且治疗组显著高于对照组(P<0.05)。结论匹多莫德能够调节NF-κB/IκB信号通路,缓解动脉粥样硬化患者炎性反应,利于改善病情。
匹多莫德;动脉粥样硬化;核因子-κB;肿瘤坏死因子-α;白细胞介素-6
动脉粥样硬化(atherosclerosis,AS)是冠心病、脑缺血及周围动脉梗阻等多种血管性疾病的重要病理基础[1]。脉管壁内膜脂质沉着,中层平滑肌细胞向内膜增殖,形成脂质斑块为其最典型病理特征。AS是一个复杂的病理进程,除脂质浸润之外,发病过程中尚存在广泛的氧化应激及炎性反应,且炎性反应贯穿其疾病发生与发展的全过程,因此也被认为是一种免疫应激性炎性反应[2]。核转录因子体系核因子-κB(nuclear factor kappa B,NF-κB/IκB)是调节基因转录的关键因子之一,也是启动级联反应,刺激炎性因子肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素(interleukin,IL)等分泌和表达的轴心[3-4]。匹多莫德是一种合成的具有免疫活性的二肽类物质,其免疫调节功能表现在多个方面。匹多莫德对机体的固有免疫细胞和T、B淋巴细胞活性均有一定的增强作用,不仅可改善各种免疫细胞的比例,而且能够介导相关细胞因子分泌,从而缓解免疫炎性反应。2012年12月至2013年12月,笔者观察匹多莫德对AS患者外周血NF-κB、TNF-α及IL-6表达的影响,也为其临床治疗新靶点的选择提供依据。
1 资料与方法
1.1 研究对象 选择本院收治的颈动脉粥样硬化患者62例为研究对象,本研究经滨州医学院附属医院医学伦理委员会批准,所有患者均由本人签署知情同意书。其中男34例,女28例;年龄46~76岁,平均(64.3±7.82)岁;病程3个月~11年,平均(4.72±1.37)年。诊断标准:以第4版《超声医学》AS标准为依据,经彩色多普勒进行诊断[5]。排除标准:急性脑梗死、严重心肌梗死、严重心律失常、糖尿病、肿瘤或癌症、血液系统疾病、其他免疫系统疾病;近2个月内应用过调脂、抗凝、免疫药物患者。采用随机数字表法将患者分为治疗组和对照组,每组31例,且两组患者之间年龄、性别、病程及病情差异无统计学意义(P>0.05)。
1.2 仪器 蛋白印迹转移装置(SDS-PAGE TY0736,美国伯乐);核酸蛋白测定仪(Biophotometerplus,德国艾本德);梯度PCR扩增仪(TP600,上海西宝生物科技有限公司);凝胶成像分析仪(FR-980,上海复日);电泳仪(DYY-III2,北京六一仪器厂)等。
1.3 试剂 总RNA提取试剂盒(15596-026, Invitrogen公司);总蛋白抽提试剂盒(k3011010,北京博尔诚科技有限公司);BCA蛋白浓度测定试剂盒(P0010S,上海碧云天生物技术有限公司);抗体Anti-NF-κB P100/P50(ab7971)、Anti-IκB(ab32518)、Anti-TNF-α(ab7939)、Anti-IL-6(ab6672)及Goat Anti-Rabbit IgG(ab175315)等由Abcam提供;引物(表1)及其他常规RT-PCR试剂由上海宝生物公司提供。
1.4 治疗方法 对照组给予常规治疗,包括辛伐他汀片(商品名:京必舒新,浙江京新药业有限公司生产,批准文号:国药准字H20000009),每次20 mg,qd;阿司匹林肠溶片(商品名:拜阿司匹林,拜耳医药保健有限公司生产,批准文号:国药准字H20080331),首剂量每次300 mg,qd,维持剂量每次100 mg,qd。治疗组在对照组的基础上加用匹多莫德口服液(商品名:芙露饮,苏州长征-欣凯制药有限公司生产,批准文号:国药准字H20030464),每次0.4 g,qd,早餐前口服。4周为1疗程,连续治疗两个疗程后进行药效评价,治疗期间禁用其他降脂和抗血小板药物。

表1 NF-κB、IκB、TNF-α及IL-6的引物序列
1.5 观察指标
1.5.1 颈动脉内膜厚度 分别于治疗前后采用彩色多普勒超声仪观察颈动脉内膜厚度。
1.5.2 mRNA表达检测 分别于治疗前后抽取患者空腹肘静脉血,以总RNA提取试剂盒提取全血总RNA,进行常规逆转录和扩增实验。扩增条件:95℃, 5 min;95℃,30 s;57℃,1 min;72℃,1 min;30个循环;72℃,10 min。扩增所得产物以5∶1与6×buffer混匀,进行1.2%琼脂糖凝胶电泳,120 V 40 min。凝胶成像分析仪测定吸光度值,以目的基因/β-action为mRNA相对表达量,进行半定量分析。
1.5.3 蛋白表达检测 分别于治疗前后抽取患者空腹肘静脉血,肝素钠抗凝,以总蛋白提取试剂盒提取蛋白质。每血液100 μL加入蛋白提取液(含0.4%的蛋白酶抑制剂)500 μL,震荡混匀,4℃,10 000 r·min-1离心5 min,弃上清液。磷酸盐缓冲溶液(phosphate buffered solution,PBS)洗涤2或3次,重新加入500 μL蛋白提取液(含0.4%的蛋白酶抑制剂),震荡混匀, 4℃,14 000 r·min-1离心15 min,弃上清液,得总蛋白。以BCA蛋白浓度测定试剂盒测定蛋白浓度,并以10 μg为单孔上样量进行SDS-聚丙烯酰胺凝胶电泳, 80 V/30 min,120 V/60 min。电泳后常规转膜100 V/ 60 min,并以4.0%脱脂牛奶将转染后的硝酸纤维素(nitrocellulose filter membrane,NC)膜封闭90 min。一抗孵育,4℃过夜,Anti-NF-κB P100/P50、Anti-IκB、Anti-TNF-α及Anti-IL-6的浓度分别为1∶3 000, 1∶1 000,1∶2 000,1∶1 500。二抗孵育,28℃, 90 min,Goat Anti-Rabbit IgG的浓度均为1∶2 000。孵育后采用化学发光法显影,并以灰度分析软件Image J分析相对表达量。
1.6 统计学方法 所得数据均以统计学软件SPSS16.0版进行分析;颈动脉厚度和表达量以均数±标准差(±s)表示,行t检验;P<0.05表示差异有统计学意义。
2 结果
2.1 颈动脉内膜厚度 治疗前,两组患者的颈动脉内膜厚度差异无统计学意义(P>0.05);治疗后,治疗组显著小于对照组(P<0.05)。见图1,2。
2.2 mRNA表达 治疗前,治疗组患者的外周血NF-κB、IκB、TNF-α及IL-6的mRNA表达水平差异无统计学意义(P>0.05)。治疗后,NF-κB、TNF-α及IL-6表达水平均有所降低,且治疗组显著低于对照组(P<0.05);IκB表达水平有所上升,且治疗组显著高于对照组(P<0.05)。见图3。
2.3 蛋白表达 治疗前,治疗组外周血NF-κB、IκB、TNF-α及IL-6的蛋白表达水平差异无统计学意义(P>0.05);治疗后,NF-κB、TNF-α及IL-6表达水平均有所降低,且治疗组显著低于对照组,差异有统计学意义(P<0.05);IκB表达水平有所上升,且治疗组显著高于对照组(P<0.05)。见图4。

图1 两组患者治疗前、后颈动脉彩色多普勒超声图

图2 两组患者治疗前后颈动脉厚度比较
3 讨论
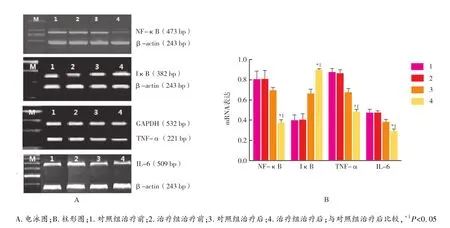
图3 两组患者外周血NF-κB、IκB、TNF-α及IL-6的mRNA表达比较

图4 两组患者外周血NF-κB、IκB、TNF-α及IL-6的蛋白表达比较
近年来,炎性反应在AS发病过程中的作用越来越受重视。众多研究显示,细胞黏附分子的表达受炎性因子的调节,炎症反应所致免疫细胞黏附是促进脂质浸润和斑块形成的主要因素[6-7]。细胞因子通过受体将信号经胞质传导至核内,并使相应的基因转录而发挥其生物学效应。这一途径是由受体-信号转导子与转录活化子-靶基因的激活来实现的。NF-κB启动靶基因转录的重要核转录因子,在机体多种生物学活性物质合成的转录调控中具有重要作用。同理,无论是炎性反应还是细胞黏附均以NF-κB为枢纽。正常人体的外周血中,NF-κB呈低表达状态,而动脉粥样硬化、心肌缺血和心力衰竭等心血管疾病患者,外周血NF-κB可大量增加[8]。近年研究证实,NF-κB可由多种刺激激活,包括炎性因子、淋巴细胞及黏附分子等,几乎参与了炎症、免疫、氧化应激反应的全过程,在AS的发病进程中至关重要[9-11]。
目前,AS与NF-κB/IκB的相关研究多局限于动物实验。本研究以临床患者为对象,重点探讨与NF-κB/ IκB及相关炎性因子TNF-α、IL-6在AS发病过程中发生的变化及免疫干预治疗的可行性。从结果来看,治疗组患者的颈动脉内膜厚度恢复更好,说明其在抗脂质浸润和斑块形成方面更占优势。此外,治疗组患者的NF-κB、TNF-α及IL-6表达水平均较对照组显著降低,IκB表达水平则较对照组显著上升。AS斑块中可检测到TNF-α、IL-6及激活的NF-κB已被众多学者所证实[12-13]。NF-κB由促炎因子TNF-α及IL-6诱导产生,并能诱导包括TNF-α及IL-6在内的多种促炎因子的表达,进一步强化此激动信号。此外,NF-κB活化后,还能启动细胞间黏附分子1(intercellular adhesion molecule 1,ICAM-1)的转录,促进受损细胞的黏附作用,加强炎性反应,进而形成级联式恶性循环[14]。实验动物学研究也证实下调NF-κB信号通路的蛋白表达,能够明显降低炎性因子TNF-α和黏附分子ICAM-1的血清含量[15]。IκB又称NF-κB抑制蛋白,在细胞静息状态下,与NF-κB结合,掩盖了其核移位信号序列,以抑制其活性。NF-κB必须与IκB解离,暴露P50蛋白的核定位符号,才能够进入细胞核发挥转录活性。因此,本研究以NF-κB/P50及IκB表达水平为主要观察指标,可以反映其活性-抑制状态。该结果说明匹多莫德在调节NF-κB/IκB信号通路,抑制炎性反应方面更占优势,可能是其发挥抗AS的重要机制。
综上所述,由NF-κB/IκB信号通路介导的免疫炎性反应在AS的发病机制中介导了重要环节,匹多莫德能够通过该信号通路,降低动脉粥样硬化患者促炎因子的表达,利于改善病情。
[1] 王浩然,于春江.动脉粥样硬化发生机制及治疗药物的研究进展[J].首都医科大学学报,2010,31(6):828-833.
[2] 褚现明,李冰,安毅,等.炎症与动脉粥样硬化关系研究进展[J].中国分子心脏病学杂志,2010,11(3):184-188.
[3] 白玉,王中群,姚文健,等.核因子-κB与细胞间黏附分子-1在人冠状动脉粥样硬化斑块中的表达及与病变进展的关系[J].中国老年学杂志,2010,30(17):2420-2422.
[4] 赵凯,钱月慧,程晓东.动脉粥样硬化闭塞症兔动脉TNF-α mRNA、NF-κB mRNA表达的变化[J].辽宁中医杂志,2012,5(11):2302-2305.
[5] 周永昌.超声医学[M].4版.北京:科学技术文献出版社,2003:799-804.
[6] ELLISON S,GABUNIA K,AUTIERI M,et al.Attenuation of experimentalatherosclerosisbyinterleukin-19[J]. Arterioscler Thromb Vasc Biol,2013,33(10):2316-2324.
[7] LICHTMAN A,BINDER C,TSIMIKAS S,et al.Adaptive immunity in atherogenesis:new insights and therapeutic approaches[J].J Clin Inv,2013,123(1):27-36.
[8] 王丹阳,朱广瑾,徐成丽.NF-κB在某些心血管疾病中的作用[J].基础医学与临床,2011,31(9):1070-1073.
[9] KIM S,KIM C,KIM Y,et al.Aqueous extract of unripe Rubuscoreanusfruitattenuatesatherosclerosisby improvingbloodlipidprofileandinhibitingNF-κB activation via phase II gene expression[J].J Ethnopharm, 2013,146(2):515-524.
[10] HU Z,FANG X,WANG Y,et al.Melatonin ameliorates vascularendothelialdysfunction,inflammation,and atherosclerosis by suppressing the TLR4/NF-κB system in high-fat-fed rabbits[J].J Pineal Res,2013,55(4):388-398.
[11] WANG L,QIU X,HAO Q,et al.Anti-inflammatory effects of a Chinese herbal medicine in atherosclerosis via estrogen receptor β mediating nitric oxide production and NF-κB suppression in endothelial cells[J].Cell Death Dis,2013,4 (51):51-56.
[12] CHANET A,MILENKOVIC D,MORAND C,et al.Flavanone metabolites decrease monocyte adhesion to TNF-αactivated endothelial cells by modulating expression of atherosclerosis-related genes[J].British J Nutr,2013,110 (4):587-598.
[13] 朱焕亮,季伟峰,程雅洁.血清CRP、TNF-α、IL-6的水平与颈动脉粥样硬化症的关系[J].放射免疫学杂志, 2011,24(1):110-111.
[14] SUN X,FEINBERG M.NF-κB and hypoxia:a double-edged sword in atherosclerosis[J].Am J Pathol,2012,181(5): 1513-1517.
[15] SONG D,FANG G,LIU S,et al.Chronic intermittent hypoxiainducesatherosclerosisbyNF-κB-dependent mechanisms[J].Biochimica Et Biophysica Acta,2012,1822 (11):1650-1659.
DOI 10.3870/yydb.2014.08.011
R979.50;R972.6
A
1004-0781(2014)08-1025-04
2014-02-28
2014-04-10
宋德海(1964-),男,山东荣成人,主管药师,学士,研究方向:临床药学。电话:0543-3256584,E-mail:sdh_bz @163.com。
