地塞米松对哮喘小鼠支气管肺泡灌洗液中IL-25和IFN-γ的影响*
2014-05-13陆韦王蕾谯明王玉江吉富吴中明
陆韦,王蕾,谯明,王玉,江吉富,吴中明
(1.遵义医学院附属医院儿科,遵义 563099;2.遵义医学院微免教研室,遵义 563003)
地塞米松对哮喘小鼠支气管肺泡灌洗液中IL-25和IFN-γ的影响*
陆韦1,王蕾1,谯明1,王玉2,江吉富2,吴中明2
(1.遵义医学院附属医院儿科,遵义 563099;2.遵义医学院微免教研室,遵义 563003)
目的 通过检测支气管肺泡灌洗液(BALF)中白细胞介素-25(IL-25)和γ-干扰素(IFN-γ)的水平,探讨地塞米松对小鼠支气管哮喘的治疗作用机制。方法清洁级Balb/c小鼠随机分为正常对照组、哮喘组和地塞米松组。以鸡卵清蛋白(OVA)致敏激发法建立哮喘小鼠模型。地塞米松组在每次激发前1 h予地塞米松腹腔注射。每次激发时观察小鼠的表现。于末次激发24 h处死小鼠,取右肺作苏木精-伊红(HE)染色病理切片,显微镜下观察炎症情况;收集左肺BALF,镜下计数白细胞总数、嗜酸性粒细胞(EOS)绝对数目,计算EOS百分比;用酶联免疫吸附法(ELISA)测定BALF中IL-25和IFN-γ的水平,并做相关性分析。结果哮喘组小鼠BALF中白细胞总数、EOS数目和百分比分别与正常对照组、地塞米松组比较均明显增加(P<0.05),而以上3个指标在正常对照组和地塞米松组间差异无统计学意义。哮喘组小鼠BALF中IL-25水平高于正常对照组和地塞米松组(P<0.05),而地塞米松组的含量也高于正常对照组;IFN-γ水平低于正常对照组和地塞米松组(P<0.05),而后两组差异无统计学意义。各组小鼠BALF中IL-25和IFN-γ水平都呈负相关。结论地塞米松治疗哮喘病的部分机制是减轻肺部炎症和促进IFN-γ的产生,同时可能抑制IL-25的表达。
地塞米松;哮喘;白细胞介素-25;γ-干扰素
哮喘的发病机制尚未完全清楚,一般认为与免疫、神经、精神、内分泌和遗传学背景等因素密切相关。在免疫发病的机制中最重要的环节是Th1/Th2细胞的失衡[1-2]。γ-干扰素(interferon-γ,IFN-γ)是重要的Th1型细胞因子,而关于Th2型细胞因子的研究大多集中于白细胞介素(interleukin,IL)-4、IL-5、IL-10和IL-13等,但一些非经典的细胞因子也同样发挥一定的作用,IL-25就是其中的一种。有研究表明,IL-25具有促进Th2型免疫反应的作用[3-7]。目前还没有根治哮喘病的方法,糖皮质激素仍是首选药物,但尚不清楚其对IL-25具有何种作用。因此,笔者在本实验中拟建立哮喘小鼠模型,设立地塞米松组,检测地塞米松对哮喘小鼠支气管肺泡灌洗液(bronchoalveolar lavage fluid,BALF)中IL-25和IFN-γ水平的影响,进一步探讨地塞米松对哮喘的治疗机制。
1 材料与方法
1.1 动物 6~8周龄清洁级Balb/c雄性小鼠36只,体质量(18±2)g,购于中国科学院上海斯莱克实验动物中心,合格证号:SCXK(沪)2007-0005。
1.2 试剂 鸡卵清清蛋白(ovalbumin,OVA)Ⅴ级,氢氧化铝凝胶(Sigma公司,批号:MKBC0623),布地奈德混悬液(澳大利亚Astra Zeneca公司,批号:305144),地塞米松注射液(四川科伦药业有限公司,批号:130601),0. 9%氯化钠溶液(四川科伦药业有限公司,批号: H11021313),小鼠IL-25、IFN-γ ELISA试剂盒(深圳欣博盛生物科技有限公司,批号:060728,101221)。
1.3 仪器 超声雾化器(德国百瑞,型号: PARIDOY),普通显微镜(日本NIKON&YS100),低温离心机(中国飞鸽,型号:TGL-16G),电热恒温培养箱(上海恒科技有限公司,型号:DHP-9162)。
1.4 建立哮喘模型及药物干预 用随机数字表法将36只Balb/c小鼠分为3组,即正常对照组、哮喘组和地塞米松组各12只。哮喘组在第0天、第10天腹腔注射致敏液0.1 mL(含OVA25 μg及氢氧化铝凝胶2 mg)。在第14天开始用1%OVA溶液行超声雾化,每次30 min,连续7 d,此即激发[8]。地塞米松组除按哮喘组操作外,在每次激发前1 h予地塞米松2 mg·kg-1腹腔注射[9]。正常对照组用0.9%氯化钠溶液致敏和雾化,方法同哮喘组。
1.5 标本制备 小鼠于末次激发后24 h腹腔注射10%水合氯醛(每只0.075 mL)后固定,暴露腹腔后腹主动脉,放血处死,打开胸腔,立即结扎右肺,并做以下两步操作。第一步,取右肺,按常规制作苏木精-伊红(hematoxylin-eosinstaining,HE)染色病理切片。第二步,充分暴露小鼠颈部气管,用22G留置针行气管插管,轻柔注入4℃、0.9%氯化钠溶液0.5 mL,反复回抽3次后收集该液体,此即为BALF,以上操作重复3次(回收率>80%)。收集的BALF放入-20℃保存。
1.6 观察和检测项目 ①小鼠的激发表现:在每次激发时观察小鼠呼吸、神智、鼻腔分泌物、行动等临床表现。②观察肺组织炎症改变:用普通显微镜观察各组小鼠肺组织病理切片的炎症情况。③记录细胞数:吸取BALF滴在计数板上,低倍镜下记录并计算白细胞计数(white blood cell,WBC)。单盲法高倍镜下数至少200个细胞作嗜酸性粒细胞(eosinophils,EOS)绝对计数和计算EOS在白细胞中的百分比。④酶联免疫吸附测定法(enzyme-linked imruno-sorbent assay, ELISA):将BALF 4℃离心10 min,取上清液,按说明书测定IL-25和IFN-γ的水平。
2 结果
2.1 小鼠的激发表现 哮喘组小鼠经OVA激发后,出现烦躁不安、鼻腔分泌物增多、挠鼻和呼吸急促等症状,严重者呼吸减慢或节律不规则,反应迟钝,四肢瘫软。地塞米松组的表现较哮喘组明显减轻,其中5只小鼠与正常对照组无区别。
2.2 小鼠肺部炎症改变 哮喘组小鼠支气管、细支气管和肺泡腔缩小,肺泡间隔增宽,管壁及肺间质有炎性细胞浸润,以嗜酸性粒细胞为主,支气管、细支气管及肺泡腔内可见渗出物,支气管和细支气管黏膜上皮部分坏死脱落,伴杯状细胞增生。地塞米松组炎症反应明显减轻。见图1。
2.3 记录细胞数 结果表明:BALF中白细胞总数、EOS数目和百分比在哮喘组比正常对照组明显增加,在正常对照组和地塞米松组进行两两比较均差异无统计学意义。见表1。

A.正常对照组;B.哮喘组;C.地塞米松组图1 3组小鼠肺组织的病理改变(HE,×400)A.normal control group;B.asthma group;C.dexamethasone groupFig.1 Pathological changes of lungs in three groups of mice(HE,×400)
表1 3组BALF中白细胞总数、EOS绝对计数和百分比Tab.1 Changes of total white cell count,absolute number of EOS and EOS%in BALF of three groups ±s

表1 3组BALF中白细胞总数、EOS绝对计数和百分比Tab.1 Changes of total white cell count,absolute number of EOS and EOS%in BALF of three groups ±s
与正常对照组比较,*1P<0.01;与哮喘组比较,*2P<0.01Compared with normal control group,*1P<0.01;compared with asthma group,*2P<0.01
组别小鼠/只WBC/ (×104个·mL-1) EOS (×104个·mL-1)%正常对照组124.98±2.120.55±0.301.85±1.06哮喘组1296.14±46.60*118.34±3.16*14.52±2.83*1地塞米松组127.28±4.30*23.30±2.14*21.81±1.23*2F 19.25631.3219.685 P 0.0000.0000.000
2.4 IL-25的水平测定 结果表明:哮喘组小鼠BALF中IL-25的水平较正常对照组增高,地塞米松组能使IL-25降低,但不能降至正常水平。见图2。
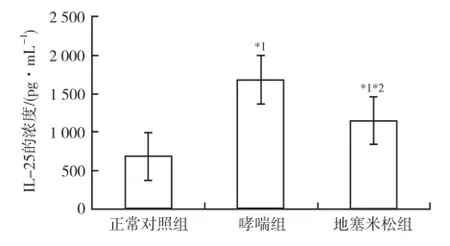
与正常对照组比较,*1P<0.05;与哮喘组比较,*2P<0.05图2 3组小鼠BALF中IL-25的浓度Compared with normal control group,*1P<0.05;compared with asthma group,*2P<0.05Fig.2 IL-25 concentration in BALF in three groups of mice
2.5 \IFN-γ水平的测定 结果表明:哮喘组小鼠BALF中IFN-γ的水平较正常对照组减低,地塞米松能使其增加至正常水平。见图3。
2.6 相关性分析 正常对照组、哮喘组和地塞米松组小鼠BALF中IL-25和IFN-γ的浓度均呈负相关关系,r分别为-0.948,-0.963,-0.580(P<0.01,n=12)。

与哮喘组比较,*1P<0.05图3 3组小鼠BALF中IFN-γ的浓度Compared with asthma group,*1P<0.05Fig.3 IFN-γ concentration in BALF in three groups of mice
3 讨论
IL-25主要来源于Th2细胞,也可由肥大细胞、巨噬细胞、嗜酸性粒细胞和嗜碱性粒细胞等产生。属于IL-17家族,受体是IL-17RB。它的靶细胞主要有两种,一种是记忆性Th2细胞,另一种是一类非T非B细胞的附属细胞群,如髓源性肥大细胞、肺泡巨噬细胞等[6-7,10-11]。既往研究显示,IL-25可以诱导哮喘病的炎症前和炎症反应,引起肺部嗜酸性粒细胞和Th2细胞增多,血清IgE、IgA和IgG1增加,IL-4、IL-5和IL-13增加,气道高反应性,肺上皮细胞增生肥大和黏液高分泌,以及气道重建[4-5,12-13]。本实验哮喘组小鼠BALF中IL-25水平增高,验证了IL-25参与到哮喘病炎症发病的过程之中。IL-25增高的可能机制是:致哮喘病的各种始动因素促使BALF中白细胞数目增加,分泌IL-25的细胞(如Th2细胞、嗜酸性粒细胞和嗜碱性粒细胞等)也相应增多,同时,IL-25基因的表达增强。
本实验中地塞米松可抑制IL-25的表达,说明地塞米松可通过抑制IL-25生成,使哮喘病缓解。可能的机制是:①地塞米松抑制IL-25基因转录和表达,使IL-25 mRNA产生减少;②抑制IL-25的合成和释放;③降低IL-25的稳定性;④下调IL-25的靶细胞和信号传导通路的功能。但是,地塞米松组小鼠BALF的IL-25并没有完全恢复至正常水平。其原因可能是:①IL-25的清除尚需要一段时间;②某些促炎因素使IL-25的稳定性增加,降解减少;③不能完全抑制IL-25基因的转录和表达。哮喘组小鼠BALF中IFN-γ水平低于正常对照组,这与许卓谦等[10]的结果相同。表明IFN-γ受到抑制,也验证了哮喘病时Th1型细胞因子的产生是受到抑制的。IFN-γ被抑制的机制可能是:Th2细胞分泌的IL-4和IL-10不但使IFN-γ蛋白分泌减少,而且还抑制IFN-γ基因的表达并降低其稳定性[14]。地塞米松可增加IFN-γ的产生,使其浓度恢复到正常水平,支持了糖皮质激素可以通过上调Th1型细胞因子的表达治疗哮喘病的理论。糖皮质激素促进IFN-γ产生的机制可能是:①促进IFN-γ基因的转录;②多途径地促进IFN-γ的表达和合成;③抑制Th2型细胞因子的产生,从而减轻该类细胞因子对IFN-γ的抑制作用;④增加IFN-γ的稳定性,减少其降解;⑤上调IFN-γ的靶细胞和信号传导通路的功能[15]。INF-γ在哮喘组和地塞米松组存在动态变化,提示其参与了哮喘病的发病。可能机制是:INF-γ抑制B细胞产生IgE;抑制IL-4 mRNA的转录水平;抑制气道炎症细胞的渗出和Th2型细胞因子的分泌[16-17]。本实验中各个组IFN-γ和IL-25均呈负相关关系,说明二者有相互抑制的关系,它们的作用方向相反,共同参与哮喘病的发展。
虽然糖皮质激素是目前治疗哮喘病的首选药物,但单纯依靠激素却很难治愈该病,因此,除了联合应用外源性的IFN-γ外[18],IL-25可能提供了一个治疗的途径。本实验中哮喘组小鼠使用地塞米松后IL-25的水平不能降至正常水平,说明激素可能不能完全抑制IL-25的产生,该细胞因子在哮喘病缓解期仍高于正常水平并继续发挥Th2型免疫反应作用,成为哮喘病只能缓解而不能根治的原因之一,因此推测IL-25可能参与到糖皮质激素耐药的机制中。多项研究表明,可溶性IL-25R和抗IL-25 mAb均可减轻小鼠肺组织的炎症反应。并且,IL-25 mAb在人体内也能阻止IL-25和IL-25R的结合[6,13,19]。因此,可考虑将IL-25作为一条辅助治疗哮喘病的途径。
[1] 李开艳,熊盛道,朱晶,等.沙美特罗/氟替卡松对支气管哮喘患者血清IL-21与总IgE水平的影响[J].医药导报,2011,30(8):1027-1029.
[2] 周敏,陈辉龙,程胜,等.孟鲁司特对哮喘小鼠肺组织黏蛋白Muc5ac表达的影响[J].医药导报,2013,32(1):5-8.
[3] 刘粉,吴金香,赵继萍,等.气道上皮IL-25促进哮喘气道重塑[J].细胞与分子免疫杂志,2012,28(6):633-636.
[4] PETERSEN B C,BUDELSKY A L,BAPTIST A P,et al. Interleukin-25 induces type 2 cytokine production in a steroid-resistant interleukin-17RB+myeloid population that exacerbates asthmatic pathology[J].Nat Med,2012,18 (5):751-758.
[5] OWYANG A M,ZAP H.Interleukin 25 regulates type 2 cytokine-dependentimmunityandlimitschronic inflammation in the gastrointestinal tract[J].J Exp Med, 2006,203(4):843-849.
[6] TAMACHI T,MAEZAWA Y,IKEDA K,et al.IL-25 enhances allergic airway inflammation by amplifying a Th2celldependent pathway in mice[J].J Allergy Clin Immunol, 2006,118(3):606-614.
[7] BALLANTYNE S J,BARLOW J L,JOLIN H E.Blocking IL-25preventsairwayhyperresponsivenessinallergic asthma[J].J Allergy Clin Immunol,2007,120(6):1324-1331.
[8] 王莹,王华英,谢强敏,等.哮喘小鼠气道上皮杯状细胞增生模型[J].中国药理学通报,2006,22(22):51-53.
[9] 陈小芳,覃冬云,梁标.三氧化二砷对小鼠过敏性哮喘的治疗作用观察[J].实用临床医学,2005,6(9):4-6.
[10] 许卓谦,刘志刚.泼尼松对蟑螂致敏小鼠支气管哮喘模型的作用[J].中华结核和呼吸杂志,2006,29(4):282-284.
[11] MAGI M,GARCIA L,VANDENBRANDEN M,et al.Heat denaturation affects the Proder p 1 IgE reactivity and downregulates the development of the specific allergic response[J].J Allergy Clin Immunol,2004,114(2):545-552.
[12] BARLOW J L,FLYNN R J,BALLANTYNE S J,et al.Reciprocal expression of IL-25 and IL-17A is important for allergic airways hyperreactivity[J].Clin Exp Allergy,2011, 41(10):1447-1455.
[13] KIM M R,MANOUKIAN R,YEH R,et al.Structure and function of interleukin-17 family cytokines[J].Protein Cell,2011,2(1):26-40.
[14] 应延风,胡野,单小云,等.哮喘患儿外周血T淋巴细胞上前列腺素D2受体改变研究[J].中国当代儿科杂志, 2009,11(3):199-202.
[15] 李洪涛,张天托,陈壮桂,等.布地奈德对支气管哮喘小鼠树突细胞胸腺基质淋巴生成素受体表达的影响[J].中华结核和呼吸杂志,2012,35(7):497-502.
[16] RIFFO-VASQUEZ Y,PITCHFORD S,SPINA D.Cytokines in airway inflammation[J].Int J Biochem Cell Biol,2000, 32:833-853.
[17] SAGAR S,VERHEIJDEN K A,GEORGIOU N A,et al. Differential regulation of inflammation and immunity in mild and severe experimental asthma[J].Mediators Inflamm, 2013,80:8470.
[18] HIZAWA N,KAWAGUCHI M,HUANG S K,et al.Role of interleukin-17F in chronic inflammatory and allergic lung disease[J].Clin Exp Allergy,2006,36(9):1109-1114.
[19] SIEGLE S,HANSBRO N,DONG C,et al.Blocking induction of T helper type 2 responses prevents development of disease in a model of childhood asthma[J].J Clin Exp Immunol,2011,165(1):19-28.
DOI 10.3870/yydb.2014.08.005
Influence of Dexamethasone on IL-25 and IFN-γ in Bronchoalveolar Lavage Fluid of Asthmatic Mice
LU Wei1,WANG Lei1,QIAO Ming1,WANG Yu2,JIANG Ji-fu2,WU Zhong-ming2
(1.Department of Pediatrics, Affaliated Hospital,Zunyi 563099,China;2.Department of Immunology,Zunyi Medical University,Zunyi 563003,China)
Objective To investigate the mechanism of therapeutic action of dexamethasone on asthmatic mice by detecting the levels of IL-25 and IFN-γ in bronchoalveolar lavage fluid(BALF).MethodsBalb/c mice with SPF grade were randomly divided into normal control group,asthma group and dexamethasone group.Asthma group and dexamethasone group were sensitized and challenged with ovalbumin(OVA).Dexamethasone group was intraperitoneally injected with dexamethasone one hour before challenging.The mice were executed 24 hours after the last challenge,and the HE stained pathological sections of the right lung were made.Pathological sections of lung were observed.BALF in the left lung was also collected.The total white blood cell count and absolute eosinophile(EOS)count were observed,and the percentage of EOS was calculated.The levels of IL-25 and IFN-γ were measured with ELISA,and correlation analyses were made.ResultsThe counts of total white blood cell and EOS, and the percentage of EOS were significantly higher in the asthma group than in the normal control group and dexamethasone group (P<0.05).No differences were found between the normal control group and dexamethasone group.The IL-25 level was higher in the asthma group than in the normal control group and dexamethasone group(P<0.05),and its level in the dexamethasone group was also higher than that in the normal control group.The IFN-γ level was lower in the asthma group than in the normal control group and dexamethasone group(P<0.05),while there was no significant difference between the normal control group and dexamethasone group.IL-25 was negatively correlated with IFN-γ in each group.ConclusionPart of the mechanisms of dexamethasone acting on asthma are related to its inhibition on the pulmonary inflammation and promotion on the expression of IFN-γ,and possible inhibition of IL-25 expression.
Dexamethasone;Asthma;Interleukin-25;γ-Interferon
R977.1;R965
A
1004-0781(2014)08-0997-04
2013-07-10
2014-01-15
*贵州省科技厅基金资助项目(黔科合J字LKZ[2010]14号)
陆韦(1977-),女,贵州遵义人,副教授,硕士,研究方向:儿童哮喘。电话:(0)13193042247,E-mail:luweizmc @163.com。
