射干合剂灌胃后大鼠尿及粪便中6种成分含量*
2014-05-13唐跃年张健陆晓彤陈婷魏昕金樑孙朝荣胡松浩杨传敏严云
唐跃年,张健,陆晓彤,陈婷,魏昕,金樑,孙朝荣,胡松浩,杨传敏,严云
(上海交通大学医学院附属新华医院药剂科,上海 200092)
射干合剂灌胃后大鼠尿及粪便中6种成分含量*
唐跃年,张健,陆晓彤,陈婷,魏昕,金樑,孙朝荣,胡松浩,杨传敏,严云
(上海交通大学医学院附属新华医院药剂科,上海 200092)
目的 了解大鼠灌胃射干合剂后,指标成分在大鼠血清内吸收及其在大鼠尿、粪中24 h排泄情况。方法采用液相色谱-质谱联用技术测定化合物的含量,大鼠代谢笼技术。结果给予射干合剂后24 h指标成分基本从大鼠体内排泄完。结论麻黄碱在大鼠体内24 h基本排泄,黄酮类化合物在体内有互相转化的可能。服用射干合剂不会造成体内麻黄碱及黄酮类化合物的蓄积。
射干合剂;黄酮类化合物;麻黄碱;排泄;含量测定
射干合剂(Sheganheji,SGHJ)由射干、麻黄、杏仁、蔊菜、僵蚕、前胡、蝉衣、百部、黄芩9味中药组成,可宣肺清热,止咳祛痰平喘。其中麻黄具有平喘功效,黄酮类化合物有清热作用。SGHJ指纹图谱分析,SGHJ的可测定化合物主要为麻黄碱和黄酮类化合物[1]。目前,对SGHJ的成分及临床疗效研究较多,但有关的成分研究大多只限于成分的定性、定量分析,针对药效物质基础研究很少;有关药效研究也多集中在临床疗效方面。SGHJ在体内到底以何种成分、何种形式发挥作用以及作用机制如何,至今尚无明确的研究报道。笔者在本实验中建立动物血清SGHJ多指标成分测定方法的基础上[2],给大鼠口服灌胃SGHJ并测定血清、尿及粪便中指标成分变化[2],为进一步确定射干合剂药效的物质奠定基础。
1 材料与仪器
1.1 动物 清洁级SD大白鼠,体质量(200±35)g,雌雄各半;由上海交通大学医学院附属新华医院实验动物中心提供,实验动物使用许可证号:SYXK(沪)2008-0052,实验动物生产许可证号:SCXK(沪)2004-0001;空白血清、尿液、粪便均采自未服用目标物的动物。
1.2 试剂 黄芩苷(baicalin,BCL,批号:110715-200815,含量:95.2%)、黄芩素(baicalein,BCN,批号: 111595-200905,含量:98.5%)、汉黄芩素(wogonin, WG,批号:111514-201003,含量:98.3%)、射干苷(belamcandin,BLC,批号:111632-201001,含量: 98.7%)、次野鸢尾黄素(irisflorentin,IFR,批号: 111557-201002,含量:≥98.8%)、盐酸麻黄碱(ephedrine hydrochloride,ED,批号:171241-201007,含量:99.7%)、盐酸硫利达嗪(thioridazine hydrochloride, TD,批号:100344-201002,含量:95.2%)都购自中国食品药品检定研究院,均为对照品;SGHJ(上海美优制药厂,批号:11120,规格:每瓶100 mL);甲醇、乙腈(色谱纯,美国Tedia公司);水为双蒸水。其余试剂均为分析纯,全部溶剂均采用0.22 μm微孔滤膜过滤。
1.3 仪器 Agilent 6460串联四极杆质谱, Agilent1200高效液相色谱仪(美国惠普公司);Labofuge 400R高速离心机(上海力新有限公司);XW-80型旋涡混合器(原上海医科大学仪器厂);Olympus BX50光学显微镜(Olympus公司);pHS-3TC精密数显酸度计(上海天达仪器有限公司);电热恒温鼓风干燥箱(上海跃进医疗器械厂);As3120B超声波清洗器(上海医用分析仪器厂)。
2 方法与结果
2.1 色谱条件 分析柱:Capcell C18MGⅢ(2 mm× 100 mm,5 μm)[资生堂(中国)投资有限公司生产];保护柱:C18(4.0 mm×3.0 mm,5 μm)(美国Phenomenex公司)。流动相A为水,流动相B为乙腈,A∶B=95∶5 (V/V),二元线性梯度洗脱[0~0.5 min,A∶B(95%∶5%);~5 min,A∶B(95%∶5%)→A∶B(10%∶90%);~6.5 min,A∶B(10%∶90%)→A∶B(95%∶5%)→~10 min,A∶B(95%∶5%)]。流速: 0.3 mL·min-1;进样体积5 μL。
2.2 质谱条件 电喷雾离子源,正离子扫描;雾化气: 50 kPa,气帘气:20 kPa,碰撞气:48 kPa,离子源电压: 4 500 V,离子源温度:500℃,为正离子多离子反应监测扫描方式。在上述色谱、质谱条件下,通过质谱参数优化,分别得到BCL、BCN、WG、BLC、IFR、ED和内标TD的离子选择通道分别为m/z447.2→271.2、m/z271.2→123.2、m/z285.2→270.2、m/z463.2→301.2、m/z387.1→357.1、m/z166.2→148.2、m/z371.2→126.2。
2.3 对照品溶液和内标溶液的配制 分别取对照品BCL、BCN、WG、BLC、IFR、ED和内标TD适量精密称定,置100 mL量瓶中。用甲醇溶解并稀释至刻度,制成对照品储备液0.1 mg·mL-1,-20℃保存备用。
2.4 SGHJ中指标成分的含量测定 取SGHJ 1 mL加甲醇至10 mL,混匀,离心,取上清液为100 μL,用双蒸水稀释至1 mL,混匀,然后取内标为10 μL (0.1 μg·mL-1),加稀释液10 μL,再加水80 μL,混匀,0.22 μm滤膜过滤,进样体积5 μL;将测定值代入各自标准曲线,得到SGHJ中指标成分的含量及动物给药量。见表1。
2.5 空白血清及含药血清、尿液、粪便样品的制备血清:取空白和给药血0.3 mL,血清在3 000 r·min-1条件下离心10 min,取血清45 μL,加内标5 μL混匀,加甲醇150 μL,旋涡振荡,离心,上清液10 μL加水50 μL稀释进样测定。尿液:取空白和给药尿样,用甲醇稀释体积10倍,离心,然后取内标10 μL (0.1 μg·mL-1),加稀释尿液10 μL,再加水80 μL,混匀,进样,最终浓度相当于稀释了100倍。粪便:称取空白和给药粪便约0.1 g,加甲醇1 mL,超声处理30 min,离心,然后取内标100 μL(0.1 μg·mL-1),加稀释液5 μL,再加水895 μL,混匀,进样,最终浓度相当于稀释200倍。
2.6 各化合物线性范围及检测限 分别取“2.3”项下各对照品储备液,制备BCL、BCN、WG、BLC、IFR、ED标准曲线,其相关系数及最低检测限分别为,BCL:Y= 4.364×10-3+5.217×10-3X,r=0.999 5,LOD= 0.01 ng·mL-1;BCN:Y=5.436×10-3+7.221×10-3X,r=0.999 4,LOD=0.01 ng·mL-1;WG:Y=6.632× 10-3+5.374×10-3X,r=0.998 7,LOD=0.05 ng·mL-1; BLC:Y=5.736×10-3+6.638×10-3X,r=0.999 9,LOD= 0.05 ng·mL-1;IFR:Y=7.362×10-3+8.123×10-3X,r= 0.999 3,LOD=0.05 ng·mL-1;ED:Y=9.536×10-3+ 5.253×10-3X,r=0.998 9,LOD=0.05 ng·mL-1。
2.7 回收率实验 分别取空白血清、尿液、粪便若干份;配制BCL、BCN、WG、BLC、IFR、ED低、中、高3个浓度[分别为5,100,500 ng·mL-1]的质控样品,每一浓度取6份,按“2.5”项下方法进行样品预处理,按“2.1”项下LC-MS/MS条件进样测定,得上述化合物峰面积,以血清、尿液、粪便中各化合物的峰面积与水中各化合物峰面积相比×100%,得各化合物提取回收率89.6%~92.1%,87.4%~90.3%,79.9%~92.3%,88.3%~95.2%,83.4%~93.4%,85.2%~94.6%;RSD(n=6)均小于12.1%[2]。
2.8 精密度与准确度 按“2.3”项方法,制备BCL、BCN、WG、BLC、IFR、ED低、中、高3个浓度[分别为5, 100,500 ng·mL-1]的质控样品,每一浓度取6份,连续测定3 d,计算方法精密度与准确度,RSD均小于15.0%[2]。
2.9 动物的给药及体内化合物的测定 取SD大鼠12只,每只大鼠单剂量口腔灌胃SGHJ 1 mL·(100 g)-1,分别放入代谢笼中,分别在给药后2 h静脉采血0.3 mL;并收集大鼠24 h尿液、粪便;按“2.5”项方法处理,测定动物血清、尿液、粪便中指标成分的含量。
2.10 SGHJ给药后指标成分在尿液、粪便中的回收情况 大鼠灌胃SGHJ后,收集24 h尿液、粪便按“2.5”项方法处理后,测定的化合物与大鼠血清中化合物相同;但是在尿液、粪便中的回收率有很大的差异。见表1。
2.11 SGHJ血中指标成分吸收 各指标成分在制剂及大鼠吸收后血中浓度。见表2。

表1 SGHJ给药24 h后指标成分在大鼠尿液、粪便中回收情况Tab.1 Recovery of marker components in SGHJ in urine and feces of rats 24 h after SGHJ treatment
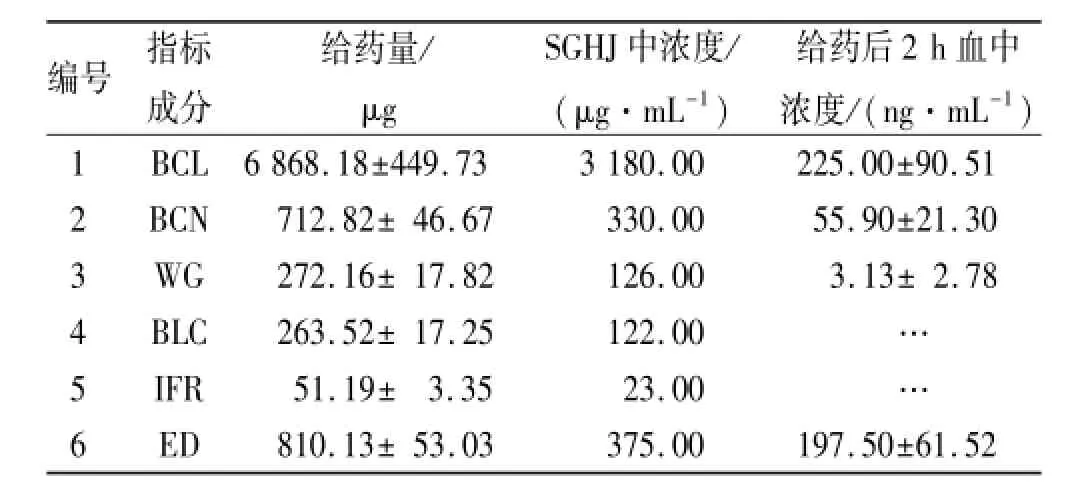
表2 SGHJ中指标成分含量2 h后在大鼠血中浓度Tab.2 Content of marker components in SGHJ and their blood level in 12 rats 2 h after SGHJ treatment
3 讨论
实验得知:SGHJ指标成分中BCL、BCN、WG、ED可被大鼠吸收进入血液,而BLC、IFR在动物给药后未能在体内血液、粪便和尿液中也检测到,可能是浓度太低所致;ED在吸收进入体内24 h基本从尿中回收,粪便中不能测得。说明ED主要经由肾脏排泄;BCL可在消化道内吸收,部分在尿中排泄,极少量在粪便中排泄;BCN能被消化道吸收,部分从尿液、粪便中排泄; WG吸收后,尿中、粪便中都有回收,并超过给药量,说明黄酮类化合物在体内存在相互转化的可能。实验说明,ED在体内不会蓄积,24 h内基本可排出体外,而黄酮类化合物在体内的变化较为复杂,种类繁多。中药黄芩中就含有:BCL、BCN、WG、汉黄芩苷、野黄芩苷、黄芩新素Ⅰ、黄芩新素Ⅱ、白黄杨素、千层纸黄素A、粘毛黄芩素Ⅰ、粘毛黄芩素Ⅲ等,需要更全面地测定各种黄酮类化合物在体内的变化,才能进一步了解各成分之间可能存在互相转化的过程[3-4]。本实验仅测定了部分的黄酮类化合物,不能对它们之间的转变有明确的结论,其互相转变的过程需要进一步实验证实。
[1] 唐跃年,金樑,张青,等.射干合剂的HPLC-UV指纹图谱分析[J].中国临床药学杂志,2012,21(5):283-286.
[2] 唐跃年,陈婷,魏昕,等.LC-MS/MS法测定动物血清中射干合剂多指标成分的浓度[J].中国药师,2013,16(2): 190-193.
[3] 陶巧凤,赵昱,罗旭.RP-HPLC测定黄芩素及其代谢产物黄芩苷大鼠血浆浓度[J].中国药学杂志,2007,42(12): 929-932.
[4] 刘太明,蒋学华,张梅娟,等.黄芩苷和黄芩素的大鼠在体肠吸收特性[J].中国药学杂志,2006,41(23):1784-1787.
DOI 10.3870/yydb.2014.08.002
Content of Six Compounds in Urine and Feces After Intragastric Administration of Shegan Heji in Rat
Objective To study absorption ofshegan hejimarker components in blood and their excretion in urine and feces of rats,after intragastric administration ofshegan heji.MethodsLC-MS/MS was used for determination of marker compounds.Rat metabolic cage technology was employed.ResultsExcretion of marker components were completed 24 hours after administration.ConclusionEphedrine can be excreted from rats within 24 hours.The possibility of mutual transformation of flavonoids exists in the body.Takingshegan hejiwill not cause accumulation of ephedrine and flavonoids in the body.
Shegan heji;Flavonoids;Ephedrine;Excretion;Content determination
R286;R285.5
A
1004-0781(2014)08-0985-03
2013-07-30
2014-01-16
*上海市卫生局中医药科研基金资助项目(2012G003A);上海市科委基金资助项目(11D21972500)
唐跃年(1956-),男,上海人,副主任药师,研究方向:中药学。电话:021-25077162,E-mail:tyn2018@163.com。
严云(1964-),女,上海人,主任医师,学士,研究方向:血液病。电话:021-25077160,E-mail:yy13651706181 @163.com。
TANG Yue-nian,ZHANG Jian,LU Xiao-tong,CHEN Ting,WEI Xin,JING Liang,SUN Chao-rong,HU Songhao,YANG Chuan-min,YAN Yun(Department of Pharmacy,Xinhua Hospital Affiliated to Medical College,Shanghai Jiaotong University,Shanghai200092,China)
