诺考达唑抑制大鼠血管平滑肌细胞增殖的作用及机制*
2014-05-13李丹郭小梅
李丹,郭小梅
(华中科技大学同济医学院附属同济医院心血管内科,武汉 430030)
诺考达唑抑制大鼠血管平滑肌细胞增殖的作用及机制*
李丹,郭小梅
(华中科技大学同济医学院附属同济医院心血管内科,武汉 430030)
目的 研究诺考达唑抑制大鼠血管平滑肌细胞(rVSMCs)的作用及机制。方法将rVSMCs分为A、B、C、D 4组,A组常规培养,B组无血清培养24 h,C组无血清培养48 h后常规培养18 h,D组先后加入胸腺嘧啶核苷(工作浓度为0.05 g·mL-1)作用12 h后再加入诺考达唑(工作浓度为0.05 g·mL-1)继续维持12 h。分别进行细胞周期的检测,观察细胞超微结构的变化,检测糖代谢、氨基酸代谢与ATP以及NAD/NADH的变化以及线粒体融合蛋白2(Mfn-2)的表达。结果流式细胞术检测结果显示B、C、D组细胞分别阻滞于G0/G1期,S期及G2/M期。电子显微镜检测显示D组线粒体的数量减少,体积缩小。D组与A组及C组相比,糖代谢、氨基酸代谢均显著降低,ATP的产生明显减少, NADH的生成显著增加(P<0.05)。Western Blot示G2/M期细胞阻滞与诺考达唑均可导致Mfn-2表达增高(P<0.05)。结论诺考达唑可明显降低rVSMCs能量代谢,阻断rVSMCs的增殖状态,可能与Mfn-2抗动脉粥样硬化的作用有关。
诺考达唑;增殖,血管平滑肌细胞;大鼠;代谢,能量;线粒体融合蛋白-2;动脉粥样硬化
经皮冠状动脉内介入治疗(percutaneous coronary intervention,PCI)术后再狭窄严重影响冠心病患者的预后,血管壁的损伤、炎症以及血管平滑肌的增殖是造成血管再狭窄的主要因素,其中血管平滑肌的增殖是关键因素,因此阻止血管平滑肌的异常增殖,预防PCI术后再狭窄,对改善患者预后具有重要的意义。笔者在本研究中首次发现诺考达唑可有效降低大鼠血管平滑肌细胞(rat vascular smooth muscle cells,rVSMCs)能量代谢,阻断rVSMCs的增殖状态,可为探索调控rVSMCs的异常增殖与分化提供新的思路和策略。
1 材料与方法
1.1 细胞 Wistar大鼠胸主动脉血管平滑肌细胞(rVSMCs),由美国国立卫生研究院提供。
1.2 主要试剂 诺考达唑、碘化丙啶(propidium iodide,PI)、RNase A(美国Sigma公司,批号:M1404, P4170,R6513);糖氧化水平定量试剂盒(美国,BioAssay Systems,批号:DIGL-100)、L-氨基酸定量检测试剂盒(美国,BioVision,批号:K639-100)、ATP比色测定试剂盒(美国,BioVision,批号:K354-100)、烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide, NAD/NADH)检测试剂盒(美国,BioAssay System,批号:E2ND-100、ECNP-100);兔抗线粒体融合蛋白2抗体(美国,abcam,批号ab50483)。
1.3 主要仪器 YT-875型超净工作台(苏州净化设备厂);Heal force二氧化碳细胞培养箱(香港力康公司);Millipore超纯水制备机(美国Millipore公司);低速/低温超高速离心机(美国Sigma公司); FACSCalibur流式细胞仪(美国BD公司);超薄切片机(德国LEICA ULTRACUT UCT);透射电镜(荷兰FEI Tecnai G212型);ELX-800酶标仪(美国Bio-Tek公司);电泳转膜设备(美国Bio-Rad公司)。
1.4 实验分组 A组:Wistar大鼠胸主动脉血管平滑肌细胞,实验选择3~5代处于对数生长期的细胞,采用DMEM高糖培养基(含10%胎牛血清)在37℃、5%CO2细胞培养箱中常规培养,细胞生长约50%丰度时进行以下处理。B组为换DMEM高糖培养基(不含血清)同步化培养24 h;C组为DMEM高糖培养基(不含血清)同步化培养48 h,接着常规培养18 h;D组为先加入胸腺嘧啶核苷(工作浓度为0.05 g·mL-1)作用12 h后再加入诺考达唑(工作浓度为0.05 mg·mL-1)继续维持12 h。
1.5 流式细胞术检测 收集细胞,0.25%胰酶消化,用10 mL培养基重悬;4℃,1 000 r·min-1离心8 min, 75%乙醇预冷,-20℃过夜;次日转入流式管中,每管加入PI(工作浓度0.5 mg·mL-1)50 mL和RNase A (工作浓度100 mg·mL-1)10 mL,37℃,避光水浴30 min;室温避光放置30 min;FACSCalibur流式细胞仪检测并分析[1]。
1.6 常规透射电子显微镜成像 收集处理后的细胞,沿管壁缓慢加入2.5%戊二醛缓冲固定液,2.5%戊二醛缓冲固定液固定2 h,0.1 mmol·L-1磷酸缓冲液清洗2× 20 min,1%锇酸后固定30~120 min,0.1 mmol·L-1磷酸缓冲液清洗,按50%乙醇、70%乙醇、90%乙醇、90%乙醇丙酮、90%丙酮、100%丙酮(2次)各5 min梯度脱水,丙酮与环氧树脂1∶1混合半浸透2 h,纯环氧树脂包埋剂浸透2 h,包埋,聚合(80℃恒温箱内)10 h,修块。超薄切片染色:醋酸双氧铀和枸橼酸铅双重染色各10 min;透射电镜观察、摄像。
1.7 糖氧化水平的定量检测 按照QuantiChromTM糖氧化水平定量试剂盒(BioAssay Systems)说明书依次完成后,检测A630 nm读数。
1.8 L-氨基酸水平的定量检测 按照BioVison L-氨基酸定量检测试剂盒说明书依次完成后;检测A570 nm。
1.9 ATP水平的比色测定 按照BioVison ATP Colorimetric检测试剂盒说明书依次完成后;检测A570 nm。
1.10 NAD/NADH水平的定量检测 按照BioAssay EnzyChromTMNAD/NADH检测试剂盒说明书依次完成后;检测A570 nm[2]。
1.11 免疫印迹分析 收集细胞,每皿100 mm,加入RIPA裂解液100 mL,冰上裂解30 min;4℃, 12 000 r·min-1离心15 min,收集上清液,根据BCA蛋白浓度测定试剂盒检测待测蛋白样品的A490 nm,计算待测蛋白样品浓度;准备蛋白样品100 mg,进行聚丙烯酰胺凝胶电泳;230 mA下转印约2.5 h;室温下5·TBS-脱脂牛奶振荡封闭1 h;加入用封闭液稀释的一抗,4℃孵育过夜;次日加入用封闭液稀释的辣根过氧化物酶标记二抗,室温振动孵育2 h;加入显色液,避光孵育1 min;暗室曝光,显影定影,胶片晾干后,经扫描仪扫描,Adobe Photoshop软件转换格式后,Image J图形软件计算灰度值,进行半定量分析。具体步骤参见已经发表的文章[3]。
1.12 统计学方法 相关实验数据均采用均数±标准差表示,采用SPSS 19.0版统计分析软件进行单因素方差分析,组间差异采用双尾t检验,P<0.05表示差异有统计学意义。
2 结果
2.1 诺考达唑可阻断rVSMCs的增殖状态 流式细胞术检测结果显示,A组大鼠血管平滑肌细胞G0/G1期、S期和G2/M期的细胞分布比例平均值依次为:51.36%, 39.53%和9.12%;B组采用无血清DMEM高糖培养基同步化培养24 h,平均约80.10%细胞停滞于G0/G1期; C组采用无血清DMEM高糖培养基同步化培养48 h,接着换DMEM高糖培养基(含10%胎牛血清)继续培养18 h,(58.88±4.72)%的rVSMCs停滞于S期;D组直接加入胸腺嘧啶核苷作用12 h将细胞同步化后,再加入诺考达唑继续作用12 h后,平均75.07%的rVSMCs被阻滞于G2/M期(n=6)。见图1。
2.2 电子显微镜结果显示诺考达唑处理rVSMCs后超微结构的改变 电子显微镜观察显示,C组与A组和B组比较,线粒体数量基本不变,但是明显肿胀甚至透亮;但是,D组诺考达唑处理后,其线粒体的数量明显减少,体积也显著缩小,还出现了大量的自噬体。见图2。
2.3 诺考达唑可导致rVSMCs能量代谢降低 A组与C组、B组与D组的rVSMCs糖代谢、氨基酸代谢、ATP的产生以及NAD/NADH的代谢水平均差异无统计学意义,但是,D组与A组和C组比较,rVSMCs糖代谢、氨基酸代谢、ATP的产生均明显降低,NADH产生显著增高(P<0.05或P<0.01,n=12)。见图3。
2.4 诺考达唑可上调Mfn-2的表达 免疫印迹半定量分析的结果表明,A、B、C、D组rVSMCs中Mfn-2蛋白条带与内参Tubulin的相对灰度值分别为(0.331± 0.055),(1.057±0.424),(0.266±0.078),(1.067± 0.425)(n=9)(P<0.05),即增殖期较未增殖期相比, Mfn-2的表达降低,诺考达唑处理后Mfn-2的表达较增殖期增高。见图4。
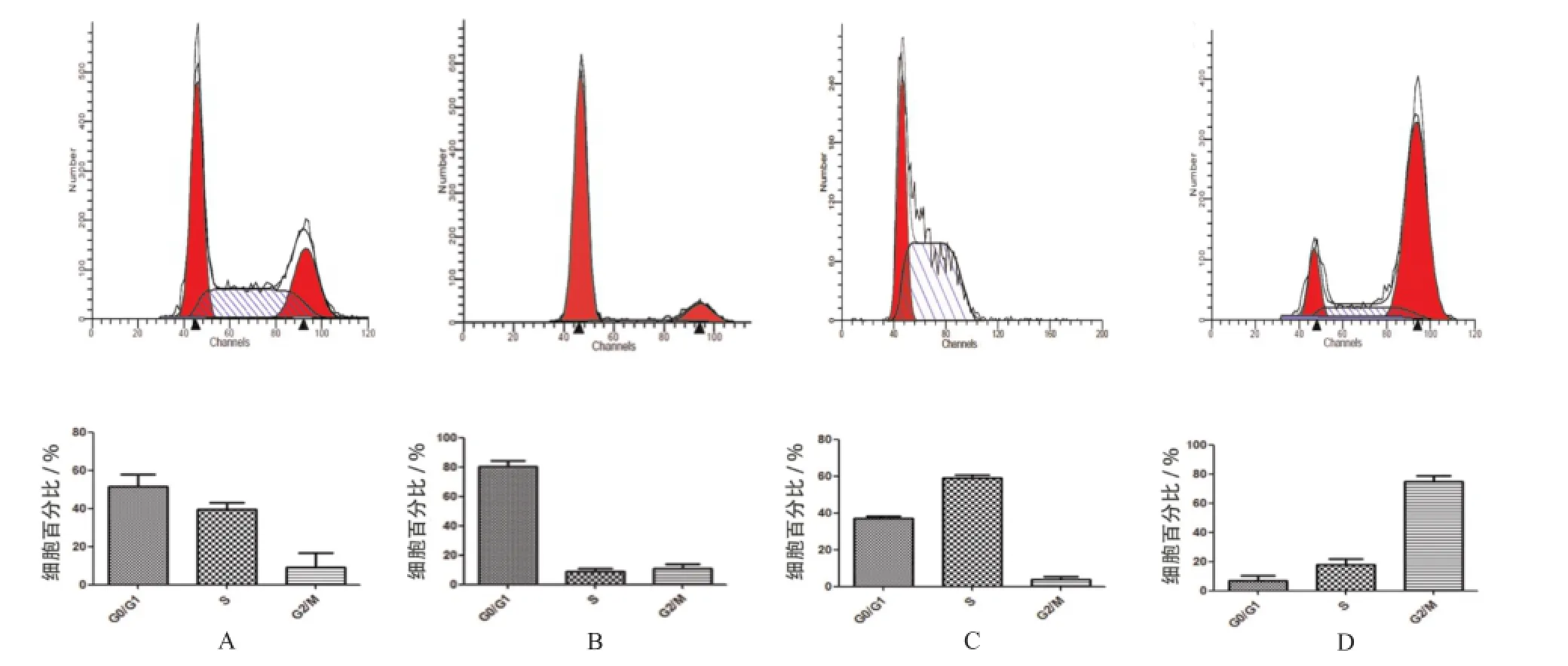
A.A组;B.B组;C.C组;D.D组图1 4组细胞周期的流式细胞术检测结果(n=6)A.group A;B.group B;C.group C;D.group DFig.1 Results of cell cycle distribution in four groups by flow cytometry analysis(n=6)
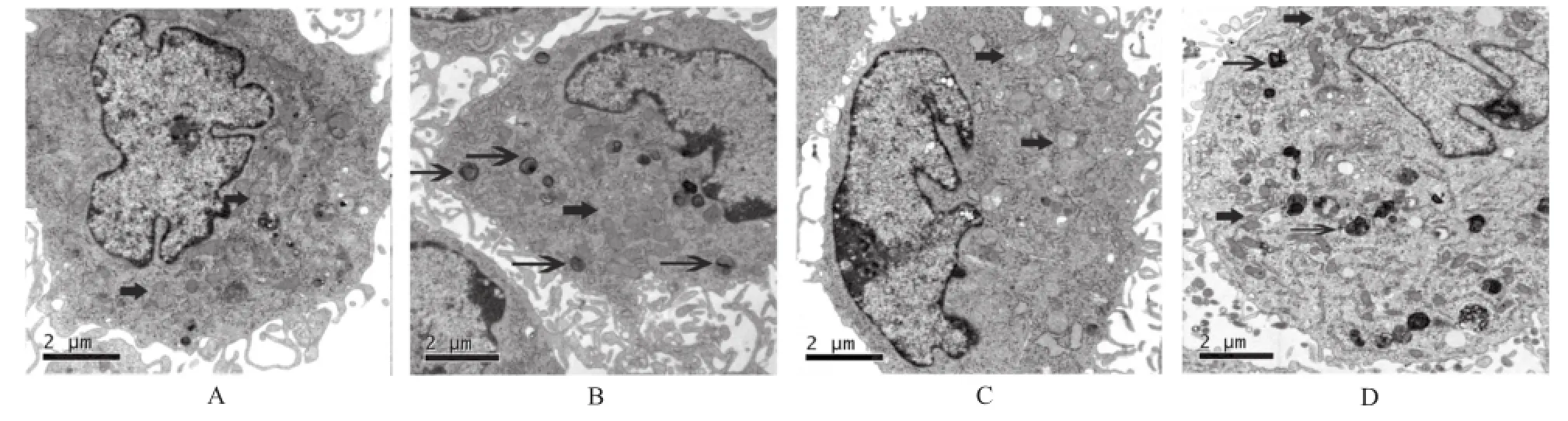
A.A组;B.B组;C.C组;D.D组(粗箭头示线粒体,细箭头示自噬体)图2 4组细胞超微结构的电子显微镜结果A.group A;B.group B;C.group C;D.group D(coarse arrows show mitochondria,fine arrows show autophagosome)Fig.2 Ultrastucture changes of four groups of cells by transmission electron microscopy

A.糖代谢的水平;B.氨基酸代谢水平;C.ATP的产生;D.NAD水平;1.A组;2.B组;3.C组;4.D组;与A组比较,*1P<0.01;与C组比较,*2P<0.05图3 诺考达唑处理后rVSMCs能量代谢的变化(n=12)A.metabolic levels of glucose;B.metabolic levels of L-amino acid;C.ATP production;D.NAD level;1.group A;2.group B;3.group C;4.group D;compared with group A,*1P<0.01;compared with group C,*2P<0.05Fig.3 Changes of energy metabolism of rVSMCs after nocodazole treatment(n=12)

A.电泳图;B.柱形图;1.A组;2.B组;3.C组;4.D组;与A组比较,*1P<0.05;与C组比较,*2P<0.05图4 诺考达唑处理后Mfn-2表达的变化(n=12)A.electrophotogram;B.histogram;1.group A;2.group B;3. group C;4.group D;compared with group A,*1P<0.05;compared with group C,*2P<0.05Fig.4 Changes of Mfn-2 expression after nocodazole treatment(n=12)
3 讨论
血管平滑肌细胞增殖的分子机制一直是动脉粥样硬化以及PCI术后再狭窄研究的热点。目前的研究认为炎症与免疫、血流动力学的不稳定等在血管平滑肌细胞的增殖中扮演着重要的角色。笔者的研究发现诺考达唑可阻断大鼠血管平滑肌细胞的增殖状态并降低其能量代谢,可能与Mfn-2抑制平滑肌细胞增殖的分子机制有关。通过细胞周期的各个阶段的启动和后续进展的精确控制细胞增殖至关重要。胸腺嘧啶核苷与诺考达唑是研究细胞周期中常用的诱导药物。胸腺嘧啶核苷作为一种常用的DNA合成抑制药可逆地抑制S期细胞DNA合成而不影响其他细胞周期运转,将处于不同时相的细胞群体阻断在G1/S期交界处;诺考达唑是一种纺锤体抑制药,可抑制纺锤体的形成及功能,最终可将细胞群体阻断在G2/M期,细胞发生严重的核内复制,导致多倍体细胞的形成,失去细胞正常的增殖功能。
通过进一步的研究发现,诺考达唑阻断rVSMCs的增殖状态的同时,rVSMCs的线粒体的形态、分布与能量代谢均发生了明显的变化。这提示诺考达唑阻断rVSMCs的增殖状态与线粒体中的某种物质有关。笔者研究发现诺考达唑处理后rVSMCs中Mfn-2的表达较增殖期升高,故而推测诺考达唑阻断rVSMCs的增殖状态与Mfn-2有关。Mfn-2是分布于线粒体外膜与线粒体融合与分裂相关的蛋白质。笔者早期的实验已经证实,抑制Mfn-2的表达会导致rVSMCs的增殖[1],增强Mfn-2的表达可抑制rVSMCs的增殖[4]。实验显示增殖期C组的rVSMCs线粒体较A组明显肿胀,胸腺嘧啶核苷联合诺考达唑处理后rVSMCs线粒体的体积明显缩小,数量骤减,并出现大量的自噬体,同时,细胞停滞生长期B组线粒体的体积也比较小,也有一部分自噬体,即诺考达唑处理后细胞的超微结构与B组非常相似。与增殖期相比,诺考达唑处理后rVSMCs糖代谢、氨基酸代谢水平明显降低,ATP的产生锐减, NADH的水平明显增多而NAD的水平明显降低。这可能是由于糖代谢、氨基酸代谢均检测的是胞质中的代谢水平,诺考达唑处理后rVSMCs发生严重的核内复制,其糖代谢主要依赖糖酵解,代谢水平远远低于糖氧化,故ATP的生成明显减少,三羧酸循环的限速酶NADH的产生也显著减少;其氨基酸代谢的来源主要为核内氨基酸,代谢水平也降低。而且诺考达唑处理后rVSMCs代谢水平与B组差异无统计学意义,B组与诺考达唑处理后rVSMCs中Mfn-2的表达均比C组增高。提示诺考达唑可能通过诱导rVSMCs中Mfn-2的表达来阻断rVSMCs的增殖状态。在线粒体内Mfn-2在钙离子介导的NADH的产生中起着关键的作用[5-6],Mfn-2可介导内质网与线粒体的融合[7-8],导致线粒体从内质网摄取钙离子促进葡萄糖氧化,三羧酸循环限速酶NADH的产生增加。
总之,诺考达唑可阻断rVSMCs的增殖状态,导致rVSMCs的线粒体的体积缩小、数量减少,能量代谢降低,可能与Mfn-2有关,相关的分子机制还有待于进一步的研究。
[1] CHEN K H,GUO X M,MA D,et al.Dysregulation of HSG triggers vascular proliferative disorders[J].Nat Cell Biol, 2004,6(9):872-883.
[2] SHIOTA A,SHIMABUKURO M,FUKUDA D,et al.Telmisartan ameliorates insulin sensitivity by activating the AMPK/ SIRT1 pathway in skeletal muscle of obese db/db mice[J]. Cardiovasc Diabetol,2012,11:139.
[3] GUO X M,CHEN K H,GUO Y,et al.Mitofusin 2 triggers vascular smooth muscle cells apoptosis via mitochondrial death pathway[J].Circ Res,2007,101(11):1113-1122.
[4] GUO Y,CHEN K H,GAO W,et al.Overexpression of mitofusin 2 inhibited oxidized low-density lipoprotein induced vascularsmoothmusclecellproliferationandreduced atherosclerotic lesion formation in rabbit[J].Biochem Bioph Res Co,2007,363(2):411-417.
[5] CHEN Y,CSORDAS G,JOWDY C,et al.Mitofusin 2-containing mitochondrial-reticular microdomains direct rapid cardiomyocyte bioenergetic responses via interorganelle Ca2+crosstalk[J].Circ Res,2012,111(7):863-875.
[6] KONSTANTINIDIS K,LEDERER W J,RIZZUTO R,et al. Mitofusin 2 joins the sarcplasmic reticulum and mitochondria at the hip to sustain cardiac energetics[J].Circ Res,2012, 111(7):821-823.
[7] MERKWITH C,LANGER T.Mitofusin 2 builds a bridge between ER and mitochondria[J].Cell,2008,135(7): 1165-1167.
[8] MARTINS D E,BRITO O,SCORRANO L.Mitofusin 2 tethers endoplasmic reticulum to mitochondria[J].Nature,2008,456 (7222):605-611.
DOI 10.3870/yydb.2014.08.007
Effect and Underlying Mechanism of Nocodazole on Inhibition of Rat Vascular Smooth Muscle Cell Proliferation
LI Dan,GUO Xiao-mei
(Department of Cardiology,Tongji Hospital,Tongji Medical College,Huazhong University of Science and Technology,Wuhan 430030,China)
Objective To investigate the effect and underlying mechanism of nocodazole on the inhibition of rVSMCs proliferation.MethodsrVSMCs were divided into four groups,group A(normal culture),group B(serum-free culture for 24 h),group C(18 h normal culture after 48 h of serum-free culture),and group D(nocodazole treatment for 12 h after thymidine treatment for 12 h).Flow cytometry,transmission electron microscopy,and metabolism measurements were performed and mitofusin-2(Mfn-2)expression was detected.ResultsFlow cytometry analysis showed rVSMCs of group B、C、D were arrested to G0/G1,S and G2/M phases,respectively.Less and smaller mitochondria were observed in group D by transmission electron microscopy in nocodazole-treated rVSMCs.Compared with groups A and C,there were significant decreases in glucose and L-amino acid metabolism,levels of ATP,and marked increase in NADH in group D(P<0.05).Western Blot showed that G2/M cell cycle arrest and nocodazole could induce up-regulation of Mfn-2 in rVSMCs(P<0.05).ConclusionNocodazole can block the energy metabolism and proliferation in rVSMCs,which is probably associated with the role of Mfn-2 on antiatherosclerosis.
Nocodazole;Proliferation,vascular smooth muscle cells;Rat;Metabolism,energy;Mitofusin-2,energy; Atherosclerosis
R972.6;R965
A
1004-0781(2014)08-1004-05
2014-01-02
2014-03-08
*国家自然科学基金资助项目(30872714)
李丹(1980-),女,湖北鄂州人,在读博士,研究方向:分子心脏病学。电话:027-83663608,E-mail:tjhlidan@126.com。
郭小梅(1959-),男,湖北大冶人,主任医师,教授,博士,研究方向:分子心脏病学。电话:027-83663608,E-mail:xmguo @tjh.tjmu.edu.cn。
