罗非鱼鱼皮胶原肽-葡萄糖美拉德反应产物的制备及其抗氧化活性*
2014-05-12刘蒙蒙杨美智子孙云孙丽平庄永亮
刘蒙蒙,杨美智子,孙云,孙丽平,庄永亮
(昆明理工大学化学工程学院食品工程研究中心,云南昆明,650500)
近年来,开发食源性活性肽作为食品天然抗氧化剂已经成为研究热点。但是食源性活性肽普遍存在味苦、抗氧化性能不全面的缺陷。Dong等[1]研究认为,美拉德反应(Maillard reaction,MR)可以掩蔽酪蛋白肽的苦味;Liu等[2]发现,大豆蛋白水解物的美拉德反应产物(Maillard reaction products,MRPs)表现高于水解物的还原能力、DPPH自由基清除活性和Fe2+螯合活性;Guerard等[3]研究表明,加热酪蛋白胨和鳕鱼内脏水解物与葡萄糖的混合物,加热产物对自由基清除活性相比水解液本身提高了75%。
罗非鱼(Oreochromis niloticus)是我国重要的经济鱼种,加工过程中产生了大量的皮、骨等副产物。前期的研究中制备了具有抗氧化活性的罗非鱼鱼皮胶原肽[4]。本文以前期制备的罗非鱼鱼皮胶原肽为原料,制备了不同条件下的胶原肽-葡萄糖的美拉德反应体系,对体系的pH值变化、MRPs在294 nm处的吸光值、褐变程度、荧光强度以及体系中游离氨基基团的含量进行了跟踪测定,进一步对MRPs的抗氧化活性进行了分析,以期对不同条件下美拉德反应对罗非鱼鱼皮胶原肽的影响进行评价。
1 材料和方法
1.1 材料与仪器
未分级的罗非鱼鱼皮胶原肽由前期实验制备[4]。
KW1000DC型数显恒温水浴锅,金坛市科析仪器有限公司;TDL-40B型离心机,上海安亭科学仪器有限公司;TU-1901紫外可见分光光度计,北京普析通用仪器有限责任公司;FE20实验室pH计,梅特勒-托利多(上海)有限公司;RF-5310PC荧光分光光度计,日本岛津公司。
1.2 不同条件下鱼皮胶原肽-葡萄糖美拉德反应体系的制备
用0.2 mol/L pH 8.0的磷酸盐缓冲液制备胶原肽溶液,浓度为25mg/mL,利用茚三酮比色法[5]测定溶液中游离氨基的摩尔浓度,以此浓度为基础,加入葡萄糖,使体系中氨基与羰基的比例为1∶0.5、1∶1和1∶2,在后面的部分分别表示为 TSGP/G 1∶1,TSGP/G 1∶0.5,和 TSGP/G 1∶2。将溶液分别转移至 25mL 螺旋密封管中(German Schott),80℃的水浴加热12 h,分别于 0,1,3,6,12h 取样,立即冷却,取部分 MRPs用于测定pH值和游离氨基浓度,其余MRPs保存于4℃下备用。不添加葡萄糖的TSGP作为对照试验。
1.3 MRPs的光度分析
按照孙丽平等[6]的方法测定不同条件下MRPs的紫外吸光值、褐变强度和荧光强度。
1.4 美拉德反应产物的抗氧化活性的测定
1.4.1 DPPH·清除活性的测定
取0.4 mL不同反应体系的MRPs,加入2 mL 0.1 mmol/L DPPH甲醇溶液,混匀,暗处放置30 min并不断振荡,在517 nm处测其吸光度。0.4 mL水+2 mL甲醇为空白,0.4 mL蒸馏水代替样品为对照。常用抗氧化剂Vc作为阳性对照。清除率计算公式为:
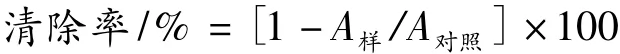
1.4.2 OH·清除活性的测定
取1.0 mL不同反应体系的MRPs,依次加入0.3 mL 8.0 mmol/L FeSO4溶液,0.25 mL 20 mmol/L H2O2溶液和1.0 mL 3.0 mmol/L水杨酸溶液,混匀,37℃水浴30 min,取出流水冷却,加入0.45 mL蒸馏水,使体系最终保持3.0 mL,3 000 r/min离心10 min,取上清液于510 nm处测定吸光值。1.0 mL蒸馏水代替水杨酸溶液为样品对照,1.0 mL蒸馏水代替样品+1.0 mL蒸馏水代替水杨酸溶液为空白调零,1.0 mL蒸馏水代替样品为对照。清除率计算公式为:

1.4.3 ABTS自由基清除活性的测定
将5 mL 7 mmol/L ABTS和88 μL 的140 mmol/L过硫酸钾混合,在室温,避光的条件下静置12 h,形成ABTs·储备液。该储备液在室温,避光的条件下稳定。使用前用无水乙醇稀释成工作液,要求其在30℃下、734 nm波长下的吸光度为0.70±0.02。
取0.5 mL不同反应体系的 MRPs,加入 4 mL ABTS·工作液充分混合10 s,30℃水浴6 min,于734 nm波长处测吸光度。0.5 mL无水乙醇+4 mL ABTS+·工作液,在0 min时的吸光值为对照,0.5 mL水+4 mL无水乙醇为空白调零。不同浓度的Trolox标准液(0,40,80,120,160 μmoL/L)绘制标准曲线。清除率计算公式为:
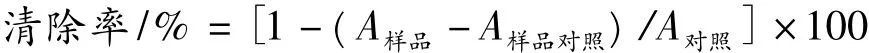
清除活性以Trolox当量表示。
1.4.4 还原能力的测定
取1.0 mL不同反应体系的MRPs,加入1.0 mL磷酸盐缓冲液(0.2 mol/L,pH 6.6)和1.0 mL 1%铁氰化钾溶液,混匀,50℃水浴20 min,取出,加入1 mL 10%三氯乙酸溶液,混匀,迅速冷却。取1.0 mL混合液于5.0 mL离心管中,加入1.0 mL超纯水和0.2 mL 0.1%的三氯化铁溶液,混匀,测定溶液在700 nm处的吸光度(A700)。Vc作为阳性对照。蒸馏水代替样品作为空白调零。以A700表示样品的还原能力。
1.5 统计分析
每个试验重复3次,结果表示为平均值±偏差。数据统计分析采用SPSS11.5软件(P<0.05表示差异显著,P>0.05表示差异不显著)。
2 结果和讨论
2.1 pH值的变化
在美拉德反应中,pH值至关重要,因为羰氨缩合是一个可逆的过程,羰氨缩合过程中封闭了游离的氨基,反应体系pH值下降,所以碱性条件有利于初始的羰氨缩合反应[7]。本研究美拉德反应体系pH值变化如图1所示。反应1h后,除TSGP外,所有体系的pH值均出现显著的下降趋势(P<0.05),随后,pH值下降缓慢,直至反应结束。TSGP/G 1∶2中pH值下降幅度最大,表明较高的葡萄糖浓度产生相对较高的pH值降低,这一结果与王惠英等[8-9]的结果一致。美拉德反应中pH值的降低也可能是由于反应过程中产生了有机酸,如甲酸和乙酸[10]。
2.2 MRPs光度的变化
美拉德反应的小分子中间产物具有强紫外光吸收和荧光,294 nm光吸收是由糖裂解产生的酮、醛类等无色小分子物质产生的,美拉德体系中荧光强度与紫外光吸收强度的发展表现为不同的动力学行为,所以荧光小分子物质被认为是不同于具有紫外光吸收物质的小分子产物[6]。褐变强度(420 nm处的吸光值)是一个用于评价美拉德反应进程的非特定性参数,这主要是美拉德反应后期产生了高分子褐色化合物类黑素,其在420 nm处有最大特征性吸收[11]。本研究体系中MRPs在294 nm的吸光值(A294)、褐变强度和荧光强度的变化如图2所示。随加热时间的增加,除TSGP外,所有美拉德反应体系的A294、褐变强度和荧光强度均显著增加(P<0.05)。
由图2(a)可以看出,TSGP/G 1∶2体系的 MRPs的A294显著高于 TSGP/G 1∶1和 TSGP/G 1∶0.5(P<0.05)。加热 12h后,TSGP/G 1∶2体系 MRPs的A294表现最大的增加值,其次是TSGP/G 1∶1和TSGP/G 1∶0.5。从本结果可以看出,美拉德反应中葡萄糖浓度越高,反应越快。同样的,TSGP/G 1∶2体系的MRPs具有最大的褐变强度,随后是TSGP/G 1∶1和TSGP/G 1∶0.5。童彦等[12]发现,随着葡萄糖添加量的增加,420 nm处吸光值(褐变强度)不断增加,说明葡萄糖不断参与美拉德反应,褐色物质不断生成,反应程度持续加深。从结果可以看出,所有样品的褐变强度随A294的增加而增加。一般来说,中间阶段的紫外吸收和无色化合物引起美拉德反应和焦糖化反应中褐色色素的形成[13]。在任一反应时间点,TSGP/G 1∶2的荧光强度均大于TSGP/G 1∶0.5和TSGP/G 1∶1,与A294和褐变强度的变化趋势相似。美拉德反应中荧光化合物的形成先于褐色色素的产生[14]。荧光化合物可能是褐色色素的前体[15]。
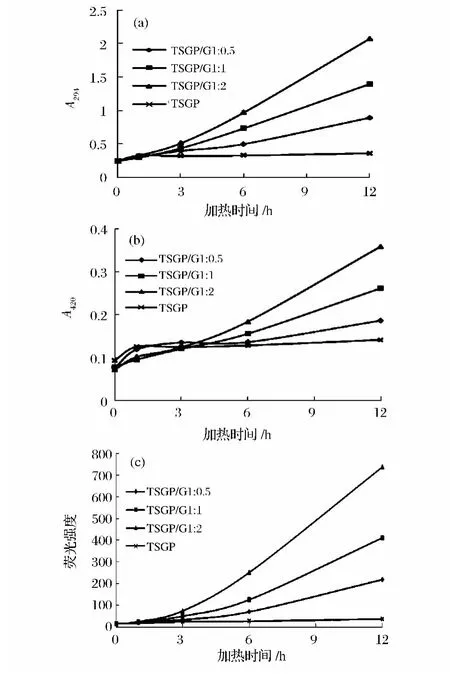
图2 MRPs在294nm下的吸光值(a)、褐变强度(b)和荧光强度(c)随加热时间的变化Fig.2 Changes in absorbance at 294 nm(a),browning intensity(b)and fluorescence intensity(c)of MRPs as function of heating time
2.3 游离氨基浓度的变化
美拉德反应体系中游离氨基浓度随加热时间的变化如图3所示。反应3 h内,含有不同浓度葡萄糖的TSGP-G体系中游离氨基的浓度显著下降(P<0.05),随后,随加热时间的增加,各体系中游离氨基的含量出现不同程度的变化,TSGP/G 1∶2体系中MRPs的游离氨基含量随加热时间的增加而持续降低。加热12 h 后,TSGP/G 1∶0.5,TSGP/G 1∶1和 TSGP/G 1∶2体系中减少的游离氨基含量分别为23.60%,25.62%和33.11%。单独加热的TSGP中游离氨基含量也随加热时间的增加而减少,但不明显。结果表明,葡萄糖浓度越高,参与反应的游离氨基含量越多,即美拉德反应越能高效地发生。此结果与Dong等[1]的结果一致。另外,游离氨基含量的降低与A294和褐变强度的增加(图2)存在正相关性。Zeng等[16]也发现游离氨基基团的损失和褐变程度之间存在相关性。
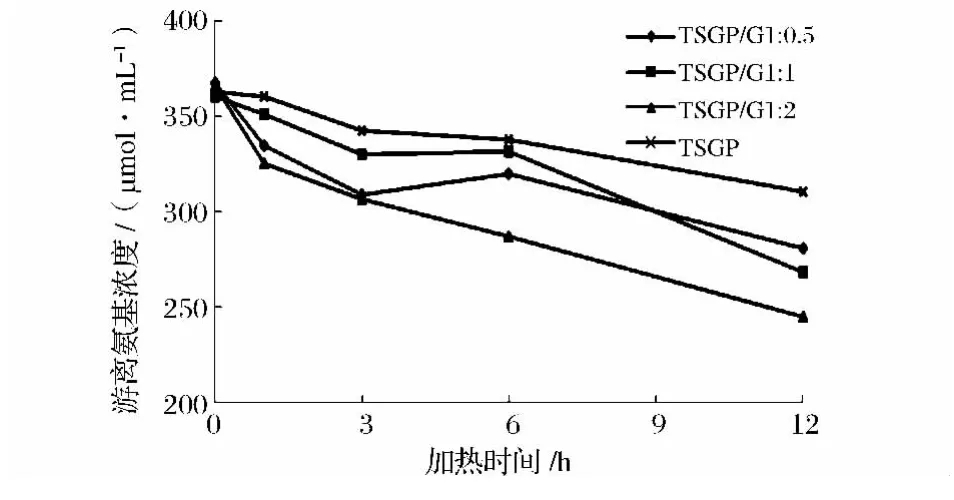
图3 反应体系中游离氨基含量随加热时间的变化Fig.3 Changes in free amino group content of Maillard reaction system as function of heating time
2.4 美拉德反应产物的抗氧化活性
2.4.1 DPPH·清除活性
MRPs对DPPH·的清除活性随加热时间的变化如图4(a)所示。TSGP具有相对较低的DPPH·清除活性,并且不受加热时间的影响(P>0.05)。加热6h内,所有MRPs的DPPH·清除活性均显著增加(P<0.05)。加热至12h 时,TSGP/G 1∶0.5,TSGP/G 1∶1和TSGP/G 1∶2的活性分别达到88.97%,94.61%和95.17%,相当于11.11~11.86 μg/mL的常见抗氧化剂Vc。本研究中,TSGP/G 1:2体系中的 MRPs的DPPH·清除活性在各加热时间点均高于TSGP/G 1∶0.5和TSGP/G 1∶1,这说明,美拉德反应体系中葡萄糖浓度越高,产生的MRPs的自由基清除活性越高。这一结果与王惠英等[8]的结果一致。有学者报道,褐变强度与DPPH·清除活性相关[7]。
2.4.2 羟自由基清除活性
如图4(b)所示,随加热时间和葡萄糖浓度的变化,MRPs的羟自由基清除活性无显著差异(P>0.05)。这一现象可能是由于MRPs的金属螯合活性[17-18]。MRPs的螯合能力取决于其浓度以及体系中的金属,金属浓度越高,MRPs结合位点饱和,从而干预了它进一步的抗氧化能力[19-20]。因此,在羟自由基清除活性中,MRPs的金属螯合能力干预了其羟自由基清除活性。在Vhangani等[10]的研究中,核糖-赖氨酸和果糖-赖氨酸模拟体系MRPs的羟自由基清除活性无显著差异,与本实验结果一致。
2.4.3 ABTS自由基清除活性
由如图4(c)可以看出,所有MRPs的ABTS自由基清除活性均随加热时间的增加而显著增加(P<0.05)。且TSGP/G 1∶2表现最高的清除活性,其次为TSGP/G 1∶1,TSGP/G 1∶0.5 的活性较低,但仍高于单独加热的TSGP对照组的活性。TSGP/G 1∶0.5,TSGP/G 1∶1和 TSGP/G 1∶2加热 12 h 得到的 MRPs的 ABTS自由基活性分别为 148.82,164.32和176.03 μmol/mL Trolox当量。MRPs的ABTS自由基清除活性与DPPH自由基清除活性[图4(a)]表现相似的趋势。Zeng等[16]也发现,MRPs具有ABTS自由基清除活性,且清除活性随反应时间的增加而增加。
2.4.4 还原能力
由图4(d)可知,随着反应时间的增加,各体系MRPs的还原能力也随之增加,TSGP/G 1∶2体系中MRPs的还原能力增强的最为明显,加热至6 h时还原能力已相当于145.03 μg/mL Vc。而对照组TSGP的还原性没有随反应时间的增加而增加。Zeng等[16]也报道,在整个美拉德反应过程中,MRPs的还原能力随反应时间的增加而增加。
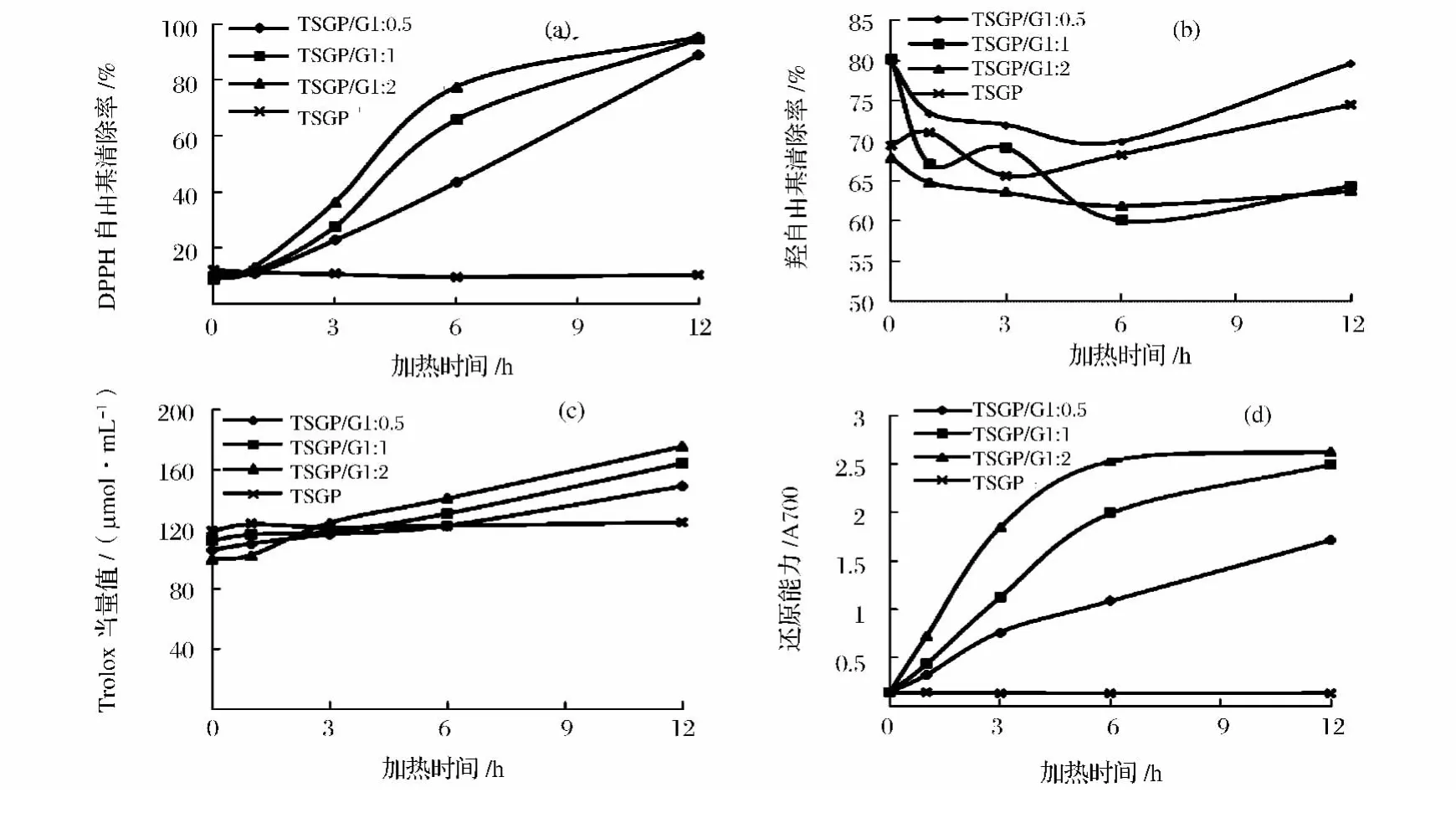
图4 MRPs的DPPH·(a)、OH·(b)和ABTS+·(c)清除活性以及还原能力(d)随加热时间的变化Fig.4 Changs of DPPH radical(a),hydroxyl radical(b)and ABTS radical(c)scavenging activities,and reducing power of MRPs as function of heating time
3 结论
结果表明,罗非鱼鱼皮胶原肽-葡萄糖的美拉德反应是一个酸度和褐变不断增强的反应过程。在相同反应条件下,TSGP/G 1∶2体系美拉德反应产物的褐变强度、荧光强度、自由基清除活性、还原能力均强于 TSGP/G 1∶0.5 和 TSGP/G 1∶1体系的 MRPs。同时,除羟自由基清除活性外,罗非鱼鱼皮胶原肽的美拉德反应产物的抗氧化活性均显著优于胶原肽。
[1] Dong S Y,Wei B B,Chen B C,et al.Chemical and antioxidant properties of casein peptide and its glucose Maillard reaction products in fish oil-in-water emulsions[J].Journal of Agricultural and Food Chemistry,2011,59(24):13 311-13 317.
[2] Liu P,Huang M G,Song S,et al.Sensory characteristics and antioxidant activities of Maillard reaction products from Soy protein hydrolysates with different molecular weight distribution[J].Food and Bioprocess Technology,2012,5(5):1 775-1 789.
[3] Guérard F,Sumaya-Martinez M T.Antioxidant effects of protein hydrolysates in the reaction with glucose[J].Journal of the American Oil Chemists'Society,2003,80(5):467-470.
[4] Zhuang Y L,Sun L P.Preparation of reactive oxygen scavenging peptides from tilapia(Oreochromis niloticus)skin gelatin:optimization using response surface methodology[J].Journal of Food Science,2011,76(3):C483 -C489.
[5] Li X D,Niu Z X,Zhang B L.Various methods available for the determination of hydrolyzed degree of whey protein[J].China Dairy Industry,2006,34(10):59 -62.
[6] 孙丽平,庄永亮,张莉,等.酶解小麦蛋白产物-还原糖美拉德反应的光谱研究[J].分析化学,2009,37(9):1 359-1 362.
[7] Lertittikul W,Benjakul S,Tanaka M.Characteristics and antioxidative activity of Maillard reaction products from a porcine plasma protein-glucose model system as affected by pH[J].Food Chemistry,2007,100(2):669 -677.
[8] 王惠英,孙涛,周冬香,等.L-赖氨酸与D-核糖的模式美拉德反应及其产物抗氧化性能研究[J].食品科学,2008,29(5):112-115.
[9] 王惠英,孙涛,周冬香,等.L-赖氨酸与葡萄糖美拉德反应及其产物的抗氧化性能研究[J].食品与发酵工业,2007,33(9):54-56.
[10] Vhangani L N,Wyk J V.Antioxidant activity of Maillard reaction products(MRPs)derived from fructose-lysine and ribose-lysine model systems[J].Food Chemistry,2013,137(1-4):92-98.
[11] Delgado-Andrade C,Seiquer I,Haro A,et al.Development of the Maillard reaction in foods cooked by different techniques.Intake of Maillard-derived compounds[J].Food Chemistry,2010,122(1):145-153.
[12] 童彦,雒莎莎,应铁进.鱼蛋白水解液美拉德反应条件优化及反应前后氨基酸组成变化[J].中国食品学报,2011,11(8):101-106.
[13] Benjakul S,Lertittikul W,Bauer F.Antioxidant activity of Maillard reaction products from a porcine plasma protein - sugar model system[J].Food Chemistry,2005,93(2):189-196.
[14] Morales F J,Romero C,Jimenez-Perez S.Fluorescence associated with Maillard reaction in milk and milk-resembling system[J].Food Chemistry,1996,57(3):423 -428.
[15] Morales F J,Van Boekel M A J S.A study on advanced Maillard reaction in heated casein-sugar solution:fluorescence accumulation[J].International Dairy Journal,1997,7(11):675-683.
[16] Zeng Y,Zhang X X,Guan Y P,et al.Characteristics and antioxidant activity of Maillard reaction products from psicose-lysine and fructose-lysine model systems[J].Journal of Food Science,2011,76(3):C398-C403.
[17] Hwang I G,Kim H Y,Woo K S,et al.Biological activities of Maillard reaction products(MRPs)in a sugar-amino acid model system[J].Food Chemistry,2011,126(1):221-227.
[18] Laguerre M,Lecomte J,Villeneuve P.Evaluation of the ability of antioxidants to counteract lipid oxidation:Existing methods,new trends and challenges[J].Progress in Lipid Research,2007,46(5):244-282.
[19] Gonzalez-Mateo S,Gonzalez-SanJose M L,Muniz P.Presence of Maillard reaction products in Spanish muffins and evaluation of colour and antioxidant potential[J].Food and Chemical Toxicology,2009,47(11):2 798-2 805.
[20] Maillard M N,Billaud C,Chow Y N,et al.Free radical scavenging of polyphenoloxidase activity and copper chelating properties of model Maillard systems[J].LWT - Food Science and Technology,2007,40(8):1 434-1 444.
