壳聚糖-PE双层抑菌保鲜膜的结构和热稳定性*
2014-05-12鲍慧娟姜燕
鲍慧娟,姜燕
(长春工业大学化学与生命科学学院,吉林 长春,130012)
近年来,具有良好抑菌、可降解和抗氧化等多种功能性质的多层食品保鲜膜备受关注[1-2]。通常多层膜的内层阻气性较好,而外层的机械性能和阻水性佳[3-4]。作者曾采用天然无毒且具有抑菌功能的壳聚糖膜液涂覆于PE膜表面,干燥后制备出一种新型的双层膜——壳聚糖-PE双层抑菌保鲜膜。该膜具有适宜的阻隔性[WVT:(38.45 ±1.3)g/(m2·24);PO2:(6 767.63 ±1.2)cm3/(m2·24h·atm),PCO2:(9 183.10 ±41.2)cm3/(m2·24h·atm)],良好的降解性、抑菌效果和抗氧化性,可有效延长肉类的货架期。
有关壳聚糖膜的热降解性和热稳定性能[5-6],聚乙烯(PE)及由其组成的化合物热稳定性[7]的研究较多。对于单独的壳聚糖膜热失重分为2个阶段:第1阶段在60℃失重10%左右,为失水阶段;第2阶段从240~380℃,失重量可达41.4%,为壳聚糖的降解阶段;将壳聚糖在催化剂钛的作用下与PE结合得到PE/壳聚糖复合材料,其熔点、熔融热焓值和结晶度随着壳聚糖含量的增加而下降[8]。但对于壳聚糖-PE双层抑菌保鲜膜的结构和热稳定性的研究却鲜有报道。为了考察此双层膜的耐热性及其界面结合,本文采用热重分析和示差扫描量热分析法对壳聚糖-PE双层膜的热稳定进行分析,利用红外光谱和扫描电子显微镜观察双层膜的微观结构,以期为壳聚糖-PE双层抑菌保鲜膜的保鲜机理和实际应用提供理论依据。
1 实验部分
1.1 原料与试剂
酸溶性壳聚糖:食品级,平均分子质量为(MW=5.0×105),脱乙酰度为90%,南通兴成生物制品厂;冰乙酸、甘油,西陇化工股份有限公司;Span 40,国药集团化学试剂有限公司;妙洁PE保鲜膜,脱普日用化学品(中国)有限公司;成膜介质使用有机玻璃自制。
1.2 仪器与设备
JJ-2型均质机,常州润华电器有限公司;SHZ-D(Ⅲ)型循环水式真空泵,巩义市予华仪器有限公司;电热恒温鼓风干燥箱,DHG-914385-Ⅲ,上海新苗医疗器械制造有限公司;Pyris 1型热重分析仪(thermogravimetric analyzer,TGA)、DSC 7型示差扫描量热仪(differential scanning calorimeter,DSC)、version BM型红外光谱仪,美国Perkin Elmer股份有限公司;Philips XL 30型扫描电子显微镜,日本电子株式会社。
1.3 实验方法
1.3.1 壳聚糖-PE双层膜的制备
称取0.94 g的壳聚糖溶解于体积分数为0.49%的醋酸溶液中,配制成质量浓度为0.94%的壳聚糖溶液,待壳聚糖完全溶解后,加入1.07 mL甘油作为增塑剂,1.41 g Span 40作为乳化剂,混合均匀,在8 000 r/min条件下均质15 min;均质后的溶液于0.09 MPa下真空脱气10 min,得到壳聚糖膜液;采用流延法将壳聚糖膜液涂覆于铺有PE膜的有机玻璃板上,涂覆量为3~4 mL/cm2;最后将其置于40℃的鼓风干燥箱内干燥8~10 h,干燥结束后,揭膜备用。
1.3.2 差示扫描量热分析(differential scanning calorimetry,DSC)
准确称取10 mg样品,以10℃/min的速率从0℃加热到150℃,恒温1 min,再以10℃/min从150℃冷却到0℃,恒温维持1 min,最后以10℃/min从0℃加热至150℃。
1.3.3 热重分析(thermogravimetric analysis,TGA)
准确称取样品10 mg,采用Pyris 1分析仪测定,升温速度10℃/min,通入N2后温度从50℃加热至700℃,流量为20 mL/min。
1.3.4 红外光谱(infrared spectroscopy,IR)分析
将复合膜裁剪为1cm×1cm的样品,将红外仪器转换到ATR模式,先测量背景单通道光谱,装上样品膜材料,测量样品单通道光谱,扫描波长范围500~4 000 cm-1,分析膜的结构变化。
1.3.5 表面结构分析
将样品于干燥器内放置24 h,保证样品充分干燥,用液氮将样品进行脆断,真空喷金后用扫描电子显微镜(scanning electron microscope,SEM)观察膜的表面或截面形貌并拍照。
2 结果与讨论
2.1 壳聚糖-PE双层膜的热稳定性分析
热稳定性分析有助于更好地了解膜的相关性能,同时它也能检测壳聚糖涂膜液和涂膜技术对PE膜结构的影响,还可以获得关于氢键之间的相互作用、壳聚糖结晶度和稳定性等相关信息[9]。
图1所示曲线分别为PE膜、壳聚糖膜及壳聚糖-PE双层膜的热重曲线图。在氮气作用下,待测试结束时,PE膜、壳聚糖膜和双层膜的失重率分别为99.64%,89.63%和90.67%。在设定的温度范围内(50~700℃),PE膜只有一个失重阶段,发生在490℃,可见PE膜的热稳定性较好;而壳聚糖膜和壳聚糖-PE双层膜均有2个失重阶段,第一阶段壳聚糖膜失重发生在50~200℃,为水蒸气和醋酸等溶剂的挥发,第2阶段壳聚糖膜最大失重出现在330℃左右,壳聚糖分子中存在着羟基,可能发生了热分解反应。据文献报道[10],任一个糖苷键的分解会促使多糖的热分解,而后分解成乙酸、丙酸等一系列低级的小分子脂肪酸,最易分解的碳位于2,3,6位。由热分解曲线可知,壳聚糖-PE双层膜第一阶段失重取决于壳聚糖膜层,而第2阶段的最大失重率发生在450℃左右,与壳聚糖分子和PE膜的热分解协同相关。由残余物的数量来看,壳聚糖-PE双层膜的热稳定性更多取决于壳聚糖膜。因此,我们推断出PE层的稳定性并未受到壳聚糖涂膜层的影响。

图1 薄膜的热重分析曲线图Fig.1 TGA curves of films
为了进一步了解膜的热稳定性,对PE膜、壳聚糖膜和壳聚糖-PE双层膜进行示差扫描量热分析(DSC)测试,结果如图2所示。
到目前为止,对于壳聚糖的玻璃化转变温度一直存在争议,因为壳聚糖是一种具有链状结构、含结晶度和脱乙酰度的高分子聚合物,各种差异导致其玻璃化转变温度不同。El-Hefian EA等[11]也指出壳聚糖的玻璃化转变温度不易测出。在本文的实验条件下也未测出壳聚糖的玻璃态转变温度。另有文献指出不同物质组成不同,其吸热放热的峰值也不同,故可以定性分析混合物各组分是否相容[12]。由图2a可知,当样品加热温度从0℃上升至100℃时,壳聚糖膜在51℃时出现最大吸热峰,峰面积为318.01 mJ;在温度约为51℃,壳聚糖-PE双层膜也出现最大吸收峰,峰面积为237.47 mJ。当样品由高温(100℃)逐渐冷却时,壳聚糖膜和壳聚糖-PE双层膜均出现最大放热峰,峰面积分别为-327.73 mJ和-262.63 mJ(图2b)。图2c、2d表明,当加热至100~120℃时,PE膜才出现相关吸热峰,峰面积为924.79 mJ;同理,当温度降至100℃左右,PE膜出现放热峰,峰面积-819.55 mJ。壳聚糖-PE双层膜吸热与放热峰面积较壳聚糖膜均有所下降,可能与PE膜有关。综上所述,壳聚糖膜并未与PE膜有很好的相容性,壳聚糖-PE膜热稳定性主要取决于壳聚糖膜层,这与上述薄膜的热重分析结果一致。
2.2 壳聚糖-PE双层膜的红外光谱分析
图3和图4分别为PE膜、壳聚糖-PE双层膜(PE面)和壳聚糖膜、壳聚糖-PE双层膜(壳聚糖面)的红外光谱图。图3中PE膜在719 cm-1左右有较强的伸缩振动峰,为—CH2键,有若干小振动峰,可能是因为PE膜中含有一些杂质成分;而壳聚糖-PE双层膜的PE面的红外光谱图的振动峰较PE膜加强,且在2 900~3 000 cm-1处出现一个小振动峰,可能是因为受到壳聚糖分子中C—H键的加强作用。图4所示的壳聚糖膜与壳聚糖-PE双层膜的壳聚糖面的红外光谱图几乎保持一致,分别在800~1 000 cm-1为C—O振动峰,1 650 cm-1为酰胺Ⅰ是羰基(C O)伸缩强峰,1 550 cm-1为酰胺Ⅱ是N—H弯曲吸收峰,2 900 cm-1左右为C—H伸缩键。由红外光谱图分析可知,PE膜涂上壳聚糖复合膜液后并未形成新的化学键。
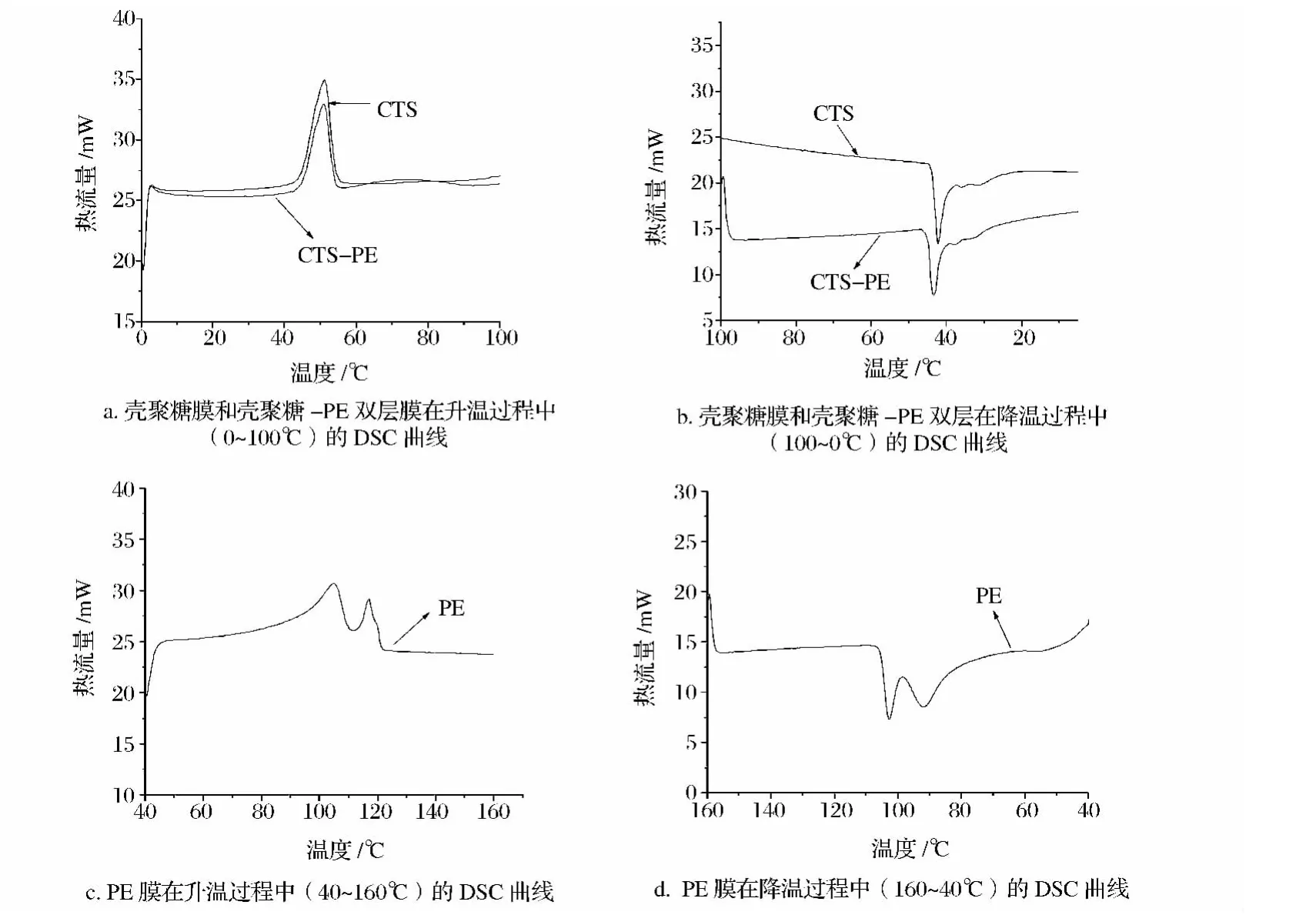
图2 薄膜的DSC图Fig.2 DSC curves of films
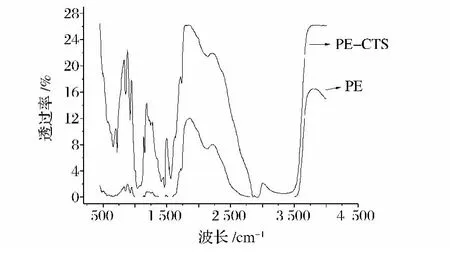
图3 PE膜和壳聚糖-PE双层膜(PE膜层)的红外光谱图Fig.3 FTIR-ATR spectra of polyethylene(PE)film and CTS-PE(the side of PE)bi-layer film
2.3 壳聚糖-PE双层膜的扫描电镜分析
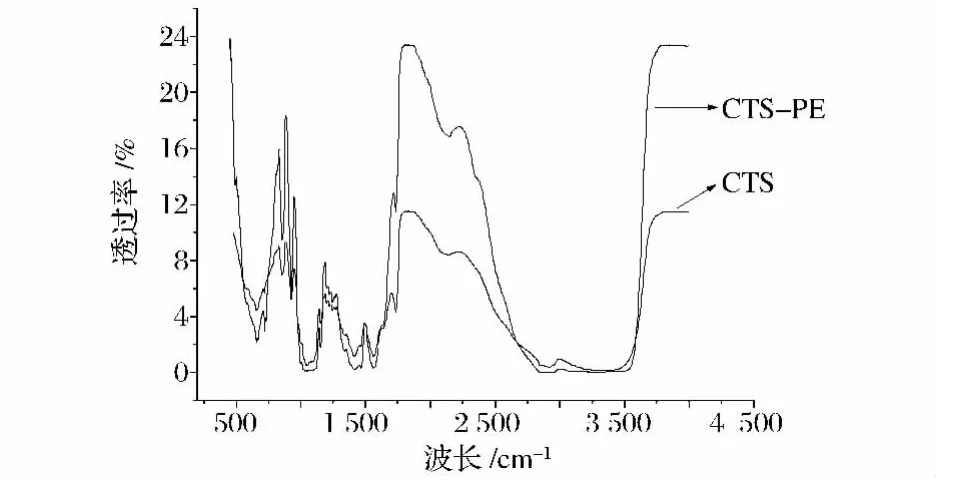
图4 壳聚糖膜和壳聚糖-PE双层膜(壳聚糖膜层)的红外光谱图Fig.4 FTIR-ATR spectra of chitosan film and CTS-PE (the side of chitosan)bi-layer film
壳聚糖-PE膜的各项性能大都取决于成膜时分子状态是否均一,分子之间的作用力的强弱以及大分子物质溶解的状况。通过对薄膜的微观结构和界面结合的分析可以使我们更加合理地解释薄膜宏观性质上的变化。图5a所示单独的PE膜表面光滑;而壳聚糖膜表面(图5b)存在皱褶,是因为在制作过程中,一方面是大分子化合物未能均匀地分散,另一方面是一些很小的气泡未能有效地去除。图5c和图5d为壳聚糖-PE膜横截面的微观结构,双层膜的断截面结构中壳聚糖膜层较粗糙,可以看到高低起伏的突起结构,而PE膜层较平滑,壳聚糖膜与PE膜之间形成较好的界面结合。

图5 薄膜的扫描电镜图Fig.5 Scanning electron micrograph of films
3 结论
当壳聚糖复合膜液涂覆于PE膜时,并未破坏PE膜的结构,也没有与PE膜发生化学反应,产生新的化学键。壳聚糖-PE双层膜的热稳定性主要取决于壳聚糖膜层。扫描电镜表明壳聚糖膜可紧贴于PE膜的表面,形成了较好的界面结合。所制备的壳聚糖-PE双层膜具有良好的抑菌性、降解性及一定的机械强度和阻隔性,将其用于食品保鲜包装中,可延长食品货架期。
[1] Lidija F Z,Tina T,Alenka V,et al.Chitosan coatings onto polyethylene terephthalate for the development of potential active packaging material[J].Applied Surface Science,2013,265(15):697-703.
[2] Jang W S,Rawson I,Grunlan J C.Layer-by-layer assembly of thin film oxygen barrier [J].Thin Solid Films,2008,516(15):4 819-4 825.
[3] Känzig J,Anex R,Jolliet O.Conference report:international workshop on assessing the sustainability of bio-based products[C].The International Journal of Life Cycle Assessment,2003,8(5):313-314.
[4] Patel M,Bastioli C,Marini L,Wurdinger E.In:Steinbuchel A,editor.Biopolymers[M].Weinheim:Wiley-VCH,2002:409-452.
[5] Zohuriaan M J,Shokrolahi F.Thermal studies on natural and modified gums[J].Polym Test,2004,23(5):575-579.
[6] Popelkaa A,Novaka I,Lehocky M,et al.A new route for chitosan immobilization onto polyethylene surface[J].Carbohydrate Polymers,2012,90(2):1 501-1 508.
[7] Kurek M,Klepac D,Scetar M,et al.Gas barrier and morphology characteristics of linear low-density polyethylene and two different polypropylene films[J].Polym Bull,2011,67(7):1 293-1 309.
[8] 李伟,李三喜,龚军,等.聚乙烯/壳聚糖复合材料的研究[J].沈阳化工学院学报,2006,20(4):268-271.
[9] Kurek M,Brachais C H,Nguimjeu C M,et al.Structure and thermal properties of a chitosan coated polyethylene bi-layer film[J].Polymer Degradation and Stability,2012,97(8):1 232-1 240.
[10] Netoa C G T,Giacomettib J A,Job A E,et al.Thermal analysis of chitosan based networks[J].Carbohydrate Polymers,2005,62(2):97-103.
[11] El-Hefian E A,Nasef M M,Yahaya A H,et al.Preparation and characterization of Chitosan/Agar blends:rheological and thermal studies[J].J Chil Chem Soc,2010,55(1):130-136.
[12] 杜易阳,孙庆申,韩德权.壳聚糖淀粉膜的研制及结构性能的分析[J].食品工业科技,2011,32(12):276-279.
