溶解无机碳的拉曼光谱定量分析可行性研究
2014-05-11田陟贤刘昌岭孟庆国
田陟贤,张 鑫,刘昌岭,孟庆国,阎 军
(1.中国科学院海洋研究所,中国科学院海洋地质与环境重点实验室,山东 青岛 266071;2.中国科学院大学,北京 100049;3.青岛海洋地质研究所,国土资源部天然气水合物重点实验室,山东 青岛 266071)
溶解无机碳的拉曼光谱定量分析可行性研究
田陟贤1,2,张 鑫1*,刘昌岭3,孟庆国3,阎 军1
(1.中国科学院海洋研究所,中国科学院海洋地质与环境重点实验室,山东 青岛 266071;2.中国科学院大学,北京 100049;3.青岛海洋地质研究所,国土资源部天然气水合物重点实验室,山东 青岛 266071)
海水溶解无机碳(DIC)的平均浓度约为2.05mmol/L,其中HCO3-占93%, CO32-为6%,CO2和H2CO3共1%.HCO3-的拉曼散射活性太弱,而其他成分的浓度又过低,使得海水中DIC组分不能产生明显的拉曼散射强度,目前还未见有关溶解无机碳拉曼光谱定量分析的报道.为突破这一局限,本研究探索了一种碱化辅助的拉曼定量分析方法,以海水DIC中拉曼活性最低、占比例最大的HCO3-为研究对象进行了可行性实验研究.通过碱化处理(100mL样品中添加NaOH试剂15mg)将HCO-转化为拉曼活性更强的CO2-,有效提高了拉曼光谱系统对HCO-333的检出限(<3mmol/L).定量分析使用内标定法,选取水在~1635cm-1附近的 O—H弯曲振动谱带作为标定物.实验结果显示,该方法对与海水中浓度相当的低浓度HCO3-溶液的定量分析具有良好的精度(相对误差<6.5%).
海水;溶解无机碳;拉曼光谱;定量分析;碳酸氢根
在过去的260余年,由于人类对化石燃料和森林资源的过度消耗,大气中二氧化碳(CO2)的含量从工业革命前的大约280×10-6(µL/L)增加到现今的 384×10-6,大约增加了 40%[1].这一变化速度比过去数百万年至少要高一个数量级[2],达到了全新世以来的最高值.海洋作为地球表面最大的碳库,不断从大气中吸收 CO2[3],速率高达1×109kg/h[4],大约吸收了人类活动排放 CO2的1/3,缓和了大气CO2浓度增加对气候的影响[4-5].
然而,海洋对CO2的吸收并不是完全无害的,会导致海水的化学平衡失衡和 pH值下降,这种现象已被模式分析以及水文调查资料证实[5-9],被称为海洋酸化或“其他CO2问题”[10-11].从工业革命开始至今,表层海水的平均 pH值从 8.21降至8.10,下降了大约0.1个单位[12].预计在21世纪末,大气中CO2的含量将达到800×10-6,海洋的pH值还将降低0.3~0.4个单位,相当于H+的浓度增加150%,CO32-的浓度降低50%[13].海洋酸化正日益改变着海洋生物赖以生存的化学环境,使海洋生物的代谢过程会受到影响,海洋生态的稳定性发生变化,对海洋生态系统有着深远的影响[14-17].
因此,了解海洋对大气 CO2增加的响应,研究CO2在海洋中的转移和归宿、海洋吸收转移大气中CO2的能力以及CO2在海洋中的循环机制等已经成为当今国际海洋科学研究的前沿领域.海水中溶解无机碳(DIC)是海洋CO2系统的重要参数,它是海水中各种无机碳酸盐,碳酸氢盐、碳酸及CO2气体的浓度总和.准确、快速、方便地测定出海水中溶解无机碳含量和存在形式,对于了解海洋对CO2的吸收、转化和迁移过程,进而了解全球气候变化和全球碳循环都具有重要意义.海洋DIC的测量最早开始于19世纪初[18],到20世纪中叶,尤其是在地化剖面(GEOSECS, 1973~1979)[19-20]以及海洋瞬时示踪剂研究计划(TTO, 1981~1983)[21]出现之后开始变得更为广泛.
目前已有多种方法可对海洋溶解无机碳进行分析[22],但这些方法的非原位性使得它们均无法避免样品理化环境变化带来的不确定性,因此,建立海洋中溶解无机碳的原位测定方法成为亟待解决的问题.激光拉曼光谱技术由于其具有原位、实时、非接触探测以及多组分同时测试等优点,在水下环境尤其是在深海极端环境下的海洋中地化参数探测上得到了广泛应用[23],但目前有关其在海洋溶解无机碳探测中应用的报道较少.海洋中溶解无机碳的平均浓度约为 2.05mmol/ L[12],从比例上来讲,碳酸氢根离子(HCO3-)占93%,碳酸根离子(CO32-)占6%,CO2和H2CO3占总体的1%.HCO3-的拉曼散射活性太弱,而其他成分的含量又过低,使得海水溶解无机碳成分不能产生明显的拉曼散射强度.为解决这一局限,本研究以海水溶解无机碳中拉曼活性最低、占比例最大的HCO3-为研究对象,探索了一种碱化法辅助的低浓度HCO3-拉曼定量分析技术.
1 实验部分
1.1 仪器与试剂
激光拉曼光谱系统:美国凯泽光学系统公司(KOSI)生产的 RamanRXN1,该光学系统由光谱仪、发射波长为 532nm的 Nd:YAG激光器(100mW,波谱范围 100~4350cm-1)、前照式冷却CCD传感器(像素2048×512)、光纤、光学探头组成.其中光学探头为KOSI公司的Mark II全息光学探头(NCO-1.3-VIS),焦距 4mm(空气中),可在0~40℃插入液体内直接进行探测,通过光纤与主机联接.
Na2CO3,NaHCO3,NaOH(国药集团化学试剂有限公司)均为分析纯(AR)试剂.实验测试的溶液均采用试剂与二次去离子水(>18MΩ)配置.
1.2 拉曼光谱定量分析原理
不同物质拉曼散射效率不同以及测试条件对拉曼散射强度的影响,使得拉曼散射不能直接与浓度或丰度相关联,拉曼光谱技术在定量分析方面长期被认为是不可行的.Wopenka等[24]的拉曼强度归一化理论奠定了基于强度比值的拉曼光谱定量分析理论基础,使拉曼光谱分析向定量化发展.拉曼散射强度I可以简化定义为:
式中:IL为激光强度;K为比例系数;σ为拉曼散射截面;N为分子数.分析对象产生的拉曼散射强度似乎与浓度呈线性关系,但拉曼散射强度还决定于测试条件(激发光强度,设备的光学配置及样品校准等),因而并不能与测试对象的浓度直接关联,必须对测试条件的影响予以消除,拉曼光谱归一化(相对强度)是最有效的方法:

式中:下标R表示参考系,其拉曼光谱须在与样品相同的条件下测得.拉曼定量分析可以表示为:

式中:σR/σ可视为常数,以相同参照系为标准,相对拉曼强度I/IR就可用来定量分析测试对象的浓度.目前,拉曼定量分析均是基于相对强度的,包括内标法和外标法.外标法对拉曼信号的校正需连续收集样品及对应标定物的拉曼光谱,收集过程的非同步性使得收集条件必然存在差异.内标法使用的标定物则存在于样品内部,同步采集到的是相同条件下样品与内标物拉曼信号的混合,所以比外标法更适合用来校正拉曼强度.由于向系统中加入标定物繁琐且会改变研究对象的理化性质,所以,将样品内部物质用作标定物更合适.
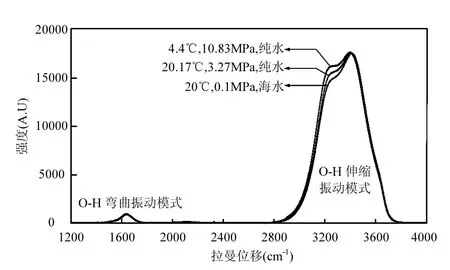
图1 不同条件下水的O—H拉曼弯曲振动峰与伸缩振动峰变化情况对比Fig.1 Contrast of Raman OH bending and stretching vibration bands under different conditions
对于溶液系统,由于溶剂的分子数远大于溶质分子数而可将其视为恒定,因此,将溶剂选作参照系是非常合理的.单独的水分子有 3种振动模式且均具有拉曼活性:2个对称振动模式(位于3657.05cm-1附近的对称伸缩振动模式 υ1,位于1595cm-1的对称弯曲振动模式υ2),1个反对称振动模式(位于3755.97cm-1的υ3)[25].液态水中氢键的相互作用使得 O—H谱带拓宽并移向低波数,使得 υ2(弯曲振动模式)在 1635cm-1附近形成液态水的弯曲振动谱带,υ1、υ3(伸缩振动模式)形成的伸缩振动谱带位于 2750~3900cm-1(图 1).由于O—H伸缩振动谱带是多种模式叠加后的集成谱峰,易受盐分含量和温度的影响,谱峰形状和强度不稳定;而O—H弯曲振动谱带对温压和盐分条件的变化不敏感(图1),故本研究选择液态水在~1635cm-1附近的O—H弯曲振动谱带作为定量分析的内标物.
1.3 测试原理
CO32-和HCO3-都具有拉曼活性(振动频移位置如表1).其中,CO32-在水溶液中的CO对称伸缩振动模式位于1066cm-1,HCO3-在1016 cm-1具有较强的C—OH伸缩模式,在1364cm-1有稍弱的C—O伸缩模式.但是,等浓度的HCO3-比CO32-所产生的拉曼信号强度弱得多(图2).注意到HCO3-在酸性环境下可以生成具对称结构的CO2分子:
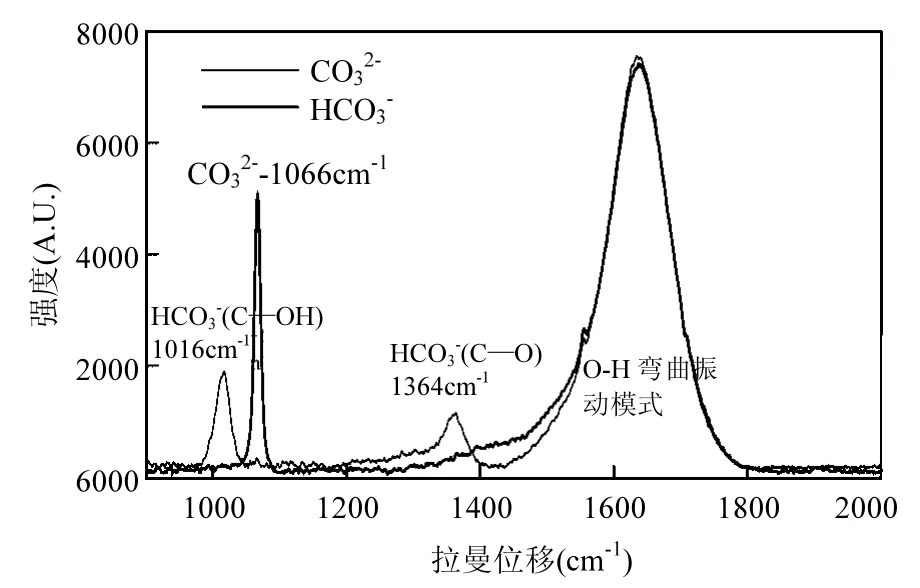
图2 Na2CO3、NaHCO3溶液拉曼光谱曲线:50mmol/L,常温,常压Fig.2 Raman spectra of Na2CO3and NaHCO3aqueous solutions at 50mmol/L under normal temperature and pressure
可产生较强的拉曼信号.但是,由于向样品中注入酸液会导致溶液体积变化,对定量分析造成不便,而HCO3-与碱反应生成CO32-:

向待测样品中加入适量氢氧化钠粉末,同样可以达到将待测物转化为具更强拉曼活性的物质的目的,并且由于该反应生成的水很少,可以认为溶液的体积不变,更有利于定量分析.
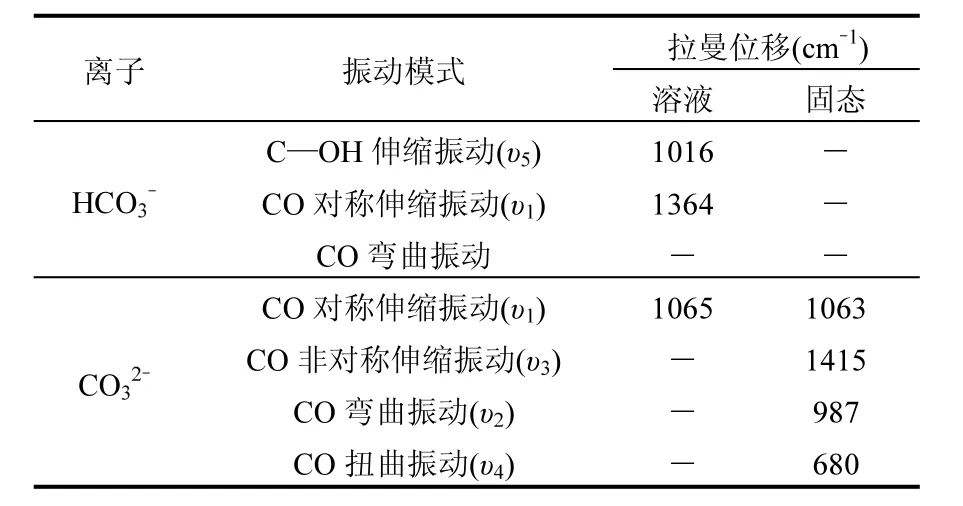
表1 CO32-和HCO3-的振动模式及拉曼峰位移Table 1 Interested Raman spectroscopic information of CO2-and HCO-33
2 测试方法
为检验本研究所用的拉曼光谱系统对碳酸氢根直接检测的能力,配制了浓度分别为1,2,3mmol/L的低浓度NaHCO3溶液.对样品溶液采取暗罩遮光保护以隔绝环境光的影响,将光学探头浸入到溶液中进行拉曼光谱探测,拉曼光谱的单光谱采集时间为600s,各浓度分别作10次光谱数据采集并累加平均,光谱处理软件采用GRAMS/AI®(下同).
对上述 1,2,3mmol/L的 NaHCO3溶液各取100mL并分别加入 15mg(均为轻微过量)的NaOH试剂,以达到使溶液碱化从而将 HCO3-转化为 CO32-的目的,5min(反应充分进行)后,再次对溶液进行拉曼探测.
为实现对碱化后的溶液进行定量分析,实验采用无水Na2CO3配制不同CO32-浓度(5,10,15,20, 30,40,50,70,100,150mmol/L,均未饱和)的水溶液,对这些溶液进行拉曼光谱探测并获取定标曲线.
3 结果分析
3.1 低浓度碳酸氢钠溶液的拉曼光谱
由图3可见,1,2,3mol/L NaHCO3溶液的拉曼光谱重叠率很高难以分辨.并且在各光谱曲线的1016cm-1、1364cm-1处均未出现HCO3-的拉曼光谱特征峰.这表明使用本实验用到的拉曼光谱系统(RamanRXN1)对 HCO3-溶液的检出限大于3mmol/L,即对与海水浓度相当的低浓度的HCO3-溶液进行直接拉曼探测是不可行的.
3.2 碱化处理后低浓度碳酸氢钠溶液的拉曼光谱
图4为碱化处理(加入轻微过量的NaOH试剂)后的低浓度NaHCO3溶液拉曼光谱曲线,在各光谱曲线的1016cm-1、1364cm-1处仍无碳酸氢根的拉曼光谱特征峰出现,但可以直观地观察到位于 1065cm-1的 CO32-特征拉曼谱峰,这说明对溶液进行碱化处理后达到了将待测对象(HCO3-)转化为拉曼活性更强的物质(CO32-)的目的.而且,根据对经碱化处理的溶液探测获得的拉曼光谱曲线及数据(表2)观察可以发现,碳酸根CO对称伸缩振动(υ1)谱峰的强度是随浓度的增加而增强的,这就定性地证明了溶液碱化辅助的低浓度HCO3-的拉曼定量分析是可行的.
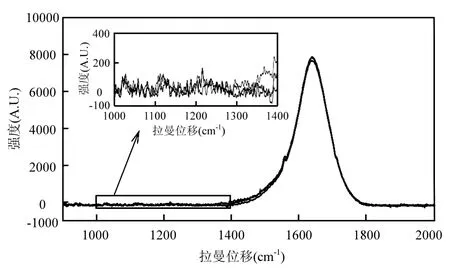
图3 低浓度NaHCO3溶液的拉曼光谱Fig.3 Raman spectra of aqueous NaHCO3solutions at 1,2,3mol/L
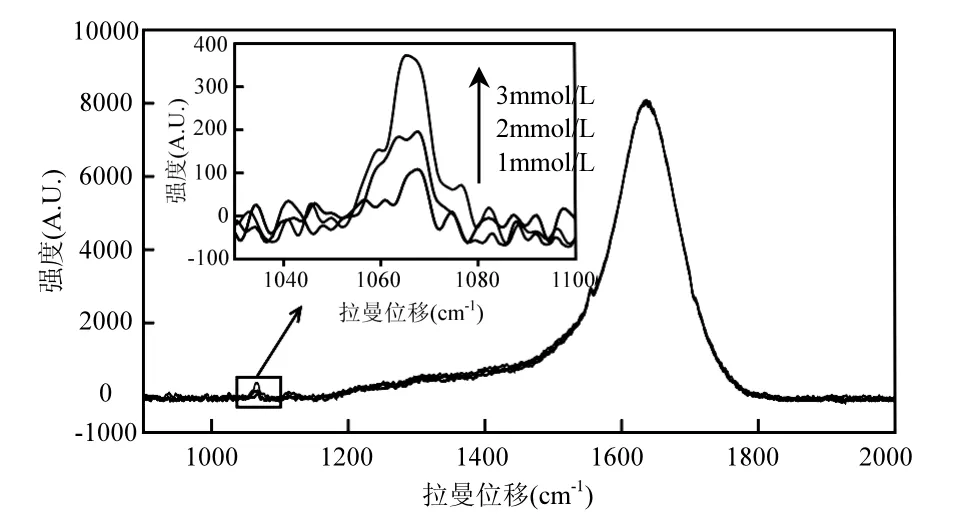
图4 碱化处理后的低浓度NaHCO3溶液拉曼光谱Fig.4 Raman spectra of aqueous NaHCO3solutions at low concentrations after alkalization
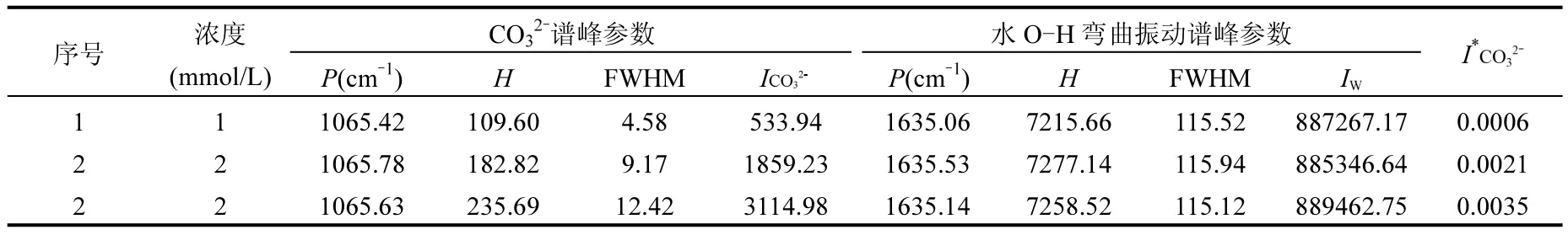
表2 碱化处理后的低浓度NaHCO3溶液的拉曼光谱数据Table 2 Raman spectra parameters of NaHCO3solutions at low concentrations after alkalization
3.3 CO32-拉曼定量分析与HCO3-浓度反演
图 5(a)为探测到的定标溶液(Na2CO3溶液)的拉曼光谱,在1065cm-1附近可观察到明显的特征峰,并且谱峰高度、半高宽和面积随碳酸根离子浓度增加而变大.表 3为探测获得的不同浓度CO32-溶液的拉曼光谱数据,根据拉曼光谱内标定原理,对 CO32-溶液浓度(mmol/L)与标准化拉曼光谱强度 I*CO32-用数据分析软件进行二次多项式拟合,回归曲线如图5(b),函数关系如下:

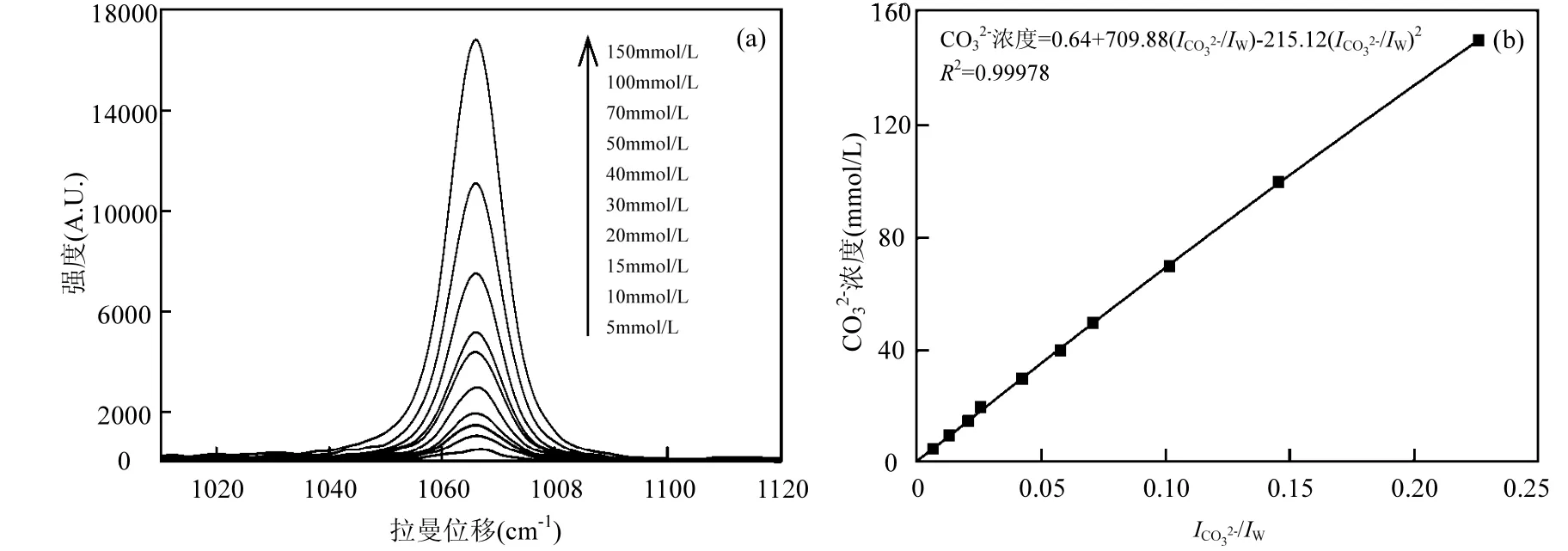
图5 不同浓度CO32-的拉曼光谱曲线(a)及浓度与拉曼光谱标准化强度的关系(b)Fig.5 Raman spectra of aqueous CO32-solutions at different concentrations (a) and the depend ence of CO32-molarity on the standardized Raman spectral intensity (b)

表3 不同浓度Na2CO3水溶液的拉曼光谱数据Table 3 Raman spectra parameters of aqueous Na2CO3solutions at different concentrations
由图 5(b)和式(6)可知,基于内标定法的拉曼光谱定量分析技术对水溶液中CO32-浓度分析具有良好的精度,回归曲线的相关系数 R2为0.99978,证明拉曼光谱技术对于水溶液中碳酸根离子浓度的定量分析具有很高的精确度.使用式(6)对采集到的碱化的低浓度碳酸氢钠溶液中碳酸根离子的标准化强度数据进行计算,得到拉曼定量分析的低浓度的碳酸氢钠溶液浓度如表 4,所得浓度的相对误差<6.5%,这一结果证明通过对溶液进行碱化处理后拉曼定量分析是可行的.
同时,海水中存在较多的Ca2+、Mg2+(平均浓度分别为53.25,10.27mmol/L),二者与CO32-生成CaCO3、MgCO3的溶解度分别为1.3,0.93mmol/L.所以,在真实海水溶解无机碳测定时,还需要预先对进样添加适量硅酸钠(Na2SiO3)使 Ca2+沉淀析出,Mg2+则在样品碱化处理时生成Mg(OH)2沉淀.对于如何进一步提高测试精度,以及本研究在海水中溶解无机碳(DIC)的定量分析实际应用的相关问题(进样及试剂添加装置的研制)将是下一步研究的方向.
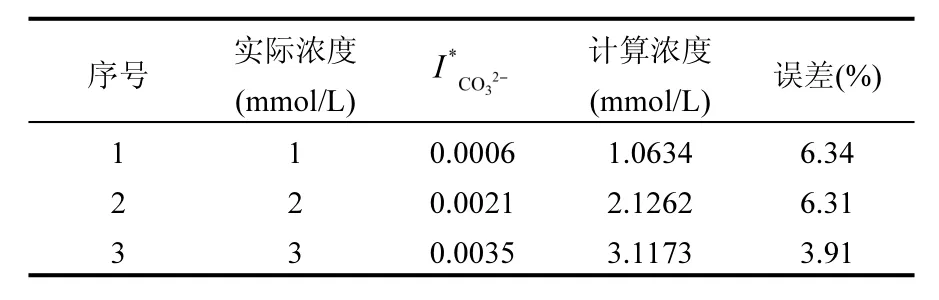
表4 HCO3-浓度反演计算值及其相对误差Table 4 Calculated HCO3-concentrations and the relative errors
4 结论
4.1 提出了一种样品碱化辅助的拉曼定量分析方法,并以海水溶解无机碳中拉曼活性最低、占比例最大的 HCO3-为研究对象进行了可行性实验研究与分析.通过碱化处理将溶液中的 HCO-3转化为拉曼散射活性更强的 CO32-,有效提高了拉曼光谱系统对 HCO3-的检出限.定量分析使用内标定法,选取水在~1635cm-1附近的O-H弯曲振动谱带作为定量分析的标定物.
4.2 结果显示,该方法对与海水中浓度相当的低浓度 HCO3-溶液的定量分析具有良好的精度(相对误差<6.5%).
[1] Doney S C, Fabry V J, Feely R A, et al. Ocean acidification: The other CO2problem [J]. Marine Science, 2009,1.
[2] Doney S C, Schimel D S. Carbon and climate system coupling on timescales from the precambrian to the anthropocene [J]. Annu. Rev. Environ. Resour., 2007,32:31-66.
[3] 石 强,杨东方.渤海夏季海水pH值年际时空变化 [J]. 中国环境科学, 2011,31(S1):58-68.
[4] Sabine C L, Feely R A, Gruber N, et al. The oceanic sink for anthropogenic CO2[J]. science, 2004,305(5682):367-371.
[5] Sabine C L, Feely R A. The Oceanic Sink for Carbon Dioxide [J]. Greenhouse Gas Sinks, 2007,31.
[6] Lauvset S K, Gruber N. Longterm trends in surface ocean pH in the North. Aelantic [J]. Marine Chemistry, 2014,162(3):71-76.
[7] Feely R A, Orr J, Fabry V J, et al. Present and future changes in seawater chemistry due to ocean acidification [J]. Carbon Sequestration and Its Role in the Global Carbon Cycle, 2008,175-188.
[8] Feely R A, Sabine C L, Hernandez-Ayon JM, et al. Evidence for upwelling of corrosive "acidified" water onto the continental shelf [J]. Science, 2008, 320(5882):1490-1492.
[9] Solomon S. Climate change 2007: contribution of working group I to the fourth assessment report of the intergovernmental panel on climate change [M]. Cambridge University Press, 2007.
[10] Henderson C. Ocean acidification: the other CO2problem [J]. New Scientist com news service, 2006,5.
[11] 陈文颖,吴宗鑫.气候变化的历史责任与碳排放限额分配 [J].中国环境科学, 1998,18(6):2-6.
[12] Raven J, Caldeira K, Elderfield H, et al. Ocean acidification due to increasing atmospheric carbon dioxide [M]. The Royal Society, 2005.
[13] Orr J C, Fabry V J, Aumont O, et al. Anthropogenic ocean acidification over the twenty-first century and its impact on calcifying organisms [J]. Nature, 2005, 437(7059): 681-686.
[14] 唐启升,陈镇东,余克服,等.海洋酸化及其与海洋生物及生态系统的关系 [J]. 科学通报, 2013,14:1307-1314.
[15] 杨 波,储昭升,金相灿,等. CO2/pH对三种藻生长及光合作用的影响 [J]. 中国环境科学, 2007,27(1):54-57.
[16] 张 静,张振克,张云峰.海洋酸化及其对海洋生态系统的影响[J]. 海洋地质前沿, 2012,28(2):1-9.
[17] 贺仕昌,张远辉,陈立奇,等.海洋酸化研究进展 [J]. 海洋科学, 2014,38(6):85-93.
[18] Krogh A. On the tension of carbonic acid in natural waters and especially in the sea [J]. 1904.
[19] Craig H, Turekian K. The GEOSECS program: 1973–1976 [J]. Earth and Planetary Science Letters, 1976,32(2):217-219.
[20] Craig H, Turekian K. The GEOSECS program: 1976–1979 [J]. Earth and Planetary Science Letters, 1980,49(2):263-265.
[21] Brewer PG, Sarmiento JL, Smethie WM. The Transient Tracers in the Ocean (TTO) program: the North Atlantic study, 1981; the tropical Atlantic study, 1983 [J]. Journal of Geophysical Research: Oceans (1978–2012), 1985, 90(C4): 6903-6905.
[22] 姬泓巍, 徐 环,辛惠蓁,等.海水中溶解无机碳DIC的分析方法[J]. 海洋湖沼通报, 2002,04:16-24.
[23] Zhang X, Kirkwood WJ, Walz PM, et al. A review of advances in deep-ocean Raman spectroscopy [J]. Applied spectroscopy, 2012, 66(3):237-249.
[24] Wopenka B, Pasteris J D. Raman intensities and detection limits of geochemically relevant gas mixtures for a laser Raman microprobe [J]. Analytical Chemistry, 1987,59(17):2165-2170.
[25] Sun Q. The Raman OH stretching bands of liquid water [J]. Vibrational Spectroscopy, 2009,51(2):213-217.
Feasibility investigation of quantitative analysis of dissolved inorganic carbon by Raman spectrometry.
TIAN Zhi-xian1,2, ZHANG Xin1, LIU Chang-ling3, MENG Qing-guo3, YAN Jun1
(1.Key Laboratory of Marine Geology and Environment, Institute of Oceanology, Chinese Academy of Sciences, Qingdao 266071, China;2.University of Chinese Academy of Sciences, Beijing 100049, China;3.Key Laboratory of Gas Hydrate, Ministry of Land and Resources, Qingdao Institute of Marine Geology, Qingdao 266071, China). China Environmental Science, 2014,34(10):2631~2636
The mean concentration of dissolved inorganic carbon(DIC) in seawater is about 2.05mmol/L. Approximately 93% of DIC is HCO3-, 6% is CO32-, and only 1% is CO2and H2CO3. Since Raman activity of HCO3-is weak and the concentration of other species is low, it is impossible for DIC in seawater to generate Raman scattering that is intense enough to be detected. There is no report on quantitative analysis of DIC in seawater using Laser Raman Spectrometry so far. In order to break through the limitation, a Raman spectroscopy quantitative analysis method assisted with sample alkalization was proposed. HCO3-was treated as study object because it takes the largest share and the Raman activity of it was the weakest among all DIC species. The solution was alkalized to convert HCO3-into CO32-which was more Raman active. OH bending band of water was treated as the internal standard for its stability. The Raman spectroscopy analysis detecting limit of HCO3-was increased, and the quantitative analysis result showed good accuracy (relative error<6.5%).
t:sea water;dissolved inorganic carbon (DIC);Raman spectroscopy;quantitative analysis;bicarbonate
X145
:A
:1000-6923(2014)10-2631-06
田陟贤(1987-),男,山东菏泽人,中国科学院海洋研究所博士研究生,主要从事海洋地质研究.
2013-12-11
国家自然科学基金项目(41006059);中国科学院战略性先导科技专项(XDA11040301)
* 责任作者, 副研究员, xzhang@qdio.ac.cn
