菊芋试管苗的初代培养及愈伤组织不定芽诱导
2014-05-11严德凯刘兆普隆小华
严德凯,刘兆普,隆小华
(南京农业大学资源与环境科学学院江苏省海洋生物学重点实验室,江苏南京210095)
菊芋试管苗的初代培养及愈伤组织不定芽诱导
严德凯,刘兆普,隆小华①
(南京农业大学资源与环境科学学院江苏省海洋生物学重点实验室,江苏南京210095)
菊芋(Helianthus tuberosus Linn.)为菊科(Asteraceae)向日葵属(Helianthus Linn.)多年生草本植物,耐寒、耐旱、耐贫瘠、耐盐碱[1];其地下块茎富含菊糖,还可通过发酵生产乙醇,在功能性食用多糖及生物能源方面的开发潜力巨大。菊芋主要通过块茎进行无性繁殖,其种子成活率和发芽率均很低[2],严重阻碍了菊芋的杂交育种。近年来以植物组织培养为基础的一系列现代育种技术为菊芋的种质改良提供了新途径,但由于菊芋的愈伤组织难以诱导不定芽或体胚发生,导致以农杆菌转化为主的转基因育种技术的应用受到限制。因此,建立高效稳定的组织培养再生体系是菊芋分子育种工作的关键。
作者以耐盐、耐涝且高产的菊芋品种‘南芋9号’(‘Nanyu 9’)为实验材料,研究其试管苗初代培养条件并比较不同外植体愈伤组织不定芽发生的差异,以期为建立高效稳定的菊芋组织培养再生体系提供实验依据和参考。
1 材料和方法
1.1 材料
供试菊芋品种‘南芋9号’种子和块茎均由南京农业大学海岸带资源实验室提供,均采自江苏省盐城市大丰市金海农场。种子于2012年9月至11月采集,置于4℃冰箱干燥保存;块茎于2012年11月收获,置于4℃冰箱春化3个月以上。
1.2 方法
1.2.1 无菌试管苗培养 在温室中通过沙培方法获得菊芋块茎无性繁殖幼苗,当苗高5~10 cm时剪取茎尖和带腋芽的茎段,流水冲洗1 h,在超净工作台上依次用体积分数70%乙醇消毒30~60 s、质量体积分数4%NaClO溶液消毒5~10 min,无菌水冲洗5~6遍;用无菌滤纸吸干水分,茎段切成长0.5~1.0 cm,将茎尖和带腋芽的茎段形态学下端朝下分别接种到添加0.00、0.05和0.10 mg·L-1NAA以及0.00、0.25和0.50 mg·L-16-BA的MS初代培养基(pH 5.6~pH 5.8)中,共9种激素组合。每瓶接种4个外植体,置于温度25℃、光照度1 500~1 800 lx、光照时间16 h·d-1的光照培养箱中培养,3~4周后观察并记录外植体发芽状况。每种培养基接种30个外植体,每组实验重复3次。
以生长健壮、无玻璃化的再生苗的茎尖和带腋芽茎段为外植体,接种到MS培养基上进行继代增殖培养,获得无菌试管苗。
外植体的发芽百分率、玻璃化苗百分率和正常苗百分率的计算公式分别为:发芽百分率=(发芽外植体数/接种外植体总数)×100%;玻璃化苗百分率=(发生玻璃化的试管苗数/萌发的试管苗总数)×100%;正常苗百分率=(正常的试管苗数/接种的外植体总数)×100%。
1.2.2 种子萌发培养 将菊芋种子去壳,置于超净工作台内,先用无菌水振荡冲洗2遍,依次用体积分数70%乙醇消毒10~30 s、质量体积分数4%NaClO溶液消毒5~10 min,无菌水冲洗5~6遍;用无菌滤纸吸干水分,将种子接种到MS培养基上,每瓶接种16~23粒种子,每次接种至少100粒种子,置于温度25℃条件下暗培养2~3 d,然后转至光照度1 500~1 800 lx、光照时间16 h·d-1的条件下培养1~2 d,获得无菌的菊芋幼苗。
1.2.3 愈伤组织诱导和不定芽发生 参照文献[3]以及作者前期实验结果配制愈伤组织诱导培养基:改良MS培养基(含200 mg·L-1肌醇、80 g·L-1蔗糖、8 g·L-1琼脂和500 mg·L-1水解酪蛋白),添加0.05 mg·L-1NAA和0.06 mg·L-16-BA (pH 5.6~pH 5.8)。
按照如下方法获取不同的外植体:菊芋块茎洗净并去皮,切成边长1~2 cm方块,置于超净工作台内,先用无菌水振荡冲洗2遍,然后依次用体积分数70%乙醇消毒30~60 s、质量体积分数4%NaClO溶液消毒10~15 min,无菌水冲洗5~6遍,无菌滤纸吸干水分,切掉表面坏死组织,切成面积0.5 cm× 0.5 cm、厚1~2 mm的小块;取上述无菌试管苗的叶片,切成面积0.5 cm×0.5 cm的小片;取上述无菌试管苗的不带腋芽和茎尖的茎段,切成长0.3~0.5 cm小段;取上述经种子萌发获得的无菌幼苗,切下子叶并去掉叶尖部分。将茎段以及块茎切片水平接种至诱导培养基上、叶片和子叶正面朝上接种至诱导培养基上,置于温度25℃条件下暗培养3~4周,观察愈伤组织诱导和不定芽发生状况;之后转移到光照度1 500~1 800 lx、光照时间16 h·d-1条件下继续培养2~4周;每种外植体接种约20个,实验重复2次。观察愈伤组织诱导状况并统计不定芽诱导率,其计算公式为:不定芽诱导率=(形成不定芽的外植体数/接种的外植体总数)×100%。
1.3 数据处理
应用SPSS 10.0统计分析软件对实验数据进行统计分析,并采用Duncan’s新复极差法进行差异显著性分析。
2 结果和分析
2.1 在添加不同激素配比的培养基中菊芋无菌试管苗初代培养结果比较
在添加不同质量浓度NAA和6-BA的培养基上菊芋无菌试管苗的培养结果见表1。由表1可见:在9种培养基上菊芋外植体的发芽百分率均较高,均在60%以上。但试管苗都出现不同程度的玻璃化现象,同时外植体上生成大块的非胚性愈伤组织(图1-A),这种非胚性愈伤组织生长速度快,体积较大,含水量高,多呈透明或淡黄色半透明状,无再分化能力。除C1培养基(不添加NAA和6-BA)外,其他8种培养基的玻璃化苗百分率均在80%以上。总体上看,C1培养基的培养效果最好,试管苗的发芽百分率为95.81%、玻璃化苗百分率为68.32%、正常苗百分率为30.18%。
2.2 菊芋不同外植体的愈伤组织和不定芽诱导结果比较
研究结果表明:以菊芋块茎、试管苗叶片、不带腋芽和茎尖的茎段以及子叶作为外植体,接种至诱导培养基上均可形成愈伤组织,并生成不定根。其中,由块茎诱导形成的愈伤组织为白色、结构致密,表面有少量不定根;叶片、不带腋芽和茎尖的茎段以及子叶形成的愈伤组织类似,均在切口处形成白色或淡黄色的半透明或不透明的愈伤组织,并生成较多的不定根。在菊芋4种外植体诱导形成的愈伤组织中,仅子叶的愈伤组织可以进一步分化生成不定芽(图1-B),其中少数愈伤组织通过体胚途径分化形成体胚(图1-C);在光照条件下不定芽转绿(图1-D)并伸长生长,但不定芽的诱导百分率仅有14.3%。
表1 在添加不同质量浓度NAA和6-BA的培养基中菊芋试管苗的初代培养结果比较(SD)1)Table1 Comparison on primary culture result of Helianthus tuberosus Linn.plantlet on media added with different mass concentrations of NAA and 6-BA(SD)1)
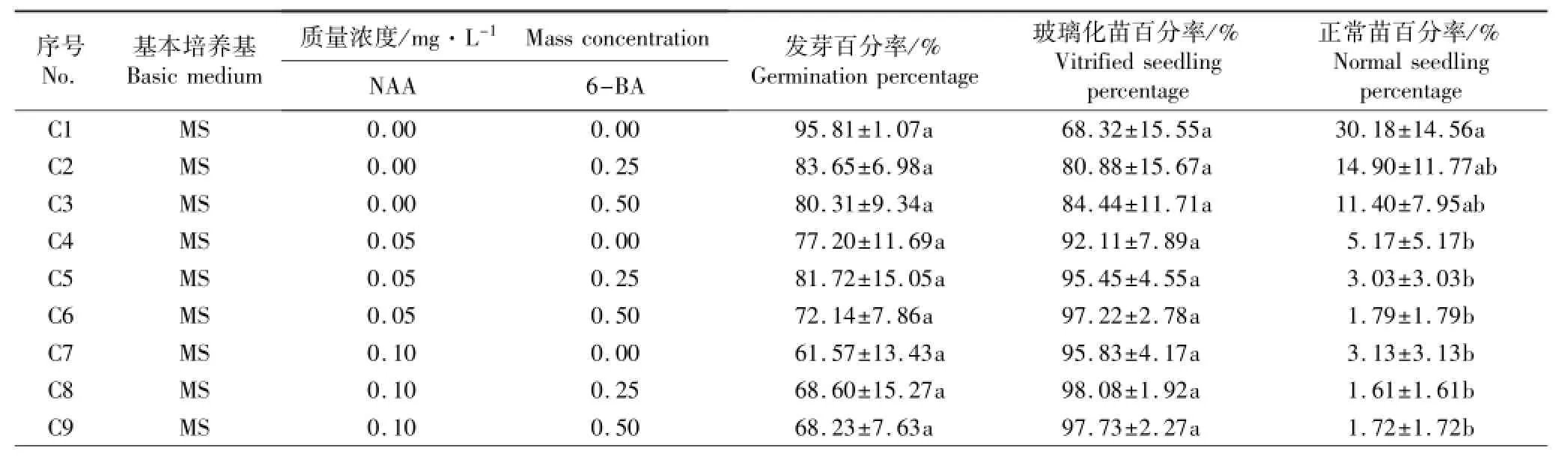
表1 在添加不同质量浓度NAA和6-BA的培养基中菊芋试管苗的初代培养结果比较(SD)1)Table1 Comparison on primary culture result of Helianthus tuberosus Linn.plantlet on media added with different mass concentrations of NAA and 6-BA(SD)1)
1)同列中不同的小写字母表示在0.05水平上差异显著Different small letters in the same column indicate the significant difference at 0.05 level.
?

图1 菊芋试管苗初代培养及其子叶愈伤组织诱导过程中外植体形态的变化Fig.1 Primary culture of Helianthus tuberosus Linn.plantlet and explant morphology change during induction process of cotyledon callus
3 讨 论
菊芋是愈伤组织难再生的植物之一[4],其同属植物向日葵(Helianthus annuus Linn.)在组织培养过程中也有类似的问题。有关向日葵组织培养研究自20世纪80年代就已开始,但仍然存在植株再生困难和重复性差等问题[5]。刘海臣[6]认为:向日葵的愈伤组织再生受多种因素制约,如基因型、外植体类型、无菌苗日龄和内外源激素等,其中,以子叶、下胚轴、茎尖和未成熟胚作为外植体较易诱导出再生植株。在菊芋的组织培养过程中,目前研究者多以其块茎、茎尖或带腋芽茎段为外植体[7-10],而对菊芋子叶或下胚轴的愈伤组织再生的研究尚不多见。作者选择优良的菊芋栽培品种‘南芋9号’为材料,研究了块茎、试管苗叶片、不带腋芽和茎尖的茎段以及子叶4种外植体的愈伤组织不定芽再生能力,结果表明:由子叶诱导的愈伤组织的不定芽再生能力明显优于块茎、叶片以及不带腋芽和茎尖的茎段,对菊芋组织培养而言是较为理想的外植体类型。但目前不定芽的诱导率较低,仅有14.3%,愈伤组织再生体系也并不完善,均有待进一步的优化。此外,在菊芋的初代培养过程中存在较为严重的玻璃化现象,这一现象在有关菊芋组织培养的文献中未见报道,可能与品种本身的遗传特性以及消毒剂对外植体的伤害有关。总之,菊芋品种‘南芋9号’的组织培养再生体系还需要进一步优化。
[1] 陆 艳,叶慧君,耿守保,等.NaCl胁迫对菊芋幼苗生长和叶片光合作用参数以及体内离子分布的影响[J].植物资源与环境学报,2010,19(2):86-91.
[2] KAYS S J,NOTTINGHAM S F.Biology and Chemistry of Jerusalem Artichoke:Helianthus tuberosus L.[M].Boca Raton:CRC Press, 2007.
[3] FIORE M C,TRABACE T,SUNSERI F.High frequency of plant regeneration in sunflower from cotyledons via somatic embryogenesis [J].Plant Cell Reports,1997,16:295-298.
[4] 陈 军.体外诱变与组织培养在菊芋种质创新中的应用研究[D].武汉:华中农业大学植物科学与技术学院,2009:7-8.
[5] 刘海学,王 罡,季 静,等.向日葵(Helianthus annuus L.)不同外植体组织培养及其再生的研究[J].中国农业科学,2006, 39(11):2208-2213.
[6] 刘海臣.向日葵下胚轴组织培养及其遗传转化的研究[D].长春:长春理工大学生命科学技术学院,2007:3-6.
[7] 王利琳,陈立明.菊芋的组织培养及植株再生[J].植物生理学通讯,1997,33(5):358.
[8] 闫海霞,汪卫星,向素琼,等.菊芋的组织培养与快繁技术研究[J].南方农业,2009,3(2):58-61.
[9] 潘 宇,庞少萍,邹 卓,等.菊芋快速繁殖与植株再生研究[J].西南大学学报:自然科学版,2013,35(12):16-20.
[10] 陆 杰,宋 洋,王 珣,等.菊芋组织培养快繁技术的建立[J].植物生理学通讯,2010,46(5):459-465.
(责任编辑:张明霞)
Primary culture of Helianthus tuberosus plantlet and its adventitious bud induction from callusYAN Dekai,LIU
Zhaopu,LONG Xiaohua①(Key Laboratory of Marine Biology of Jiangsu Province,College of Resources and Environmental Sciences,Nanjing Agricultural University,Nanjing 210095,China),J.Plant Resour.&Environ.2014,23(4):108-110
Effect of NAA and 6-BA with different mass concentrations on primary culture of Helianthus tuberosus‘Nanyu 9’plantlet was researched,and induction result of different explants was compared.The results show that the primary culture result of shoot tip and stem with axillary bud of H.tuberosus on MS medium without adding NAA and 6-BA is the best,and its germination percentage and normal seedling percentage are the highest(95.81%and 30.18%,respectively),and vitrified seedling percentage is the lowest(only 68.32%).Taking tuber,leaf of plantlet,stem without axillary bud and shoot tip and cotyledon of H.tuberosus as explants,callus can be induced on induction medium(improved MS medium added with 0.05 mg·L-1NAA and 0.06 mg·L-16-BA,pH 5.6-pH 5.8),while only callus from cotyledon can form adventitious bud and induction rate of adventitious bud is only 14.3%.
菊芋;试管苗;外植体;组织培养;愈伤组织;不定芽
Helianthus tuberosus Linn.;plantlet;explant;tissue culture;callus;adventitious bud
Q943.1;S632.9
A
1674-7895(2014)04-0108-03
10.3969/j.issn.1674-7895.2014.04.17
2013-12-24
江苏省农业科技自主创新资金项目〔CX(12)1005-1;CX(12)1005-3〕;国家自然科学基金资助项目(31201692);国家“十二五”科技支撑计划项目(2011BAD13B09);中央高校基本科研业务费项目(Y0201100249)
严德凯(1989—),男,山东青岛人,硕士研究生,主要从事耐盐植物快繁和组培方面的研究。
①通信作者E-mail:longxiaohua@njau.edu.cn
