不同采集时间芒萁各部位总黄酮含量的动态变化
2014-05-11陈少美宋飞飞陈艳玉
陈少美,宋飞飞,陈艳玉
(福建生物工程职业技术学院,福建福州350002)
不同采集时间芒萁各部位总黄酮含量的动态变化
陈少美,宋飞飞,陈艳玉
(福建生物工程职业技术学院,福建福州350002)
芒萁〔Dicranopteris pedata(Houtt.)Nakai〕又称铁狼萁,为里白科(Gleicheniaceae)芒萁属(Dicranopteris Bernh.)多年生草本植物,广泛分布于中国长江以南各省区,是常用药用蕨类植物,也是林区酸性土的指示植物[1-2]。黄酮类成分是芒萁的主要药用成分,具有抗菌消炎、抗氧化、降压、清热解毒、防止血管增生和抑制脂肪氧化酶等多种活性[3-7],在治疗冠心病、抗癌防癌和消除自由基等方面[8-11]也有显著功效,具有广阔的应用前景。
芒萁药材质量主要取决于药用部位的总黄酮积累量,而最适采收时间对其总黄酮的积累有直接影响;此外,因药用植物有效成分累积的动态变化与植物各生长发育阶段之间存在必然的内在联系[12],因此,适时适部位采收是影响药用植物产量和质量的重要因素之一[13]。
目前,关于芒萁不同部位总黄酮含量的研究报道并不多见[14],尤其是对不同采集时间芒萁总黄酮含量的变化规律缺乏较系统全面的研究报道。基于此,作者采用紫外分光光度法对不同采集时间芒萁的植株含水量、单株干质量以及各部位的总黄酮含量进行了测定和比较,以期明确芒萁总黄酮含量的时空变化规律,为确定芒萁的合理采集时间和最佳采收部位提供实验依据。
1 材料和方法
1.1 材料
供试芒萁均栽植于福建农林大学菌草资源圃。分别于2012年4月15日、6月1日、7月15日、9月1日、10月15日和12月1日各采集50株生长状况一致的芒萁全株,一部分样株直接用于含水量和单株干质量测定;另一部分样株按根状茎、叶、下部茎和上部茎分开(其中,垂直茎秆即根部至第1次分叉处之间的粗壮茎秆为下部茎,叶间茎秆部分即第1次分叉处至植株顶端之间的细小茎秆为上部茎),置于55℃烘箱中烘干至恒质量,粉碎并过40目筛,备用。
芦丁标准品(纯度大于等于98%,货号MUST-12040302)购自成都曼思特生物科技有限公司;其他试剂均为分析纯,购自国药集团。
1.2 方法
1.2.1 含水量和单株干质量的测定 将称量瓶置于105℃干燥箱中烘干约1.0 h后置于干燥器内冷却0.5 h并称量,重复进行干燥直至前后2次的质量差值在2 mg范围内,记录称量瓶质量(m0);准确称取一定量的芒萁单株样品并置于称量瓶中,精确称量二者总质量(m1)后置于105℃干燥箱中干燥3 h,取出并于干燥器内冷却约0.5 h后再次称量二者的总质量;称量后再次于105℃干燥箱中干燥约1 h,冷却后称量二者的总质量,重复此操作直至连续2次的质量差值在2 mg范围内,记录称量瓶和样品的总质量(m2)。芒萁植株含水量(ω)的计算公式为:ω=〔(m1-m2)/(m1-m0)〕×100%。
1.2.2 对照品溶液制备及标准曲线绘制 精密称取干燥至恒质量的芦丁对照品50.0 mg,加入甲醇20.0 mL,水浴微加热溶解,冷却后用甲醇定容至25 mL;精密吸取10 mL上述溶液,用蒸馏水定容至100 mL,即得质量浓度0.2 mg·mL-1的芦丁对照品溶液。精密吸取芦丁对照品溶液3.0 mL,加入蒸馏水5.0 mL和0.7 mol·L-1NaNO2溶液1.0 mL,摇匀后静置10 min;加入0.5 mol·L-1Al(NO3)3溶液1.0 mL,摇匀后静置10 min;再加入1.0 mol·L-1NaOH溶液10.0 mL,用蒸馏水定容至25 mL,摇匀后静置15 min;用759MC型紫外可见分光光度计(上海菁华科技仪器有限公司)进行全波段扫描,测定溶液的吸光度并绘制吸收曲线,据此确定在波长510 nm处有最大吸光值。
分别精密吸取芦丁对照品溶液0.0、1.0、2.0、3.0、4.0、5.0和6.0 mL,按照上述方法测定波长510 nm处的吸光度。以吸光度为横坐标x、芦丁质量浓度为纵坐标y绘制标准曲线,回归方程为y=0.080 3x+0.001 2(r=0.998 9),芦丁质量浓度在0.002 0~0.034 0 g·L-1范围内线性关系良好。
1.2.3 供试样品溶液的制备及测定 精密称取不同部位样品的干燥粉末各3.0 g,每个部位称取3份样品,分别置于索氏提取器中,加入150 mL石油醚浸泡2 h,回流至无色,自然挥干溶剂;将提取物置于锥形瓶中,加入50 mL甲醇,称取原始质量;静置36 h后密封并超声提取35 min,冷却并用甲醇补足至原始质量;静置30 min后过滤,滤液用甲醇定容至50 mL,即为供试样品溶液。
精密吸取供试样品溶液5.0 mL并用甲醇定容至50 mL;精密吸取3.0 mL该溶液,按照上述方法测定波长510 nm处的吸光度,并根据标准曲线计算不同采收期芒萁各部位的总黄酮含量,每个样品重复测定3次。
1.2.4 方法学考察 精密量取芦丁对照品溶液3.0 mL,按照上述方法测定吸光值,连续测定6次。总黄酮含量的RSD值为0.45%,说明该方法精密度较高。
量取10月中旬根状茎样品溶液3.0 mL,按照上述方法处理并分别放置0、2、4、6、8和10 h后测定吸光度。总黄酮含量的RSD值为1.37%,说明供试样品溶液在10 h内稳定。
准确称取10月中旬根状茎样品5份,每份3.0 g,按照上述方法制备供试样品溶液并测定吸光度。总黄酮含量的RSD值为2.38%,说明本方法的重复性良好。
精密量取总黄酮含量已知的10月中旬根状茎样品溶液7份,每份10 mL,分别加入0.0、1.0、2.0、3.0、4.0、5.0和6.0 mL芦丁对照品溶液,按照上述方法测定吸光度。平均回收率为98.78%,其RSD值为1.34%。
1.3 数据处理和统计分析
使用SPSS 10.0统计分析软件对实验数据进行单因子方差分析和LSD检验。
表1 不同采集时间芒萁含水量、单株干质量及不同部位总黄酮含量的比较(SE)1)Table1 Comparison on water content,dry weight per plant and total flavonoids content in different parts of Dicranopteris pedata(Houtt.)Nakai at different collection times(SE)1)
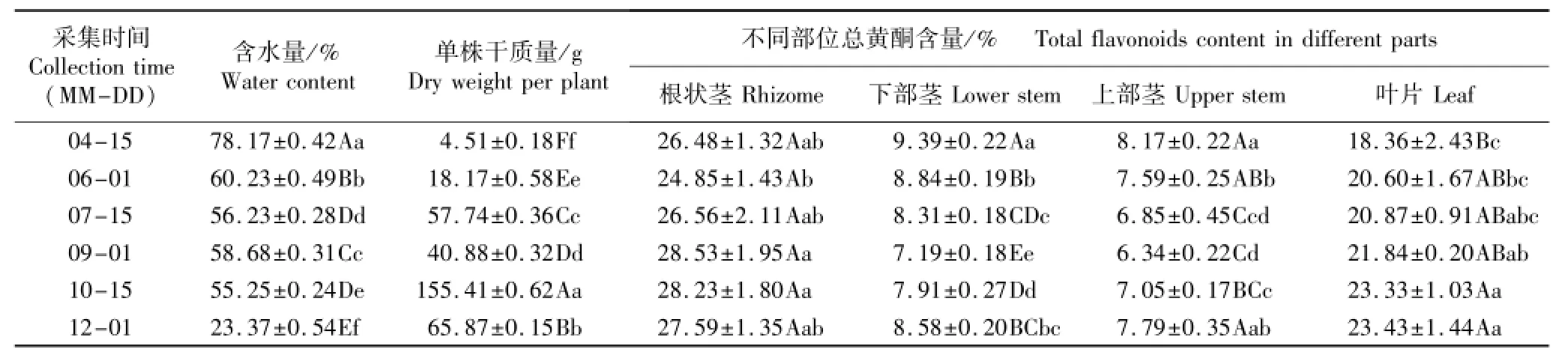
表1 不同采集时间芒萁含水量、单株干质量及不同部位总黄酮含量的比较(SE)1)Table1 Comparison on water content,dry weight per plant and total flavonoids content in different parts of Dicranopteris pedata(Houtt.)Nakai at different collection times(SE)1)
1)同列中不同的小写字母和大写字母分别表示在0.05和0.01水平上差异显著和极显著Different small letters and capitals in the same column indicate the significant and extremely significant differences at 0.05 and 0.01 levels,respectively.
?
2 结果和分析
不同采集时间芒萁植株含水量、单株干质量及不同部位总黄酮含量的测定结果见表1。
2.1 不同采集时间植株含水量及单株干质量的比较
由表1可见:生长初期(4月15日)芒萁植株的含水量较高,接近80%;随着植株的生长(6月1日至10月15日),其含水量逐渐趋于稳定,为55%~60%;进入成熟期(这一时期植株质量趋于最大值,且植株部分部位干枯)后,植株开始衰老,其含水量骤降,至12月1日仅为23.37%。
随着芒萁植株的生长(4月15日至10月15日),其单株干质量大体呈现逐渐增加的趋势,并在10月中旬达到最大,这一时期芒萁的单株干质量极显著高于其他时期(P<0.01);进入衰老期(12月1日)后,芒萁的单株干质量极显著降低但仍极显著高于10月份之前的单株干质量。这可能是由于这一时期植株光合作用减弱,但营养消耗仍然较大,植株逐渐枯萎所致。
2.2 不同采集时间各部位总黄酮含量的比较
由表1可见:4月份至9月份,芒萁上部茎和下部茎中的总黄酮含量均逐渐降低;其中,4月份芒萁上部茎和下部茎中的总黄酮含量最高,分别为8.17%和9.39%;9月份这2个部位的总黄酮含量最低,分别仅为6.34%和7.19%;此后,总黄酮含量开始有所回升,但仍低于生长初期;整个生长阶段,芒萁上部茎和下部茎中的总黄酮含量无显著差异。随着芒萁植株的生长,叶片中的总黄酮含量呈递增趋势,而根状茎中的总黄酮含量则无明显的变化趋势,总体上差异不显著。
从不同部位来看,不同采集时间芒萁根状茎中的总黄酮含量均最高。在整个生长阶段,各部位总黄酮含量从高到低依次为根状茎、叶片、下部茎、上部茎;根状茎和叶片中的总黄酮含量与茎中的总黄酮含量有极显著差异(P<0.01),根状茎和叶片中的总黄酮含量最高值分别可达28.53%和23.43%,而上部茎和下部茎中的总黄酮含量最高值分别仅为8.17%和9.39%。
3 结 论
研究结果表明:芒萁根状茎和叶片中的总黄酮含量均较高,并随着芒萁植株的生长呈现一定的动态变化规律。在9月初至10月中旬,根状茎中的总黄酮含量较高,在12月初叶片中的总黄酮含量达到最高值(23.43%),而芒萁茎中的总黄酮含量均较低。根状茎是芒萁的主要繁殖器官,不但不适宜作为提取总黄酮的原料,而且在采收时还应加以保护。综合考虑含水量、单株干质量、总黄酮含量以及药用部位和产量等因素,认为在10月中旬采收芒萁的叶片作为总黄酮提取的原料较为适宜。
[1] 秦仁昌.中国蕨类植物科属的系统排列和历史来源[J].植物分类学报,1978,16(3):1-19.
[2] 卢海生,庄惠如.福建福州鼓山药用蕨类植物资源调查[J].亚热带植物通讯,1999,28(2):42-46.
[3] HADDAD A Q,VENKATESWARAN V,VISWANATHAN L,et al. Novel antiproliferation flavonoids induce cell cycle arrest in human prostate cancer cell lines[J].Prostate Cancer and Prostatic Diseases,2006,9(1):68-76.
[4] 朱文振,马 龙,李国荣.黄酮类化合物的抗癌作用及作用机制[J].生命科学,2012,24(5):444-449.
[5] HARBORNE J B.The Flavonoids:Advances in Research Since 1986[M].London:Chapman&Hall,1993.
[6] 丁利君,黄泽华.微波-纤维素酶联合提取芒萁黄酮及抗氧化研究[J].食品科技,2011,36(1):172-176.
[7] 国家中医药管理局《中华本草》编委会.中华本草:第四卷[M].上海:上海科学技术出版社,1998:86-88.
[8] 丁利君,周圳辉,林燕如.芒萁中黄酮物质的提取及其抗氧化研究[J].食品科学,2005,26(8):77-82.
[9] NEUHOUSER M L.Dietary flavonoids and cancer risk:evidence from human population studies[J].Nutrition and Cancer,2004,50 (1):1-7.
[10] QIN L Q,XU J Y,WANG P Y,et al.Soyfood intake in the prevention of breast cancer risk in women:a meta-analysis of observational epidemiological studies[J].Journal of Nutritional Science and Vitaminology,2006,52(6):428-436.
[11] HIRVONEN T,VIRTAMO J,KORHONEN P,et al.Flavonol and flavone intake and the risk of cancer in male smokers(Finland) [J].Cancer Causes and Control,2001,12(9):789-796.
[12] 苏育才.芒萁多糖提取及抗菌活性初步研究[J].亚热带植物科学,2005,34(2):43-45.
[13] 陈晓清,许柑叶.九种蕨类植物多糖提取物抗动植物病原菌活性[J].亚热带植物科学,2007,36(1):43-45.
[14] 汤 晓,朱建华.芒萁根茎黄酮类化合物的提取工艺优化研究[J].宁波职业技术学院学报,2008,12(5):112-115.
(责任编辑:佟金凤)
Dynamic change of total flavonoids content in different parts of Dicranopteris pedata at different collection times
CHEN Shaomei,SONG Feifei,CHEN Yanyu(Fujian Vocational College of Bioengineering,Fuzhou 350002,China), J.Plant Resour.&Environ.2014,23(4):102-104
Water content,dry weight per plant and total flavonoids content in different parts of Dicranopteris pedata(Houtt.) Nakai at different collection times(from April to December)were comparatively analyzed.The results show that at different collection times,there are extremely significant differences in water content and dry weight per plant,and also there are obvious differences in total flavonoids content in rhizome,leaf,lower and upper stems.Generally,from mid April,water content of D.pedata begins to decrease gradually and reaches the lowest in December.Dry weight per plant increases generally and reaches the highest in mid October with a value of 155.41 g.Total flavonoids content in rhizome and leaf are extremely significantly(P<0.01)higher than that in stem and their maximum are 28.53%and 23.43%,respectively, while that in upper and lower stems are only 8.17%and 9.39%,respectively.Comprehensively considering on many factors such as total flavonoids content,medicinal material yield and collection time,etc,the optimal raw material for extracting total flavonoids is confirmed to be leaf,the optimal collection time to be mid October.
芒萁;总黄酮;采集时间;含水量
Dicranopteris pedata(Houtt.)Nakai;total flavonoids;collection time;water content
Q946.8;R282;S567.23+9
A
1674-7895(2014)04-0102-03
10.3969/j.issn.1674-7895.2014.04.15
2013-12-04
福建生物工程职业技术学院科研项目(KJ201306)
陈少美(1971—),女,福建宁德人,硕士,实验师,主要从事食品、生物技术的研究和开发工作。
