有氧运动和饮食干预对肥胖小鼠Visfatin水平的影响及其与氧化应激的关系
2014-05-11付鹏宇龚丽景赵林青刘庆春李军
付鹏宇 龚丽景 赵林青 刘庆春 李军
1北京体育大学科学研究中心(北京 100084)
2北京体育大学运动人体科学学院
3中国武警总医院
4北京大学实验动物中心
5四海恒源(北京)科技有限公司
肥胖与糖尿病、血脂异常、高血压病等许多疾病有关,其发生机制可能与糖、脂代谢紊乱及氧化应激失衡有关。Visfatin作为一种由内脏脂肪分泌的脂肪因子,在脂肪细胞分化和葡萄糖代谢中有特殊作用[1],它具有类胰岛素样降血糖作用,并促进前内脏脂肪细胞分化,是糖、脂代谢重要影响因子[2];而氧化应激(OS)失衡是一种机体活性氧(ROS)产生过多或(和)机体抗氧化能力下降,导致ROS清除不足,使之在体内增多并引起细胞氧化损伤的病理过程。作为控制肥胖有效手段,饮食控制和有氧运动是否调控脂肪因子Visfatin分泌及其与OS过程有关鲜有研究。本研究从肥胖机体Visfatin水平和OS状态的变化入手,以饮食控制和有氧运动作为干预手段,探究可能诱导肥胖发生的机理及其控制方法。
1 材料与方法
1.1 实验对象与分组
C57BL/6J雄性小鼠40只,北京维通利华实验动物技术有限公司,许可编号SCXK(京)2012-0001,随机分为普通膳食对照组 (ND组)10只和高脂饮食组(HD组)30只。ND组给予大鼠维持饲料,由北京科澳协力饲料有限公司提供,许可编号SCXK(京)2009-0012;HD组喂以高脂饲料,主要成分包括酪蛋白、胱氨、玉米淀粉、麦芽糊精、蔗糖、纤维素、豆油、猪油、复合矿物质、磷酸氢钙、碳酸钙、柠檬酸钾、复合维生素、酒石酸氢胆碱等,由美国Research Diet公司提供,货号D12492:Rodent Diet with 60 kcal%Fat,60%。建立肥胖动物模型后 (以HD组小鼠平均体重大于ND组平均体重的20%作为肥胖标准),将HD组小鼠随机分为高脂肥胖对照组(OB组)、高脂转普通膳食组(HTN组)和高脂膳食+有氧运动组(EH组),每组10只。其中HTN组高脂饲料改为大鼠维持饲料;EH组运动强度设定为:跑台坡度0,速度10 m/min,1 h/次/天,6次/周,共8周。各组小鼠均自由摄食饮水,每3天测量一次各组小鼠体重。饲养与训练均在北京体育大学动物实验室屏障环境内进行,温度(22±2)℃,湿度40%~70%,许可编号SYXK(京)2011-0034。
1.2 仪器与设备
Beckman低温高速离心机 (美国),Model 680型酶标仪(BIO-RAD),电动匀浆器(IKA公司),电泳仪(北京六一仪器厂),电泳槽(北京君意东方电泳设备有限公司);BioSens SC 810B型凝胶成像仪 (上海山富科学仪器有限公司),Roche LightCycler480实时定量PCR仪(Roche公司)。
1.3 取材
干预8周后取材,注射麻醉小鼠,心脏取血后迅速打开腹腔,取内脏脂肪(肾周)、肝脏,用锡纸包裹投入液氮冷冻,而后置于-80℃冰箱保存待测。
1.4 血清TG、CHO含量测定
采用酶比色法(GPO-PAP法)测定小鼠血清TG和CHO含量,按试剂盒(中生北控生物科技股份有限公司)说明书进行操作。
1.5 血清Visfatin含量测定
采用ELISA法测试血清Visfatin含量,按试剂盒(北京冬歌生物科技有限公司)说明书进行操作。
1.6 内脏脂肪和肝脏组织VisfatinmRNA相对含量测试
Trizol法提取内脏脂肪和肝脏Visfatin总RNA,用琼脂糖电泳仪检测总RNA浓度,逆转录过程根据逆转录试剂盒 (TaKaRa公司:PrimeScriptII 1stStrand cDNA Synthesis Kit)说明操作获取cDNA后,再进行实时荧光定量PCR扩增。选β-actin为内部参照基因,Visfatin为目的基因,使用Primer5软件设计扩增引物并合成引物,Visfatin上游引物5’-GCCACCTTATCTT AGAGTCATTCA-3’,下游引物5’-TCTCGGGTTAAC TTCTGTAGCA-3’;β-actin上 游 引 物 5’-CTAGCA CCATGAAGATCAAGATC-3’,下游引物5’-ACTCAT CGTACTCCTGCTTGC-3’。实时荧光定量PCR反应体系:SYBR FAST Qpcr Kit Master Mix(2×)Universal 5μL;10 μM上 下游 引物 各0.2 μL;cDNA为1 μL;ROX校正染料0.2 μL;用H2O将总体系补齐至10 μL。PCR反应条件为:95℃预变性3 min,循环扩增95℃3s→60℃ 20 s(循环40次),最后溶解从60℃→95℃,每15 s升温1℃。
采用比较阈值法表示目的基因的相对表达[3],即△△Ct法:目的基因的相对表达量=2-△△Ct(2-△△Ct表示的是实验组目的基因的表达相对于对照组的变化倍数), 其中△△Ct=(CtVisfatin-Ctβ-actin) 实验组-(CtVisfatin-Ctβ-actin)对照组,使用这一方法可以直接得到Visfatin基因相对于内参基因β-actin的定量。
1.7 血清T-SOD、GSH-px、MDA含量测定
采用双抗体夹心法测试血清总超氧化物歧化酶(T-SOD)、谷胱甘肽过氧化物酶(GSH-px)、丙二醛(MDA)含量,按试剂盒(北京冬歌生物科技有限公司)说明书进行操作。
1.8 统计学分析
采用SPSS13.0软件对所有数据进行统计学处理,实验数据计量资料以均数±标准差表示。多组间数据比较用析因设计的方差分析(ANOVA),任意两组间比较采用独立样本t检验,采用积矩相关系数(Pearson相关系数)进行相关分析,检验标准为α=0.05。
2 结果
2.1 体重和血清CHO及TG
与OB组相比,HTN组和EH组体重和血清CHO、TG水平降低,且HTN组血清CHO、TG水平较EH组下降明显,见图1、表1。

图1 各组小鼠实验期间体重的变化

表1 各组小鼠血清CHO、TG含量比较
2.2 Visfatin mRNA相对表达量
图2显示,高脂饲料饲喂各组内脏脂肪Visfatin mRNA相对表达量较ND组降低,HTN组较OB组降低,EH组较OB组升高,但各组之间无显著性差异。图3显示,OB组肝脏Visfatin mRNA相对表达量较ND组升高,HTN组和EH组较OB组均有下降趋势,但各组之间无显著性差异。图4显示,肥胖模型各组血清Visfatin水平均高于ND组,EH组血清Visfatin水平较OB组降低,HTN组血清Visfatin水平较OB组显著性增高(P<0.05)。
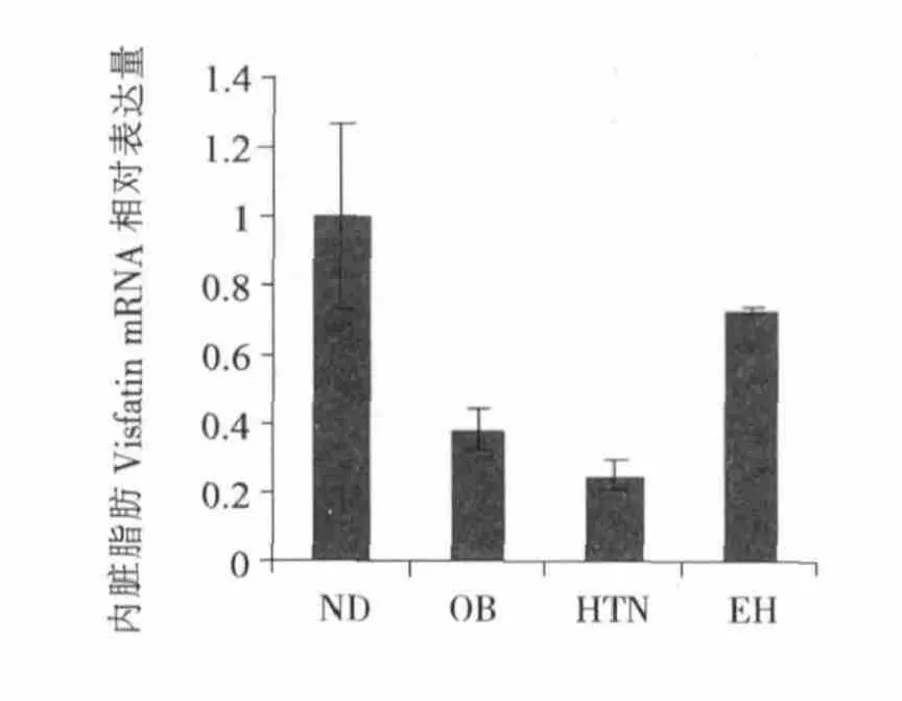
图2 各组小鼠内脏脂肪Visfatin mRNA相对表达量
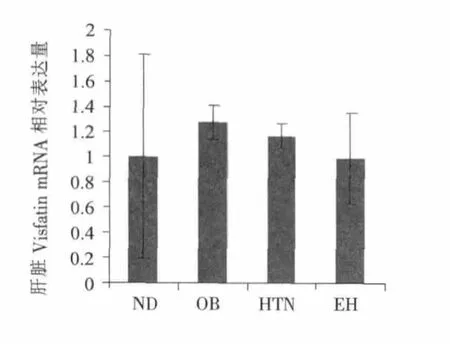
图3 各组小鼠肝脏Visfatin mRNA相对表达量

图4 各组小鼠血清Visfatin含量比较
2.3 OS水平
表2显示,HTN组抗氧化酶SOD、GSH-px水平和EH组SOD水平较OB组显著上升,且EH组MDA水平显著低于OB组。

表2 各组小鼠血清SOD、GSH-px和MDA含量比较
2.4 小鼠Visfatin水平与OS水平相关性分析
对各组小鼠血清Visfatin水平与OS相关指标进行相关性分析后发现,小鼠血清Visfatin水平与SOD水平呈正相关(r=0.505,P<0.05);与GSH-px水平呈正相关(r=0.627,P<0.01);与MDA水平呈正相关(r=0.520,P<0.05)。
3 讨论
3.1 高脂膳食诱导的肥胖与Visfatin水平的关系
Visfatin是Fukuhara等[4]在2005年发现的一种内脏脂肪细胞因子,它具有类胰岛素样作用,能促进内脏脂肪的合成和聚集,可能参与肥胖等疾病的发生发展。
从血清Visfatin水平而言,本研究显示高脂膳食诱导的肥胖小鼠的血清Visfatin水平较普通对照组明显升高。研究发现[4-6],血浆Visfatin水平与腰臀比与肥胖度呈正相关,提示Visfatin可能参与了肥胖发病的病理生理过程,其原因可能是Visfatin促进葡萄糖转化为TG,及TG在前脂肪细胞的积聚,使内脏脂肪组织分化成熟,导致了肥胖的积累[7];同时,Visfatin参与调控其他脂肪细胞因子的分泌活动,也可能是肥胖导致血清Visfatin水平升高的原因。
从内脏脂肪Visfatin mRNA水平而言,肥胖小鼠内脏脂肪(取材部位:肾脏周围、肠系膜周围、附睾周围)Visfatin mRNA较对照组明显升高[8],与本实验结果相左,取材部位的不同及取材前的禁食时间长短不同等因素均可能影响实验结果;同时本实验只检测了内脏脂肪Visfatin mRNA水平,没有检测其蛋白水平,作为一种主要由内脏脂肪分泌的脂肪因子,肥胖机体内脏脂肪中的高Visfatin水平可能负反馈的调节其Visfatin mRNA水平,从而使得其水平下降。
从肝脏Visfatin mRNA水平而言,本研究发现,OB组肝脏Visfatin mRNA水平较ND组有上升的趋势,但无显著性差异。其可能机制是:高脂饮食会诱发肥胖患者机体的糖代谢异常,血糖升高使机体产生相应的代偿性反应,使各组织分泌更多的Visfatin,激活胰岛素代谢通路,模拟胰岛素的降血糖作用,以弥补胰岛素的相对不足,从而导致作为调控机体的糖代谢器官的肝脏的Visfatin维持于较高水平[9]。
3.2 高脂膳食诱导的肥胖与机体OS水平的关系
本研究发现HD组小鼠血清MDA水平较ND组下降,SOD及GSH-px水平较ND组升高,说明肥胖和OS反应有密切关系。可能是由于肥胖导致机体内尼克酰胺腺嘌呤二核苷酸磷酸氧化酶(NADPH)氧化途径被激活[10],致使体内ROS浓度升高,导致机体处于OS状态并造成一系列的损伤[11],作为脂质过氧化产物的MDA,其水平的降低可能意味着肥胖机体OS状态对机体脂质过氧化产物的损伤;同时,SOD及GSH-px水平的升高说明机体为了平衡OS状态而相应提高了抗氧化能力。
3.3 肥胖机体Visfatin水平与OS水平的关系
研究发现单纯肥胖患者体内OS水平和内脏脂肪细胞因子含量显著相关[12],本结果显示血清Visfatin水平与MDA、SOD和GSH-px水平呈正相关,提示肥胖小鼠Visfatin水平升高与体内氧化应激增强有关。Visfatin可以引起内皮细胞ROS生成增多[13],也可通过上调NAD合成水平促进氧化应激[14]。肥胖机体内升高的Visfatin可激活蛋白激酶C(PRC)信号转导通路,活化细胞NADPH氧化酶,诱导ROS的合成,从而加重脂质过氧化,促进OS反应。
同时,肥胖机体的高OS水平也可反作用于肝脏Visfatin水平,使其出现升高,这可能与“二次打击假说”有关,即肥胖机体可能出现的胰岛素抵抗和脂肪代谢紊乱会导致脂肪酸和TG在肝脏沉积,引起脂肪变性,作为首次打击;脂肪变性的肝细胞活力下降,导致氧化代谢产物增加,引发OS作为二次打击,使得脂肪变性的肝细胞发生炎性反应、坏死甚至纤维化,从而加重肥胖机体的糖代谢障碍[15]。由OS所导致的肥胖机体肝脏Visfatin水平升高可能不仅与肥胖所致的肝脏糖代谢异常有关,还可能与炎症反应有关。
3.4 有氧运动和饮食控制对肥胖机体Visfatin和OS水平的调控作用
有氧运动和饮食控制作为两种最有效的非药物干预措施,其对肥胖及相关疾病影响的机制一直是研究的重点[16]。本研究通过比较HTN组和EH组的体重、血清CHO、TG值发现,饮食干预比有氧运动对肥胖的调控作用更显著。
从两种干预控制氧化应激程度而言,HTN组的血清SOD及GSH-px水平较OB组明显升高,说明饮食控制可提高机体的抗氧化能力。可能是通过增加肝脏中SOD活性并降低过氧化氢酶活性提高机体抗氧化能力并减轻OS水平[17]。
运动会产生ROS,但是最终是否会引起机体处于OS状态还与运动的强度、持续时间密切相关[16]。规律的有氧运动干预后,EH组血清SOD水平较OB组升高、GSH-px水平降低,而MDA水平明显下降,且具有显著性差异,说明有氧运动具有改善机体OS失衡的作用。其可能机制是由于机体对运动产生了适应性代偿[18],久坐少动生活方式的受试者参与了40周的跑步训练后,血清GSH-px的活性明显增强[19];有氧运动可使胰岛素抵抗大鼠内脏脂肪组织SOD活性显著升高,这可能是运动降低OS水平的原因[20];长期有氧运动的大鼠肝脏抗氧化酶活力比肥胖对照组显著提高,MDA含量显著降低[21]。
从两种干预对脂肪因子Visfatin水平的影响而言,本研究中HTN组内脏脂肪和肝脏中的Visfatin mRNA较OB组有下降的趋势,说明从高脂转为普通膳食可以有效地改善机体的糖、脂代谢;有氧运动可以降低血浆Visfatin水平,提高内脏脂肪Visfatin mRNA的表达,降低肝脏Visfatin mRNA水平。原因可能有以下几个方面,其一,有氧运动过程中交感神经兴奋从而调整生长激素、TNF-α的分泌,这些激素可能抑制Visfatin的表达[25];其二,有氧运动可以减少脂肪的堆积和调整脂肪的分布,从而减少Visfatin的分泌;其三,运动时骨骼肌收缩所释放的IL-6对于Visfatin的表达减少可能起到一定作用;同时,有氧运动可使炎症反应状态得到改善,而在炎症调节中扮演一定角色的Visfatin表达的减少也就伴随这种长期效应而自然发生[24]。有氧运动干预后,肾周脂肪、皮下脂肪及肌肉组织Visfatin蛋白表达量较普通组增加,以肾周脂肪较为显著[22,23],可能是Visfatin在运动后的恢复期参与局部组织的代谢[26]。
4 总结
肥胖导致血清Visfatin、肝脏及内脏脂肪Visfatin mRNA水平升高,并诱发机体更高程度的OS;有氧运动和饮食控制下调肥胖机体体重水平及血液CHO、TG含量,降低血清Visfatin、肝脏Visfatin mRNA水平,改善机体OS状态,从而减轻肥胖对机体的损伤。
[1]赖爱萍,陈文鹤,王益义.肥胖儿童少年血清内脂素水平与糖代谢、脂代谢的相关性研究.中国体育科技,2012,48(2):86-90.
[2]张蕾,杨秀红,陈树春.罗格列酮对IR大鼠血清Visfatin、VCAM-1水平及内脏脂肪组织Visfatin mRNA表达的影响.河北医药,2011,33(2):184-185.
[3]Livak KJ,Schmittgen TD.Analysis of relative gene expression data using real-time quantitative PCR and the 2[-Delta Delta C(T)]method.Methods,2001,25(4):402-408.
[4]Fukuhara A,Matsuda M,Nishizawa M,et al.Visfatin:a protein secreted by visceral fat that mimics the effects of insulin.Science,2005,307(5708):426-430.
[5]杨媚,杨刚毅,李伶,等.不同糖耐量个体血浆内脂素水平的变化.中华内分泌代谢杂志,2006,22(3):245-247.
[6]Jian WX,Luo TH,Gu YY,et al.The visfatin gene is associated with glucose and lipid metabolism in a Chinese population.Diabet Med,2006,23(9):967-973.
[7]Sethi JK,Vidal-Puig A.Visfatin:the missing link between intra-abdominal obesity and diabetes.Trends Mol Med,2005,11(8):344-347.
[8]林纬,刘小莺,周文娟,等.肥胖小鼠内脏与皮下脂肪Visfatin基因表达.福建医科大学学报,2008,42(5):391-395.
[9]张安星.不同糖代谢状态下大鼠肝脏内脂素的表达及其对肝葡萄糖和能量代谢的作用.贵州:遵义医学院硕士学位论文,2011:7-37.
[10]赵彦,孙桂香.氧化应激与单纯性肥胖及2型糖尿病的关系.天津医药,2010,38(5):442-443.
[11]Meigs JB,Larson MG,Fox CS,et al.Association of oxidative stress,insulin resistance,and diabetes risk phenotypes:The Framingham off-spring study.Diabetes Care,2007,30(10):2529-2535.
[12]Shen XP,Zou SB,Wu HJ,et al.Circulating levels of oxidative stress and adipocytokines in obese subjects.Chin J Cell Mol Immunol,2008,24(7):721-723.
[13]Kim SR,Bae YH,Bae SK,et al.Visfatin enhances ICAM-1 and VCAM-l expression through ROS-dependent NF-kappa B activation in endothelial cells.Biochim Biophys Acta,2008,5(1783):886-895.
[14]Dong WR,Xiang LX,Shao JZ.Pre-B cell colonyenhancing factor in lower vertebrates:First evidence of this cytokine being involved in antioxidant activity by reconstruction of a novel NAD salvage pathway in E.coli.Int J Biochem Cell Biol,2008,41(5):1127-1137.
[15]Day CP,James OF.Steatohepaitis:a tale of two “hit?”.Gastroenterology,1998,114(4):842-825.
[16]孙明晓.有氧运动与饮食干预对肥胖少年氧化应激状态的影响和分子机制研究.北京:北京体育大学博士学位论文,2008:15-17.
[17]Burneiko RC,Diniz YS,Galhardi CM,et al.Interaction of hypercaloric diet and physical exercise on lipid profile,oxidative stress and antioxidant defenses.Food Chem Toxicol,2006,44(7):1167-1172.
[18]Radak Z,Taylor AW,Ohno H,etal.Adaptation to exercise-induced oxidative stress:from muscle to brain.Exerc Immunol Rev,2001,7:90-107.
[19]Evelo CT,Palmen NG,Artur Y,et al.Changes in blood glutathione concentrations,and in erythrocyre glutathione reductase and glutathione S-transferase activity after running training and after participation in contests.Eur J Appl Physiol Occup Physiol,1992,64(4):354-358.
[20]杨洪涛,李娟,陈巍,等.运动对胰岛素抵抗大鼠内脏脂肪组织氧化应激及炎症的影响.西安体育学院学报,2010,27(2):206-209.
[21]邓玉强,金其贯.有氧运动和大豆多肽对高脂饮食大鼠肝脏自由基代谢及组织形态的影响.北京体育大学学报,2009,32(2):70-73.
[22]高雅,王长江,代芳,等.二甲双胍和游泳运动对肥胖大鼠不同组织内脏脂肪素蛋白表达和血清水平的影响.中国糖尿病杂志,2010,18(9):696-700.
[23]尚敬,陈璐璐,孙晖.运动干预对高脂喂养大鼠脂肪组织内脏脂肪素表达的影响.中国现代医学杂志,2008,18(5):551-554.
[24]罗莉.二甲双胍和有氧运动对高脂诱导肥胖大鼠血清及不同组织Visfatin蛋白表达水平的影响.安徽:安徽医科大学硕士学位论文,2010:3-37.
[25]MacLaren R,Cui W,Cianflone K.Visfatin expression is hormonally regulated by metabolic and sex hormones in 3T3-L1 pre-adipocytes and adipocytes.Diadetes Obes Metab,2007,9(4):490-497.
[26]陈宝.有氧运动联合膳食控制对2型糖尿病大鼠血清Visfatin水平的影响及相关因素研究.扬州:扬州大学硕士学位论文,2009:9-15.
