运动通过调控CREB促进成年神经发生
2014-05-11张宪亮徐波邓玉强贺强钱帅伟
张宪亮 徐波 邓玉强,2 贺强 钱帅伟
1青少年健康评价与运动干预教育部重点实验室 华东师范大学 (上海 200241)
2南通大学体育科学学院
3烟台大学体育学院
成年神经发生(adult neurogenesis)是指成年后,哺乳动物某些脑区还能够生成新的内源性神经干细胞,并转化成功能性神经元加入到现有的神经网络回路中,最终整合到成年脑的结构和功能中的过程,其主要分布在侧脑室的室管膜下区 (the subventricular zone of the lateral ventricle,SVZ) 和海马齿状回的颗粒下层(the subgranular zone of the hippocampal dentate gyrus,SGZ)。 SVZ产生3型祖细胞(成神经细胞),并沿着迁移流迁移到嗅觉中枢,整合到嗅觉回路;而SGZ产生颗粒细胞,并在神经回路中进行功能性整合,形成新的突触联系,与学习记忆密切相关[1]。正常生理条件下,神经发生处于一个相对平衡状态,以维持神经元功能稳定以及脑功能健康。但运动、衰老、丰富环境和应激等因素会引起神经发生的改变[2]。一般来说,适宜的运动可促进成年海马齿状回SGZ神经干细胞的增殖、存活和分化,提高学习记忆能力,维持脑健康[3]。那么,运动是如何影响成年大脑神经发生过程呢?其生物学机制又如何呢?
动物实验发现,新生神经元的产生受到细胞间相互作用和某些信号通路的影响。不管是通过降低神经发生速率使神经元产生过少,还是通过抑制细胞凋亡使神经元产生过多,都会损害海马学习记忆能力。因此,成年海马的神经发生必须受到精确调控[4]。机体通过哪一信号通路整合各种刺激,精确调控神经发生以满足机体的需求仍不清楚。但新生神经元的存活以及形态的成熟都涉及到cAMP反应元件结合蛋白(cyclic-AMP response binding protein,CREB)。据此,本文将运动、CREB以及神经发生的研究进展进行综述。
1 CREB与神经发生
CREB是真核细胞内核转录增强因子,受多种因素激活,进而调控靶基因转录。它是由一段30bp左右的DNA片段构成的cAMP应答序列,这段序列含有高度保守的5’-TGACGTCA-3’的8碱基回文结构,主要存在于基因的启动子与增强子上。CREB信号通路的关键环节是CREB磷酸化。免疫组化实验证实,CREB信号通路在神经发生中的作用主要由磷酸化的CREB(pCREB)调控。海马SGZ区产生的绝大多数新生未成熟神经元都伴随有CREB磷酸化[5,6]。 Jagasia等[6]发现,成年海马齿状回新生颗粒细胞从产生后的3~21天一直伴有CREB磷酸化,且pCREB的免疫活性伴随着DCX(doublecortin+,主要用于标记未成熟的新生神经细胞)的表达,随着颗粒细胞的成熟,DCX的表达减少,pCREB也随之下调。
目前,通过各种方法已经检测到CREB信号通路在成年动物脑内神经发生中的作用。磷酸二酯酶-4(phosphodiesterase 4,PDE-4)抑制剂激活了成年脑内的CREB信号通路,促进齿状回神经干细胞增殖,新生神经元存活以及树突分支[7]。 Giachino等[8]在敲除了CREB的转基因鼠中发现新生颗粒细胞减少,说明CREB信号在成年新生神经元的存活中起了关键作用。以上研究说明CREB信号通路可调节成年神经发生,然而CREB信号通路是直接调控干细胞还是通过其它分子机制起作用,目前仍不清楚。
2 运动与神经发生
成年海马神经发生受到外源性和内源性因素的共同调控。1997年,Kempermann等[9]首先发现丰富环境可促进成年海马神经发生,同时提高了海马依赖的空间学习记忆能力。丰富环境包含运动、社会交往、学习训练及身体活动等多个因素。为了确定具体哪个因素在成年海马神经发生中具有关键作用,van Praag等[10]把各个因素剥离出来,将小鼠分为运动、学习、丰富环境及对照组,发现只有运动组小鼠海马齿状回神经干细胞增殖及存活能力增强、空间记忆能力提高。Ehninger等[11]将小鼠分为丰富环境组及不含跑轮的丰富环境组,发现运动对神经发生具有更明显的促进作用。Kobilo等[12]验证了Ehninger的研究,将C57BL/6雌性小鼠分为对照组、跑轮组、丰富环境组及不含跑轮的丰富环境组,发现运动在促进海马神经发生及增加BDNF表达上起了关键作用。
运动可促进成年脑内神经发生。一些研究发现,不管是被动运动还是主动运动均可促进成年海马神经发生。Kim等[13]研究了1周强制性跑台训练对SD大鼠(5周龄)神经发生的影响。结果表明,中、低强度训练均可显著增加大鼠海马齿状回5-溴-2-脱氧尿苷阳性(BrdU+)细胞的数量。Lou等[14]的研究也发现,低、中强度跑台训练能促进大鼠(5周龄)海马神经发生和相关基因表达。Synder等[15]探讨了自主运动对6周龄小鼠新生神经细胞存活和功能性整合的作用,结果发现12天自主运动增加了海马齿状回SGZ区新生细胞数量,提示自主运动促进了新生神经细胞的功能性整合。Mustroph等[16]将C57BL/6雄性小鼠分为对照组、跑轮运动组、丰富环境组和丰富环境+跑轮组。32天后进行Morris水迷宫实验,并采用BrdU+/NeuN+双标记新生神经元。结果显示,跑轮组和丰富环境+跑轮组BrdU+/NeuN+的阳性细胞显著增加,学习记忆能力显著提高,提示跑轮运动促进了大脑神经发生,提高学习记忆能力。以上实验表明,被动运动与主动运动均能诱导成年海马神经发生,且适宜的运动不仅在数量上,还在质量上影响神经发生。
运动也可抑制由年龄增加引起的神经发生水平下降[17,18]。Lafenêtre等[18]发现,运动抑制了由年龄增加引起的海马神经细胞增殖的减少,增加新生颗粒细胞的产生,老年小鼠神经发生水平明显低于成年小鼠。最近研究发现,运动还可促进AD模型鼠的神经发生,提高认知功能[19,20]。跑轮运动减少了AD转基因鼠(过表达APP695swe)的Aβ沉积,改善其空间记忆能力[19]。Rodriguez等[20]发现,AD转基因鼠神经发生水平下降,但是运动后神经发生水平得以提高。因此,运动不仅可促进成年鼠神经发生,还可抑制由年龄增加或AD等因素造成的神经发生水平的降低。
3 CREB在运动依赖的神经发生中的作用
适宜的运动不仅可以促进海马齿状回SGZ神经发生,还可影响新生神经元的成熟过程。Luo等[21]在小鼠脑缺血造模后令其进行自主跑轮运动,结果发现运动可促进脑缺血小鼠海马齿状回新生颗粒细胞的产生,同时CREB磷酸化水平上调,改善了脑缺血造成的学习记忆能力下降。Thakker等[22]发现运动调节了CREB的磷酸化水平,促进新生神经元的产生及存活。Huang等[23]发现自主跑轮运动后,成年海马齿状回新生神经元细胞存活能力增强,同时伴随着齿状回内CREB磷酸化水平升高。因此,运动依赖的神经发生伴随着CREB的磷酸化。CREB作为一种细胞核内转录因子,可通过自身磷酸化修饰调节下游靶基因的转录。CREB能整合Ca2+、cAMP及生长因子等信号,是细胞内多条信号转导通路的集聚点。Ca2+、cAMP及生长因子等可诱导CREB的磷酸化,磷酸化的CREB与cAMP反应元件 (cAMP response element,CRE)结合,与辅助激活因子CREB结合蛋白(CREB-binding protein,CBP)及p300(一种基因编码的核蛋白)一起在共激活因子作用下,调控下游靶基因的转录。同时,CRE序列中CpG的甲基化可抑制其与CREB结合;miRNA也可改变RNA结合蛋白的位置,按顺序结合CBP/p300,抑制CBP/p300活性;DNA甲基化及miRNA都可以直接作用于CREB转录后的目的基因表达,共同调控成年神经发生(图1)。
3.1 运动通过pCREB调节神经发生

图1 CREB各阶段与神经发生
Suijo等[24]研究发现,14天自主运动后小鼠海马内脑源性神经营养因子 (brain-derived neurotrophic factor,BDNF)、CREB上调,mTOR及p70S6K磷酸化水平提高,并且海马神经发生能力增强。Lee等[25]研究发现自主运动提高了大鼠海马内BDNF、CREB、p-CREB的蛋白水平。运动通过CREB的磷酸化调节成年海马神经发生,同时伴随着BDNF蛋白水平升高,说明运动调节神经发生的机制可能与CREB的磷酸化及BDNF蛋白表达有关。海马内BDNF的快速增加会短暂激活TrkB导致CREB的磷酸化,而BDNF的渐进性增强会持续性激活TrkB受体并使CREB持续性磷酸化[26]。急性和渐进性增加BDNF对CREB磷酸化产生了不同的结果,说明CREB的磷酸化可能是由BDNF的改变引起的。BDNF蛋白高表达会激活丝裂原活化蛋白激酶 (mitogen activated protein kinase,MAPK),从而促进CREB在133位点磷酸化[27]。同时,运动可显著提高BDNF水平。因此,运动可能提高了BDNF表达水平,通过TrkB受体,作用于MAPK途径,促使CREB在133位点磷酸化,促进海马神经发生。此外,与神经发生相关的生长因子还包括VEGF、IGF-1等,运动促进神经发生的同时伴随着VEGF[28]、IGF-1[29]表达增加。
Ma等[30]发现运动后5-HT1A受体、CREB的表达上调。运动首先激活了海马5-HT系统,促进5-HT合成和5-HT1A受体表达增加,神经传递功能增强。由于5-HT1A受体是G蛋白偶联受体 (G-proteincoupled receptors,GPCRs),通过G 蛋白偶联使cAMP环化酶活性升高,接着cAMP水平升高,进而激活PKA,后者在133位点磷酸化CREB,促使下游靶基因转录。同时,5-HT、去甲肾上腺素、多巴胺等神经递质通过GPCRs介导的信号通路调节成年神经发生[31]。因此,运动后5-HT、多巴胺等神经递质通过GPCRs,促使腺苷酸环化酶 (adenylate cyclase,AC)生成cAMP,cAMP激活PKA,转移到核内使CREB磷酸化,调控神经发生。
在成年海马齿状回新生颗粒细胞内发现了NMDA受体的激活[32],而敲除NMDA受体的成神经细胞出现死亡[33]。这提示,NMDA受体与神经发生密切相关。Lou等[14]发现运动促进神经发生,并提高了海马NMDAR1 mRNA水平。 Real等[34]将大鼠分为3天、7天、15天、30天运动组及对照组,免疫组化检测AMPA受体亚基GluR1、GluR2/3的变化,发现30天运动后GluR1、GluR2/3表达增加,运动诱导脑的可塑性增强。NMDA受体、AMPA受体激活后,胞内Ca2+增加,激活了钙调激酶 (CaMK),CaMKIV是CREB在133位点磷酸化的关键环节,而CaMKⅡ可使CREB在142/143位点磷酸化。同时,Ca2+还可通过第二信使cAMP促使CREB在133位点磷酸化。因此,运动诱导神经发生的机制可能是运动上调了NMDAR、AMPAR的表达。同时,适宜的运动可使谷氨酸在正常范围内升高,与其受体结合,促使Ca2+通道打开,Ca2+浓度增加,激活CaMK或cAMP,调节CREB的磷酸化,调控神经发生。丰富性环境小鼠海马神经祖细胞增殖的同时,其海马组织中CaMK和CREB的表达量也显著增加,证实了CaMK/CREB表达增加可能在丰富环境介导的神经发生中起重要作用。
以上研究表明,运动可通过CREB上游分子(如BDNF等营养因子介导的MAPK途径、5-HT介导的cAMP/PKA/CREB信号通路、Ca2+介导的Ca2+/CaMK通路)促进CREB磷酸化,调控神经发生(图2)。
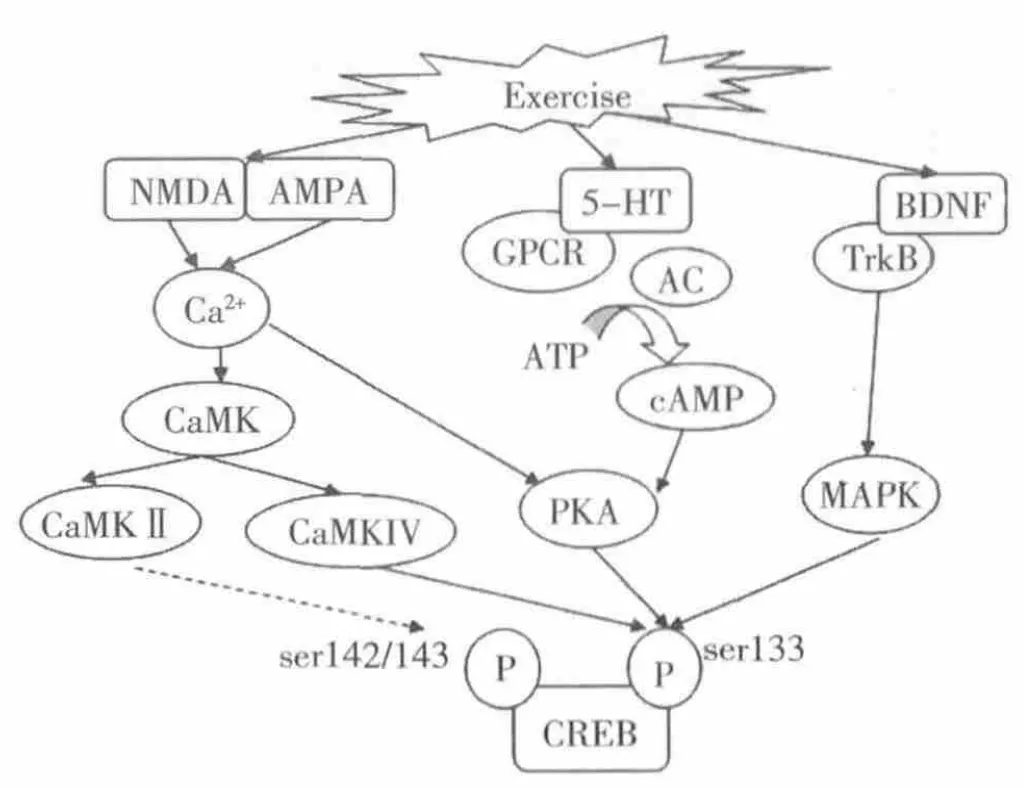
图2 运动对CREB磷酸化水平的调控
3.2 运动通过共激活因子调节神经发生
CREB的转录水平依赖于CBP/p300等的募集。CBP/p300是一种组蛋白乙酰基转移酶,可促进核小体上组蛋白乙酰化,使染色体结构松散,从而更有利于转录因子、RNA聚合酶与DNA的结合。CREB磷酸化后,必须与CRE结合,在CBP/p300的共同作用下才能发挥作用。影响CRE位点及CBP/p300募集的共激活因子包括CREB活性调节传导子 (transducers of regulated CREB activity ,TORC)、TOX3、神经细胞特异性转录因子4(LIM domain only4,LMO4)、下游监管元素拮抗剂调制器(Downstream regulatory element antagonist modulator,DREAM)和钙反应激活因子(Calcium responsive transactivator,CREST)、 血清效应因子(serum response factor,SRF)等。 运动可能通过影响这些共激活因子调控神经发生。
TORC1在成年脑内神经发生及突触可塑性中起重要作用。磷酸化的TORC1没有转录活性,Ca2+和cAMP可调节TORC1去磷酸化,从而调节海马神经元发生[35]。Ca2+水平增加,激活了钙调磷酸酶的活性,后者可使磷酸化的TORC1去磷酸化,从而激活CREB的转录。运动上调了谷氨酸水平,增加胞内Ca2+浓度,且运动激活GPCR,使cAMP表达增加[30]。因此,运动后Ca2+浓度及cAMP增加,介导TORC1的去磷酸化,TORC1去磷酸化后被转运至核内,结合CREB,促进CBP/p300的募集,作用于靶基因,引起脑内神经发生。
运动后NDMA、AMPA受体激活以及谷氨酸水平上升均能引起Ca2+内流[14,34]。 目前在Ca2+介导的CREB信号通路中发现了许多转录因子。TOX3是一种快速移动的盒蛋白,在CREB与CBP结合后起作用,激活神经元内相关基因的转录。敲除TOX3的小鼠神经元内,CREB介导的c-fos活性降低。并且TOX3的转录与CRE位点密切相关。有学者提出TOX3可能通过结合小沟和弯曲DNA,使CREB与CBP结合物靠近转录位点,从而促进转录[36]。LMO4在齿状回及嗅觉系统等成年脑内的中枢神经系统中高度表达,可调节轴突发育以及控制丘脑皮层模式和神经元密度[37]。Ca2+的流动激活了MAPK和CaMKIV,上调LMO4,促进神经元转录;同时LMO4也可被PKA通路激活。DREAM和CREST抑制CREB的转录。DREAM和CREB结合后抑制CBP的募集,Ca2+内流时,DRE释放出DREAM,抑制作用消除。总之,DREAM蛋白的减少促使CREB介导的基因转录增加,抵制神经元降解。CREST结合CREB后抑制皮质及海马神经元树突发育[38]。因此,运动引起Ca2+内流,上调了TOX3、LMO4,下调了DREAM、CREST,促进CBP的募集,激活神经元内相关基因的转录,调节神经发生。
SRF在海马齿状回颗粒细胞发生以及早期未成熟神经元迁移中起重要作用[39]。生长因子、神经营养因子以及神经元的活性可通过MAPKs、钙调激酶、Rho/肌动蛋白等信号通路,激活SRF或SRF辅助因子(包括MRTF、TCF),促使SRF与CREB结合,调节下游c-fos基因[40]。同时,大量实验已证实运动可上调BDNF、VEGF、IGF-1的表达[24,28,29],因此,运动还可能通过生长因子、营养因子等调节SRF,促进未成熟神经元迁移,神经颗粒细胞存活。
3.3 运动通过表观遗传修饰调节神经发生
表观遗传修饰可影响基因转录活性,但并不引起基因序列改变,包括DNA甲基化、miRNA的调控等。DNA甲基化和miRNA可调节CREB信号通路。CRE序列中含有CpG结构,可被DNA甲基化,CpG的甲基化可抑制其与CREB结合[41]。神经元活性可调节DNA甲基化,说明新生神经元可通过调节DNA的甲基化来激活CREB目的基因。CREB可与甲基CpG结合蛋白2 (methyl-CpG-binding protein 2,MeCP2)相互作用。MeCP2与甲基化的CpGs结合,募集抑制因子,改变染色体结构。然而有研究显示,MeCP2也可募集辅助因子,激活CREB特殊目的基因的转录[42]。MeCP2活性受到丝氨酸残基磷酸化以及去磷酸化的影响。神经元活性以及Ca2+的内流会激活CaMKII介导的MeCP2在Ser421的磷酸化,促进树突的形成和棘突的成熟[43]。BDNF是CREB的目的基因之一,有效的运动训练可降低BDNF基因启动子区域甲基化水平,加强BDNF基因转录,从而提高海马BDNF mRNA水平[44]。BDNF对于神经发生的促进效应已经得到证实。因此,运动可能通过降低DNA甲基化水平改善CREB目的基因BDNF的表达来影响神经发生。
miRNA是一类约有19~23个核苷酸大小的mRNA,主要通过RNA降解或翻译抑制来抑制mRNA的表达。有研究发现,某些miRNA(miR-132,miR-134等)在成年神经发生中调控干细胞存活、分化。CREB可通过miR-132和MeCP2调节神经元形态[45],而miR-134也可调节CREB转录后基因表达[46]。运动可通过调节肌肉特异性miRNA来调节肌细胞增殖分化,调控肌细胞发育。那么,运动是否通过miRNA调控神经发生呢?研究发现,BDNF通过TrkB/mTOR通路抑制miR-134促进Limk1的合成。敲除miR-134的大鼠海马神经元棘突的长度及宽度增加[47]。而且抑制miR-134会诱导CREB的活性[46],因此,运动可能通过BDNF抑制miR-134,增强CREB活性,调节神经发生。
4 小结与展望
运动不仅可促进成年鼠海马神经发生,还可抑制由年龄增加、AD等导致的神经发生的下降。并且成年海马齿状回神经发生一直伴随着CREB的磷酸化,说明运动可能通过CREB调控成年海马神经发生。 CREB磷酸化受到cAMP/PKA、Ca2+/CaMK、MAPK等通路调节,多种共激活因子(TORC、TOX3、LMO-4、SRF)可促进pCREB募集更多的CBP/p300,提高CREB基因转录水平,DNA甲基化、miRNA可直接作用于CREB靶基因,影响其表达。因此,运动对CREB的调控涉及到CREB磷酸化的调控、共激活因子对CREB转录水平的调控及CREB目的基因的调控。而运动通过哪一阶段调控CREB,从而调节神经发生,目前并不明确。现有的研究仅集中于运动影响CREB上游的BDNF等分子来调节神经发生。运动是否可通过某个信号转导通路来影响CREB的磷酸化从而调节神经发生,是否可通过营养因子、Ca2+等影响CREB相关的共激活因子来调节CREB的转录,是否可影响DNA甲基化或某些miRNA来影响CREB目的基因的转录,从而调节神经发生,这些问题在今后的研究中仍需进一步探索。
[1]Zhao C,Deng W,Gage FH.Mechanisms and functional implications of adult neurogenesis.Cell,2008,132 (4):645-660.
[2]Ma DK,Bonaguidi MA,Ming GL,et al.Adult neural stem cell in the mammalian central nervous system.Cell Res,2009,19(6):672-682.
[3]Van Praag H.Exercise and the brain:something to chew on.Trends Neurosci,2009,32(5): 283-290.
[4]Dupret D,Fabre A,Dobrossy MD,et al.Spatial learning depends on both the addition and removal of new hippocampal neurons.PLoS Biol,2007,5(8):e214.
[5]Herold S,Jagasia R,Merz K,et al.CREB-signalling regulates early survival,neuronal gene expression and morphological development in adult subventricular zone neurogenesis.Mol Cell Neurosci,2011,46(1):79-88.
[6]Jagasia R,Steib K,Englberger E,et al.GABA-cAMP response element binding protein signaling regulates maturation and survival of newly generated neurons in the adult hippocampus.Neurosci,2009,29(25):7966-7977.
[7]Fujioka T,Fujioka A,Duman RS.Activation of cAMP signaling facilitates the morphological maturation of newborn neurons in adult hippocampus.Neurosci,2004,24 (2):319-328.
[8]Giachino C,De Marchis S,Giampietro C,et al.cAMP response element-binding protein regulates differentiation and survival of newborn neurons in the olfactory bulb.Neurosci,2005,25(44):10105-10118.
[9]Kempermann G,Kuhn HG,Gage FH.More hippocampal neurons in adult mice living in an enriched environment.Nature,1997,386(6624):493-495.
[10]van Praag H,Kempermann G,Gage FH.Running increases cell proliferation and neurogenesis in the adult mouse dentate gyrus.Nat Neurosci,1999,2(3):266-270.
[11]Ehninger D,Kempermann G.Regional effects of wheel running and environmental enrichment on cell genesis and microglia proliferation in the adult murine neocortex.Cereb Cortex,2003,13(8):845-851.
[12]Kobilo T,Liu QR,Gandhi K,et al.Running is the neurogenic and neurotrophic stimulus in environmental enrichment.Learn Mem,2011,18(9):605-609.
[13]Kim SH,Kim HB,Jang MH,et al.Treadmill exercise increases cell proliferation without altering of apoptosis in dentate gyrus of Sprague-Dawley rats.Life Sci,2002,71(11): 1331-1340.
[14]Lou SJ,Liu JY,Chang H,et al.Hippocampal neurogenesis and gene expression depend on exercise intensity in juvenile rats.Brain Res,2008,1210:48-55.
[15]Snyder JS,Glover LR,Sanzone KM,et al.The effects of exercise and stress on the survival and maturation of adult-generated granule cells.Hippocampus,2009,19(10):898-906.
[16]Mustroph ML,Chen S,Desai SC,et al.Aerobic exercise is the critical variable in an enriched environment that increases hippocampal neurogenesis and water maze learning in male C57BL/6J mice.Neuroscience,2012,219:62-71.
[17]Michael WM,Michelle C,van Praag H,et al.Running throughout middle-Age improves memory function,hippocampalneurogenesis,and BDNF Levelsin female C57Bl/6J mice.Dev Neurobiol,2012,72(6):943-952.
[18]Lafenêtre P,Leske O,Ma-Z,et al.Exercise can rescue recognition memory impairment in a model with reduced adult hippocampal Neurogenesis.Front Behav Neurosci,2010,3:34-43.
[19]Adlard PA,Perreau VM,Pop V,et al.Voluntary exercise decreases amyloid load in a transgenic modelof Alzheimer’s disease.J Neurosci,2005,25 (17):4217-4221.
[20]Rodríguez JJ,Noristani HN,Olabarria M,et al.Voluntary running and environmental enrichment restores impaired hippocampal neurogenesis in a triple transgenic mouse model of Alzheimer’s disease.Curr Alzheimer Res,2011,8(7):707-717.
[21]Luo CX,Jiang J,Zhou QG,et al.Voluntary exercise-induced neurogenesis the postischemic dentate gyrus is associated with spatial memory recovery from stroke.J Neurosci Res,2007,85(8):1637-1646.
[22]Thakker VS,Alder J.Neuropeptides in depression: role of VGF.Behav Brain Res,2009,197(2):262-278.
[23]Huang FL,Huang KP,Wu J,et al.Environmental enrichment enhances neurogranin expression and hippocampal learning and memory but fails to rescue the impairments of neurogranin null mutant mice.J Neurosci,2006,26(23):6230-6237.
[24]Suijo K,Inoue S,Ohya Y,et al.Resistance exercise enhances cognitive function in mouse.Int J Sports Med,2012,10:1055-1064.
[25]Lee MC,Okamoto M,Liu YF,et al.Voluntary resistance running with short distance enhances spatial memory related to hippocampal BDNF signaling.J Appl Physiol,2012,113(8):1260-1266.
[26]Ji Y,Lu Y,Yang F,et al.Acute and gradual increases in BDNF concentration elicit distinct signaling and functions in neurons.Nat Neurosci,2010,13(3):302-309.
[27]Jeon SJ,Rhee SY,Seo JE,et al.Oroxylin A increases BDNF production by activation of MAPK-CREB pathway in rat primary cortical neuronal culture.Neurosci Res,2011,69(3):214-222.
[28]Fabel K,Tam B,Kaufer D,et al.VEGF is necessary for exercise-induced adult hippocampal neurogenesis.Eur J Neurosci,2003,18(10):2803-2812.
[29]Ding Q,Vaynman S,Akhavan M,et al.Insulin-like growth factor-1 interfaces with brain-derived neurotrophic factormediated synaptic plasticity to modulate aspects of exercise-induced cognitive function.Neuroscience,2006,140(3): 823-833.
[30]Ma Q.Beneficial effects of moderate voluntary physical exercise and its biological mechanisms on brain health.Neurosci Bull,2008,24(4):265-270.
[31]Doze VA,Perez DM.G-protein-coupled receptors in adult neurogenesis.Pharmacol Rev,2012,64(3):645-675.
[32]Ge S,Goh EL,Sailor KA,et al.GABA regulates synaptic integration of newly generated neurons in the adult brain.Nature,2006,439(7076):589-593.
[33]Platel JC,Dave KA,Gordon V,et al.NMDA receptors activated by subventricular zone astrocytic glutamate are critical for neuroblast survival prior to entering a synaptic network.Neuron,2010,65(6):859-872.
[34]Real CC,Ferreira AF,Hernandes MS,et al.Exercise-induced plasticity of AMPA-type glutamate receptor subunits in the rat brain.Brain Res,2010,1363:63-71.
[35]Screaton RA,Conkright MD,Katoh Y,et al.The CREB coactivator TORC2 functions as a calcium-and cAMP-sensitive coincidence detecto.Cell,2004,119(1):61-74.
[36]Yuan SH,Qiu Z,Ghosh A.TOX3 regulates calcium-dependent transcription in neurons.Proc NatlAcad Sci USA,2009,106(8):2909-2914.
[37]Joshi K,Lee S,Lee B,et al.LMO4 controls the balance between excitatory and inhibitory spinal V2 interneurons.Neuron,2009,61(6):839-851.
[38]Aizawa H,Hu SC,Bobb K ,et al.Dendrite development regulated by CREST,a calcium-regulated transcriptional activator.Science,2004,303(5655):197-202.
[39]Knoll B,Kretz O,Fiedler C,et al.Serum response factor controls neuronal circuit assembly in the hippocampus.Nat Neurosci,2006,9(2):195-204.
[40]Ravnskjaer K,Kester H,Liu Y,et al.Cooperative interactions between CBP and TORC2 confer selectivity to CREB target gene expression.EMBO J,2007,26 (12):2880-2889.
[41]Zhang X,Odom DT,Koo SH,et al.Genome-wide analysis of cAMP-response element binding protein occupancy,phosphorylation,and target gene activation in human tissues.Proc Natl Acad Sci USA,2005,102 (12):4459-4464.
[42]Chahrour M,Jung SY,Shaw C,et al.MeCP2,a key contributor to neurological disease,activates and represses transcription.Science,2008,320(5880):1224-1229.
[43]Zhou Z,Hong EJ,Cohen S,et al.Brain-specific phosphorylation of MeCP2 regulates activity-dependent Bdnf transcription,dendritic growth,and spine maturation.Neuron,2006,52(2):255-269.
[44]Gomez Pinilla F,Zhuang Y,Feng J,et al.Exercise impacts brain derived neurotrophic factor plasticity by engaging mechanisms of epigenetic regulation.Eur J Neurosci,2011,33(3):383-390.
[45]Vo N,Klein ME,Varlamova O,et al.A cAMP-response element binding protein-induced microRNA regulates neuronal morphogenesis.Proc Natl Acad Sci USA,2005,102(45):16426-16431.
[46]Gao J,Wang WY,Mao YW,et al.A novel pathway regulates memory and plasticity via SIRT1 and miR-134.Nature,2010,466(7310):1105-1109.
[47]Schratt GM,Tuebing F,Nigh EA,et al.A brain-specific microRNA regulates dendritic spine development.Nature,2006,439(16):283-289.
