脂多糖诱导的慢性阻塞性肺病模型大鼠肺支气管上皮MRP1功能分析
2014-05-10汪珊珊汪电雷陶秀华汪辰吟陈金佩杨丽丽曹银
汪珊珊,汪电雷,,陶秀华,汪辰吟,陈金佩,杨丽丽,曹银
(1.安徽中医药大学药学院,合肥 230038;2.安徽中人科技有限责任公司药理组,合肥 230088; 3.安徽合肥市精神病医院药剂科,合肥 230022)
研究报告
脂多糖诱导的慢性阻塞性肺病模型大鼠肺支气管上皮MRP1功能分析
汪珊珊1,汪电雷1,,陶秀华2,汪辰吟1,陈金佩1,杨丽丽1,曹银3
(1.安徽中医药大学药学院,合肥 230038;2.安徽中人科技有限责任公司药理组,合肥 230088; 3.安徽合肥市精神病医院药剂科,合肥 230022)
目的分析脂多糖(LPS)造模方法对慢性阻塞性肺疾病(COPD)模型大鼠的肺支气管上皮细胞多药耐药相关蛋白1(MRP1)功能的影响。方法利用LPS造模方法制备COPD模型大鼠,设置正常对照组、造模14 d组和造模28 d组,分别测定其呼吸功能;以酚红外排水平评价大鼠肺支气管上皮MRP1的功能;同时采用免疫组化法分析各组大鼠肺支气管上皮MRP1的表达。结果与正常对照组比较,LPS处理组造模进程中随时间的延长大鼠的各项肺功能指标明显下降;静脉给予酚红后其BALF中酚红浓度与血浆酚红浓度的比值降低;其肺支气管上皮MRP1蛋白表达显著性降低。结论LPS造模方法制备COPD模型大鼠,随着造模的进程,其肺支气管上皮细胞MRP1蛋白的功能随之下调。
脂多糖;慢性阻塞性肺疾病;多药耐药相关蛋白1;功能;表达;大鼠
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)具有高致死和致残等特点,是呼吸系统常见疾病之一,其发病率、死亡率呈逐年增加态势。由于很多实验研究不适合在人体上实施,因此,动物模型在研究COPD发病机制方面起着重要的作用。目前COPD动物模型造模的方法有吸入剂模型(吸烟模型、SO2模型、NO2模型、氧化剂和颗粒刺激等)、脂多糖(lipopolysaccharide,LPS)模型、组织降解模型、基因调控模型、复合模型[1]等。其中烟熏法和人类COPD的疾病特征最为接近,吸烟模型的动物可以建立起诸多病理特征,如慢性炎症、肺气肿、肺动脉高压及气道重塑等[2]。多药耐药相关蛋白 1(multidrug resistance-associated protein 1, MRP1)是在肺部氧化应激及化学异物或毒物的外排中起着关键性保护作用的外排蛋白[3]。前期研究表明,药物可以通过上调MRP1的功能来发挥治疗COPD的作用[4-5],因此建立合适的动物模型来满足药物的评价要求至关重要。虽然前期研究表明,烟熏复合雾化吸入木瓜蛋白酶法能成功复制出COPD模型,且MRP1表达呈进行性下降[6],但其造模时间长,影响因素较多等不足,这类模型仍有待进一步开发。LPS模型可引起肺功能下降、肺气肿、小气道重塑,产生肺部炎症等[7]。且LPS模型手术简单,复制时间短,影响因素较少,理论上认为其可代替烟熏法。但据报道[8],LPS能够使RAW 264.7巨噬细胞的MRP1转运体功能和表达增加,LPS诱导的COPD模型是否能引起肺支气管上皮细胞MRP1转运体功能的改变,以及这种模型能否用于基于改变MRP1转运体的功能发挥治疗COPD的药物研究仍需进一步探索。因此,本文在 LPS诱导制备COPD模型基础上,评价其肺支气管上皮细胞MRP1转运体的功能,同时通过免疫组化法对其肺支气管上皮细胞MRP1的表达进行研究。为研究COPD状态下MRP1功能或者药物基于影响MRP1功能而具有治疗COPD作用的研究提供进一步的参考。
1 材料与仪器
1.1 动物
普通级Wistar雄性大鼠30只,鼠龄8周,体重(200±20)g。由安徽省全椒安立实验动物有限公司提供【SCXK(苏)2002-0002】。动物实验在安徽医科大学实验动物中心进行【SYXK(皖)2005-0002】。
1.2 试剂
LPS(Sigma公司,批号:20120429223);酚红(天津市凯通化学试剂有限公司,批号:20080910); NaHCO3(国药集团化学试剂有限公司,批号: F20100113);0.9%生理盐水(安徽丰原药业股份有限公司,批号:100803K6);NaOH(上海化学试剂有限公司,批号:030124)。一抗兔抗鼠MRP1抗体(Santa Cruz公司);二抗生物素化山羊抗兔工作液(北京中杉金桥生物技术有限公司)。
1.3 仪器
TGL-16GB台式高速离心机(上海安亭科学仪器厂);徕卡RM2016轮转式切片机(上海徕卡仪器有限公司);亚鹏BM-IX生物组织包埋机(湖北省孝感市宏业医用仪器有限公司);AniRes2005型肺功能仪(北京贝兰博科技有限公司);721型分光光度计(上海第三分析仪器厂);亚鹏CS-Ⅵ型摊片烤片机(湖北省孝感市宏业医用仪器有限公司);亚鹏TS-12A生物组织自动脱水机(湖北省孝感市宏业医用仪器有限公司)。
2 方法
2.1 酚红标准溶液的配制
精密称取酚红10.00 mg,用5%NaHCO3溶液溶解后,用 pH 8.95的0.9%生理盐水定容至10 mL,配制成1 mg/mL的酚红储备液。
2.2 动物实验
2.2.1 LPS模型实验分组及COPD模型的建立
大鼠正常饲养7 d后进行实验,随机分为正常对照组、造模14 d组、造模28 d组,每组各10只。实验前均禁食不禁水12 h。造模14 d组大鼠于造模的第1天,造模28 d组大鼠于造模的第1天和第14天分别用乌拉坦(2 g/kg)腹腔注射麻醉后暴露气管,用1 mL注射器向气管内注入200μg LPS,手术完成后缝合,正常饲养[9-10]。
2.2.2 呼吸功能测定
将正常对照组、造模14 d组、造模28 d组大鼠用乌拉坦(2 g/kg)腹腔注射麻醉,然后切开气管,插管,结扎,放置于小动物呼吸机内,检测第0.3秒用力呼气容积(FEV0.3%)及其占预计值的百分比(FEV%),最大呼气中段流量(MMF),呼气流量峰值(PEF)及肺顺应性(Cldyn)。
2.2.3 肺上皮细胞MRP1转运体功能的评价
以MRP1底物酚红作为工具药,测定大鼠静脉注射酚红后肺泡灌洗液(BALF)中酚红浓度与血浆中酚红浓度的比值,作为评价COPD大鼠肺支气管上皮细胞MRP1的功能指标[11]。各组大鼠分别由尾静脉注射1% 酚红生理盐水溶液(25 mg/kg)。30 min后腹主动脉采血置于经肝素钠处理的EP管中,离心10 min(3000 r/min),取血浆0.2 mL加入NS-NaOH(1 mol/L)溶液(29∶1)稀释液3 mL,混匀,以545 nm为测定波长,采用分光光度法测定其吸光度[12]。同时分离气管插入磨平的9号注射针头,用5%NaHCO3溶液(3 mL)冲洗3次,冲洗液合并(回收率70%~80%),离心,得到红色透明上清液,即BALF,以545 nm为测定波长,采用分光光度计测定其吸光度[13-15]。
2.2.4 免疫组化检测分析
采用免疫组化S-P的方法。取LPS模型组大鼠的右肺中叶石蜡切片,脱蜡、水化;细胞通透、封闭内源性过氧化物酶;抗原修复暴露抗原决定族;封闭非特异性蛋白;滴加一抗即兔抗鼠 MRP1抗体(1∶150),4℃孵育过夜;滴加二抗即生物素化山羊抗兔工作液;DAB显色,苏木素复染胞核,逐级乙醇脱水,透明;中性树胶封片,显微镜观察。在200倍视野下,选择肺组织分布均匀、染色均匀的视野摄片,采用IPP 6.0软件进行分析[16]。
2.3 统计学方法
3 结果
3.1 不同组别间大鼠肺功能指标测定结果比较
将正常对照组、造模14 d组、造模28 d组大鼠进行肺功能指标测定。其结果见表1。
结果表明:与正常对照组比较,造模14 d组大鼠的各项肺功能有下降的趋势;而造模28 d组大鼠各项肺功能指标差异有显著性(P<0.05)。
3.2 不同组别间BALF中酚红浓度与血浆中酚红浓度的比值比较
正常对照组、造模14 d组、造模28 d组大鼠BALF中酚红浓度及其血浆中酚红浓度进行测定,其结果见表2。
表1 不同组别间大鼠肺功能指标测定结果比较(±s,n=10)Tab.1 Comparison of the pulmonary function in the rats of different groups
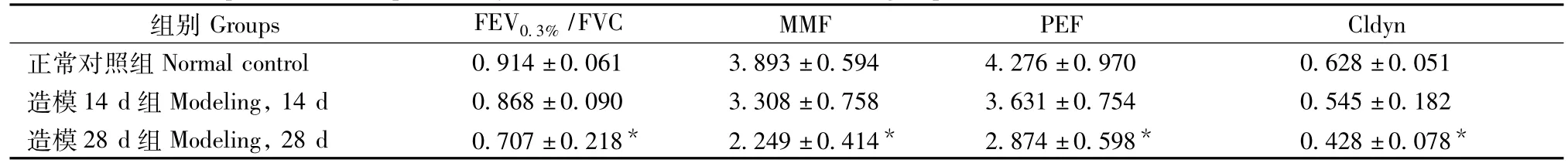
表1 不同组别间大鼠肺功能指标测定结果比较(±s,n=10)Tab.1 Comparison of the pulmonary function in the rats of different groups
注:与正常对照组比较,Note:*P<0.05。Note:Compaed with the normal control group,*P<0.05.
组别Groups FEV0.3%/FVC MMF PEF Cldyn正常对照组Normal control 0.914±0.061 3.893±0.594 4.276±0.970 0.628±0.051造模14 d组Modeling,14 d 0.868±0.090 3.308±0.758 3.631±0.754 0.545±0.182造模28 d组Modeling,28 d 0.707±0.218*2.249±0.414*2.874±0.598*0.428±0.078*
表2 不同组别间BALF中酚红浓度及其与血浆中酚红浓度的比值比较(±s,n=10)Tab.2 Concentrations and ratios of phenol red in the BALF and plasma of rats in different groups
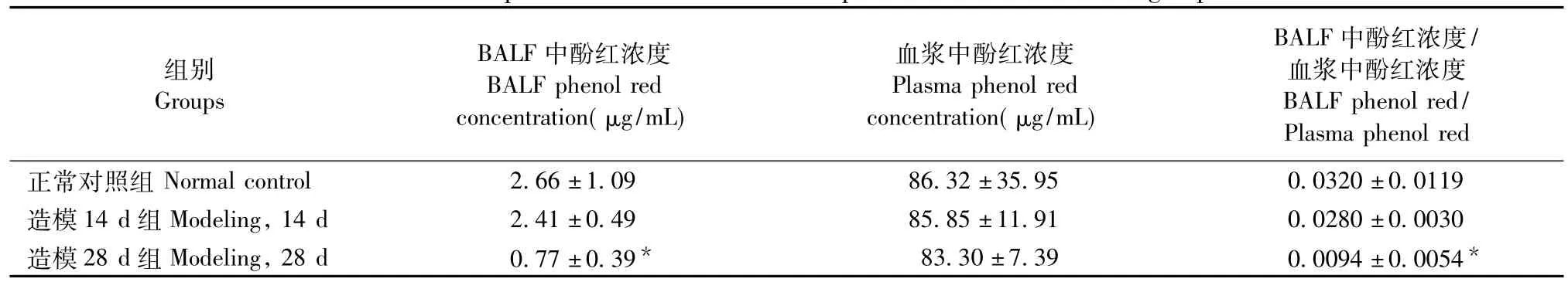
表2 不同组别间BALF中酚红浓度及其与血浆中酚红浓度的比值比较(±s,n=10)Tab.2 Concentrations and ratios of phenol red in the BALF and plasma of rats in different groups
注:与正常对照组比较。Note:Compared with the normal control group,*P<0.05.
BALF中酚红浓度/血浆中酚红浓度BALF phenol red/ Plasma phenol red正常对照组Normal control 2.66±1.09 86.32±35.95 0.0320±0.0119造模14 d组Modeling,14 d 2.41±0.49 85.85±11.91 0.0280±0.0030造模28 d组Modeling,28 d 0.77±0.39*83.30±7.39 0.0094±0.0054组别Groups BALF中酚红浓度BALF phenol red concentration(μg/mL)血浆中酚红浓度Plasma phenol red concentration(μg/mL)*
结果表明:与正常对照组比较,大鼠静脉给予酚红后,造模进程中BALF中酚红的浓度,血浆中酚红的浓度以及BALF中酚红浓度/血浆中酚红浓度均有下降的趋势,同时造模28 d后,BALF中酚红的浓度以及BALF中酚红浓度/血浆中酚红浓度值显著降低,有统计学意义(P<0.05)。
3.3 LPS模型各组大鼠肺支气管上皮MRP1表达的比较
各组大鼠肺组织免疫组化中MRP1表达用平均光密度值表示,结果分别为正常对照组(0.388± 0.102);造模14 d组(0.230±0.923);造模28 d组(0.187±0.040)。正常对照组中(图1A),MRP1蛋白表达较强(棕黄色颗粒为阳性产物);而在LPS模型组(图1B,图1C)中表达降低,与正常组比较,其平均光密度均降低,且造模28 d组有统计学意义(P<0.05)(图1见彩插5)。
4 讨论
前期在调研相关文献后,我们采用烟熏复合雾化吸入木瓜蛋白酶法复制出COPD模型大鼠,能成功用于基于影响MRP1功能药物评价研究[5],但实验过程繁琐,模型不稳定,需要控制的因素较多。为了进一步探索复制的模型更简便、可靠、均一的特点,同时更利于验证COPD状态下肺支气管上皮细胞MRP1的改变,及基于影响MRP1功能而具有治疗COPD作用的药物研究,本研究采用LPS诱导大鼠的COPD模型,观察其肺支气管上皮MRP1表达和功能的改变。因LPS诱导的COPD模型是成熟的模型制备方法,所以在研究中我们仅以肺功能测定的改变为其特征说明是否已成功复制出COPD模型大鼠,其COPD的病理变化参考马楠[9]首次利用LPS注入气管成功复制出大鼠慢性支气管炎模型,研究表明其符合COPD病理变化。试验中为表现COPD疾病形成过程中,其肺支气管上皮MRP1表达和功能的变化,在造模过程中,选择14 d及造模成功后分析,即设造模14 d组与造模28 d组。理想的COPD大鼠模型应具有与人类疾病相一致的以气流受限为特征的肺功能改变,故实验中测定了FEV0.3%/FVC,MMF,PEF,Cldyn这几个反映大鼠肺功能的指标,结果显示与正常对照组相比,造模14 d组大鼠肺功能下降,造模28 d组大鼠的肺功能显著性降低(表1,P<0.05),这表明LPS诱导的大鼠COPD模型复制成功,同时LPS处理组造模进程中,随时间的延长大鼠的各项肺功能指标明显下降。与烟熏复合雾化吸入木瓜蛋白酶法相比,LPS法简便、省时、省力、影响因素小且成功率高。
MRP1是一种依赖于ATP介导底物跨膜转运蛋白,是ABC转运家族中的重要一员,在正常人肺支气管上皮细胞高度表达[17-18],能对吸入性化学异物或毒物以及体内内源性物质起外排作用,所以与肺部的屏障作用密切相关。通过免疫组化实验发现,COPD患者的支气管上皮细胞中MRP1的表达会减少,重度COPD患者比中度COPD患者支气管上皮细胞中MRP1表达减少[19]。据报道,在体外细胞中可利用特异性底物的外排水平来评价MRP1的功能,而在体评价MRP1功能的方法较少。故在前期研究中,课题组选用MRP1的特异性底物——酚红作为工具药,利用其外排水平来评价肺上皮细胞MRP1的功能[11]。本实验主要以 BALF中酚红浓度/血浆中酚红浓度的比值来评价MRP1的功能,这一指标即直接反映了COPD模型大鼠肺部MRP1的外排水平也排除了因血浆中酚红浓度不同带来的误差。实验数据显示,造模14 d大鼠BALF中酚红的浓度以及BALF中酚红浓度/血浆中酚红浓度均下降,而造模28 d大鼠BALF中酚红的浓度以及BALF中酚红浓度/血浆中酚红浓度值显著降低,且均有统计学意义(表2,P<0.05)。造模14 d和造模28 d组大鼠血浆中酚红浓度与正常对照组比较有所降低但差异无显著性,研究表明大鼠肺支气管上皮细胞MRP1的功能随着COPD造模进程逐渐下调。
同时,为进一步分析COPD模型大鼠肺支气管上皮MRP1的功能改变是否与其表达有关,我们采用免疫组化对其蛋白水平分析,图1可明显发现,正常对照组MRP1表达呈强阳性,与正常组比较,造模14 d组平均光密度值降低,造模28 d组平均光密度值降低显著降低。这从另一方面证明肺支气管上皮MRP1蛋白的功能在COPD造模过程中逐渐下调。
综上所述,本实验利用LPS复制的COPD模型大鼠,随着造模的进程,其肺支气管上皮细胞MRP1蛋白的功能随之下调。所复制的COPD大鼠模型在肺支气管上皮细胞MRP1转运体功能的改变上,与本实验室前期研究的基于烟熏复合雾化吸入木瓜蛋白酶法复制出COPD模型,其MRP1表达和功能上无明显区别。因此,该模型能用于基于MRP1转运体的COPD的发生、发展规律奠定基础,以及基于改变MRP1转运体的功能发挥治疗COPD的药物评价研究,同时为在临床上药物通过逆转MRP1功能的COPD的治疗提供了新思路与方法。
(本文图1见彩插5。)
[1] Groneberg DA,Chung KF.Models of chronic obstructive pulmonary disease[J].Resp Res,2004,5(18):1-16.
[2] 范励侦.慢性阻塞性肺疾病动物模型研究进展[J].福建医药杂志,2011,33(1):139-141.
[3] Cole SP,Bhardwaj G,Gerlach JH,et al.Overexpression of atransporter gene in a multidrug-resistant human lung cancer cell line[J].Science,1992,258:1650-1654.
[4] Van der Deen M,Homan S,Timmer-Bosscha H,etal.Effectof COPD treatments on MRP1-mediated transport in bronchial epithelial cells[J].Int J Chron Obstruct Pulmon Dis,2008,3 (3):469-475.
[5] 汪电雷,张弦,陶秀华,等.化痰降气胶囊对COPD模型大鼠支气管上皮细胞中多药耐药相关蛋白1功能和表达的影响[J].中国中西医结合杂志,2012,32(7):955-959.
[6] 汪电雷,张弦,陶秀华,等.慢性阻塞性肺疾病大鼠支气管上皮MRP1 mRNA及蛋白水平变化及化痰降气方逆转的作用[J].中国临床药理学与治疗学,2012,17(6):621-626.
[7] Vernooy JH,Dentener MA,van Suylen RJ,etal.Long-term intratracheal lipopolysaccharide exposure in mice results in chronic lung inflammation and persistent pathology[J].Am J Respir Cell Mol Biol,2002,26(1):152-159.
[8] Silverstein PS,Audus KL,Qureshi N,et al.Lipopolysaccharide increases the expression ofmultidrug resistance-associated protein 1(MRP1)in RAW 264.7 macrophages[J].J Neuroimmune Pharmacol.2010,5(4):516-520.
[9] 马楠,崔德健,梁延杰,等.气管内注入脂多糖法建立大鼠慢性支气管炎模型[J].中华结核与呼吸杂志,1999,22 (6):371-372.
[10] 宋一平,崔德健,茅培英.慢性阻塞性肺疾病大鼠模型的建立及药物干预的影响[J].中华内科杂志,2000,39(8):56.
[11] 陶秀华,汪电雷,曹银,等.酚红外排水平评价肺上皮细胞多药耐药相关蛋白1的功能[J].中国临床药理学与治疗学,2013,18(2):127-131.
[12] 李秀国,于海玲,李迎军,等.两种急性肾衰家兔模型的酚红药动学比较[J].沈阳药科大学学报,2010,27(11):924 -927.
[13] 徐叔云.药理实验方法学(1版)[M].北京:人民卫生出版社,1985:523.
[14] 刘文彬.大鼠支气管肺泡灌洗方法的研究进展[J].临床肺科杂志,2012,17(4):704-706.
[15] 杨光涛,徐东群,毛彩霞,等.DEHP对哮喘模型大鼠气道高反应性和肺嗜酸性粒细胞浸润的影响[J].环境科学学报,2008,28(5):995-1000.
[16] 王文勇,黄晓峰,王映梅,等.免疫组化技术标准化的探讨[J].细胞与分子免疫学杂志,2011,27(8):927-929.
[17] Van der Deen M,de Vries EG,TimensW,et al.ATP-binding cassette(ABC)transporters in normal and pathological lung[J].Respir Res,2005,6(1):59-74.
[18] Scheffer GL,Pijnenborg AC,Smit EF,et al.Multidrug resistance related molecules in human and murine lung[J].JClin Pathol,2002,55(5):332-339.
[19] Deen M,Marks H,Willemse BW,et al.Diminished expression of multidrug resistance-associated protein 1(MRP1)in bronchial epithelium of COPD patients[J].Virchows Arch,2006, 449(6):682-688.
MRP1 expression and bronchial epithelial function in lipopolysaccharideinduced ratmodel of chronic obstructive pulmonary disease
WANG Shan-shan1,WANG Dian-lei1,TAO Xiu-hua2,WANG Chen-yin1,CHEN Jin-pei1,YANG Li-li1,CAO Yin3
(1.College of Pharmacy,Anhui University of Chinese Medicine,Hefei230038,China;2.Pharmacology Dept, Anhui Sino-Implant Co.,Ltd,Hefei230038; 3.Pharmacy Dept,the Fourth People’s Hospital of Hefei,Hefei230022)
ObjectiveTo study the impact of establishment of lipopolysaccharide(LPS)-induced ratmodel of chronic obstructive pulmonary disease(COPD)on the function ofmultidrug resistance-associated protein 1(MRP1)in the rat bronchial epithelium.M ethodsUsing intratracheal instillation of LPS to establish COPD ratmodel.8-week old healthy maleWistar rats were divided into 3 groups(10 rats in each group):(1)Normal control;(2)Modeling for 14 days after LPS instillation;(3)Modeling for28 days after LPS instillation.Pulmonary function and the concentration of phenol red in bronchoalveolar lavage fluid(BALF)and plasma were measured.The ratio of phenol red concentration in BALF/plasma was used as an index of the MRP1 function in the ratbronchial epithelium and the expression ofMRP1 in the bronchialepithelium was also observed by immunohistochemistry.ResultsCompared with the normal group,the pulmonary functions of the rats in themodel groupswere significantly reduced alongwith themodeling progress.After intravenous administration of phenol red,the ratio of phenol red concentration in BALF/plasmawas gradually reduced,and the expression ofMRP1 in the bronchial epithelium was significantly decreased.ConclusionsCOPD ratmodel can be established by intratrachealLPS instillation,and the function ofMRP1 in bronchial epithelium was gradually reduced alongwith themodeling progress.
Lipopolysaccharide;Chronic obstructive pulmonary disease;Multidrug resistance-associated protein 1;Function;Expression;Rat
Q95-33
A
1005-4847(2014)03-0030-05
10.3969/j.issn.1005-4847.2014.03.006
2013-10-29
国家重大新药创制资助项目(No 2009ZX09103-399);国家自然科学基金资助项目(No 81001592);教育部科学技术重点项目(No 210101);安徽高校省级自然科学研究重点项目资助(No KJ2010A210,KJ2012A186)。
汪珊珊(1989-),女,硕士研究生,药物代谢动力学研究,Tel:13956913874,E-mail:277024827@qq.com
汪电雷(1977-),男,硕导,副教授,药物代谢动力学研究,Tel:(0551)5169230,E-mail: dlwang@ahtcm.edu.cn
