创伤失血性休克大鼠肠系膜淋巴液对血管内皮细胞程序性坏死的影响
2014-05-08王林林于金宝张立亚王玉亮崔尧丽王勇强
王林林,王 兵,于金宝,张立亚,王玉亮,崔尧丽,王勇强
(1天津医科大学一中心临床学院,天津300070;2天津市第一中心医院重症医学科天津市急救医学研究所;3卫生部危重病急救医学重点实验室)
自上世纪80年代提出肠源性学说[1]以来,多器官功能障碍综合征(MODS)的发病机制得到了进一步解释,肠系膜淋巴液导致急性肺损伤/急性呼吸窘迫综合征(ALI/ARDS)的机制也得到进一步验证[2]。实验表明,创伤失血性休克(THS)肠系膜淋巴液能够导致血管内皮细胞凋亡和坏死[3]。近年来,研究证实在有些情况下细胞坏死也是由基因控制的、有序的过程[4],这个过程能被 Necrostatin-1(Nec-1)特异性阻断[5]。Nec-1是细胞程序性坏死的特异性阻滞剂,它能够特异性结合细胞程序性坏死传导通路中的关键酶。2013年3~7月,我们观察了THS肠系膜淋巴液能否导致血管内皮细胞程序性坏死,以及能否被Nec-1阻断。
1 材料与方法
1.1 材料 清洁级健康成年雄性SD大鼠12只,体质量280~320 g,购于中国人民解放军军事医学科学院实验动物中心,许可证号:SCXK-(军)20070004;饲养于采用明暗各12 h、25℃恒温的隔离系统动物房内,适应期至少7 d,实验前禁食12 h。多导生理记录仪(美国AD公司),酶标仪(美国伯乐公司),垂直电泳仪(美国伯乐公司),凝胶成像分析仪(美国伯乐公司),移液枪(德国艾本德公司);MTT细胞活性检验试剂盒,人脐静脉内皮细胞(HUVECs),二甲基亚砜(DMSO);抗体:鼠抗受体交互体用蛋白(RIP)抗体(1∶2 000,BD 公司),RIP3(H-43):SC-135170(1∶200,Santa Cruz公司),Anti-GAPDH单克隆抗体(1∶2 500,EarthOx公司),羊抗兔 IgG(1∶1 000,Immuno Reagents公司),羊抗鼠IgG(1∶1 000,Immuno Reagents公司)。
1.2 方法
1.2.1 动物分组与模型制备 将大鼠随机分为手术(T/HS)组与假手术(T/SS)组,每组6只。T/HS组以戊巴比妥钠50 mg/kg腹腔麻醉,置于手术台,用加热毯及热灯保持大鼠肛温37℃。术前准备后行5 cm腹部正中切口,左侧颈内动脉插管监测动脉血压,右侧股静脉插管用于放血及输血。左旋内脏暴露肠系膜淋巴管,硅胶导管插管并于右侧腹壁穿出引入置于冰袋上的无菌离心管,双层缝合腹部切口。以1 mL/min静脉血放入含10 U肝素钠(溶于0.3 mL生理盐水)的无菌注射器至动脉血压为30 mmHg,后通过放或注入血维持动脉血压30~40 mmHg。90 min后以自身血及2倍放血量的林格液复苏。T/SS组大鼠仅手术切开,不放血及输血。
1.2.2 肠系膜淋巴液收集 自复苏开始时收集肠系膜淋巴液,持续3 h。收集完成后,以1 500 r/min离心15 min去除内含细胞。用PBS以1∶1稀释后,立即-80℃保存备用。使用时,肠淋巴液终浓度为5%。
1.2.3 肠系膜淋巴液对HUVECs活性及程序性坏死影响的观察 根据文献资料,以HUVECs替代大鼠肺血管内皮细胞。取在内皮细胞生长培养基中传代2 ~3 代的 HUVECs,以2 ×104/孔(200 μL)接种与96孔细胞培养板,培养24 h。将细胞分为3组,T/HS、T/SS组分别加入1∶1稀释的T/HS、T/SS大鼠肠系膜淋巴液,对照组加入20 μL PBS;培养3 h后,应用MTT细胞活性检验试剂盒检验HUVECs活性,并以无细胞的空白孔细胞活性为100%。在5 mL细胞培养皿中培养细胞,孵育3 h后提取蛋白质,应用Western blot法检测程序性坏死的特异性蛋白RIP1和 RIP3。按说明书操作,以目标蛋白与GAPDH光密度比值作为RIP1和RIP3表达量。
1.2.4 Nec-1对 THS肠系膜淋巴液处理 HUVECs活性及程序性坏死影响的观察 将HUVEC以2×104/孔(200 μL)接种96孔细胞培养板,培养24 h。将细胞分为6组,A(D)、B(E)、C(F)组分别加入20 μL PBS、0.2 μL 浓度为 100 mmol/L Nec-1、溶媒DMSO预处理1 h,D、E、F组分别加入1∶1稀释的T/HS大鼠肠系膜淋巴液。孵育3 h后,观察细胞活性及细胞程序性坏死情况,方法同1.2.3。
1.2.5 统计学方法 采用SPSS18.0统计软件。数据以±s表示,采用单因素方差分析(ANOVA)。P≤0.05为差异有统计学意义。
2 结果
2.1 肠系膜淋巴液对HUVECs活性及程序性坏死的影响 各组HUVECs活性及 RIP1、RIP3相对表达量比较,见表1、图1。
2.2 Nec-1对THS肠系膜淋巴液处理HUVECs活性及程序性坏死的影响 各组HUVECs活性及RIP1、RIP3相对表达量比较,见表2、图2。
3 讨论
随着上个世纪医学科技的发展,单一器官、系统衰竭的病死率已大大降低,但随之而来的是先期存活患者发生MODS的几率大大增加[6]。创伤是导致40岁以下患者死亡的首要原因,在外科重症监护病房中MODS占到死亡原因的50% ~80%[7],但是严重创伤引起远隔器官的损伤机制还不甚明了。在MODS产生机制的众多学说中,肠源性学说占有重要地位。Glenn等[8]首先提出,T/HS导致内脏低灌注产生的有害因子通过淋巴管进入血液循环。此学说经过 Moore实验室[9]和 Deitch 等[10]的发展,认为导致T/HS后终末器官损伤的因子是由缺血的肠产生,并经肠系膜淋巴管进入腹腔淋巴管,然后经胸导管经锁骨下静脉入血;肺脏首先接受这些血液,因而肺常常先于其他器官出现损伤,并且通过结扎肠淋巴管能够减轻肺脏的损伤。因而,获取T/HS肠系膜淋巴液,使我们可以在体外条件下研究其可能的细胞损伤机制。研究发现,T/HS肠系膜淋巴液能够增加血管内皮细胞通透性[11]、上调内皮细胞黏附因子的表达[12]、活化中性粒细胞[13]。但是,大量的实验并没有明确其中的毒性物质,包括细菌或其产物、内毒素[14]、肿瘤坏死因子及其他细胞因子,均不存在于其中。最新研究认为,T/HS肠淋巴含有的游离脂肪酸是重要的内皮细胞毒素,其中亚油酸毒性最强[15]。
表1 各组HUVECs活性及RIP1、RIP3相对表达量比较(±s)
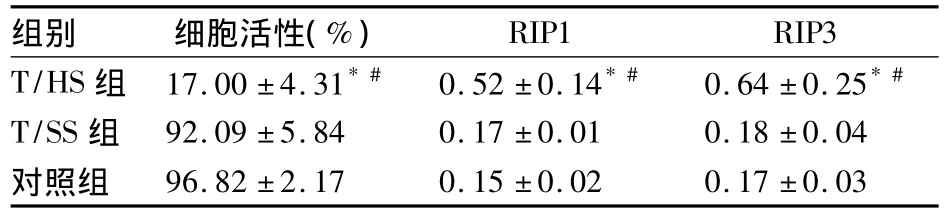
表1 各组HUVECs活性及RIP1、RIP3相对表达量比较(±s)
注:与对照组比较,*P <0.01;与 T/SS组比较,#P <0.01
RIP1 RIP3 T/HS 组 17.00 ±4.31*# 0.52 ±0.14*# 0.64 ±0.25*#组别 细胞活性(%)T/SS 组 92.09 ±5.84 0.17 ±0.01 0.18 ±0.04对照组96.82 ±2.17 0.15 ±0.02 0.17 ±0.03

图1 肠系膜淋巴液对HUVECs中RIP1、RIP3表达的影响
表2 Nec-1对各组HUVECs活性及RIP1、RIP3相对表达量的影响(±s)

表2 Nec-1对各组HUVECs活性及RIP1、RIP3相对表达量的影响(±s)
注:与其他各组比较,#P <0.01
RIP1 RIP3 A组组别 细胞活性(%)94.62 ±3.38 0.15 ±0.03 0.19 ±0.03 B 组 92.12 ±5.46 0.17 ±0.04 0.17 ±0.05 C 组 92.55 ±4.27 0.16 ±0.02 0.21 ±0.07 D 组 18.61 ±3.00 0.47 ±0.12 0.62 ±0.22 E 组 31.97 ±7.51# 0.36 ±0.14# 0.40 ±0.17#F组20.22 ±5.35 0.51 ±0.09 0.64 ±0.19

图2 Nec-1对THS肠系膜淋巴液处理HUVECs中RIP1、RIP3表达的影响
肺血管内皮损伤是T/HS肺损伤发生的重要病理过程,其损伤包括凋亡与坏死[3]。本研究目的在于观察T/HS肠系膜淋巴液导致的血管内皮细胞坏死是否存在程序性坏死。程序性坏死是新近发现的一种由基因控制的、有序的过程[5],其主要发生机制[16]是“死亡受体—RIP—线粒体—氧自由基通路”。死亡受体活化后迅速形成聚体,随后RIP1与之结合形成复合物,内吞作用使得RIP1进入细胞,此时RIP1与死亡受体解离并与RIP3形成复合物Ⅱ。复合物Ⅱ能够招募Caspase-8,Caspase-8聚集引起复合物Ⅱ降解,从而进入死亡受体诱导的凋亡通路,当Caspase-8不足以降解复合物Ⅱ时,RIP3活化并作用于能量代谢相关的酶,从而大量的氧自由基产生损伤细胞,致使细胞坏死。RIP1与RIP3在其中起重要作用,Nec-1能够特异性阻断RIP1与RIP3的相互磷酸化,从而阻断复合物Ⅱ的形成及信号的向下传导[17]。
参照以往的实验,我们以HUVECs替代肺血管内皮细胞,使用终浓度为5%的肠系膜淋巴液以达到其在大鼠血液中的浓度[18],并应用MTT细胞活性试剂盒检测细胞活性及Western blot法检测程序性坏死特异性蛋白RIP1、RIP3相对含量。我们首先对比了T/HS及T/SS肠系膜淋巴液对HUVECs程序性坏死的影响。结果表明,T/HS肠系膜淋巴液对内皮细胞的毒性明显高于T/SS肠系膜淋巴液,并使HUVECs中程序性坏死特异性蛋白RIP1和RIP3相对含量明显升高。随后应用特异性抑制剂Nec-1观察其对HUVECs程序性坏死的影响。结果显示,加入Nec-1的E组HUVECs活性显著高于没有加入的D、F组,并且RIP1、RIP3的相对含量明显低于 D、F组;同时,与 A、B、C 组比较,E 组 HUVECs活性显著降低、RIP1和RIP3相对含量显著升高。说明Nec-1能够部分抑制T/HS肠系膜淋巴液对HUVEC程序性坏死的作用。
综上所述,T/HS大鼠肠系膜淋巴液能够引起血管内皮细胞程序性坏死,在血管内皮细胞损伤中占有一定比例;Nec-1能够抑制程序性坏死的发生,减轻血管内皮细胞的损伤。血管内皮细胞的损伤及坏死造成的血管通透性增加是ALI/ARDS的重要病理基础,那么Nec-1应该能起到减轻ALI/ARDS的效果,然而体内实验与体外实验不是等同的,至于在体内实验是否有同样的效果,需要更多的实验进一步验证。T/HS大鼠肠系膜淋巴液能够引起血管内皮细胞程序性坏死的机制,以及与凋亡之间的关系也需要进一步的研究。
[1]Deitch EA.Bacterial translocation of the gut flora[J].J Trauma,1990,30(Suppl 12):184-189.
[2]Deitch EA.Gut lymph and lymphatics:a source of factors leading to organ injury and dysfunction[J].Ann N Y Acad Sci,2010,1207(Suppl 1):103-111.
[3]Jernigan TW,Croce MA,Fabian TC.Apoptosis and necrosis in the development of acute lung injury after hemorrhagic shock[J].Am Surg,2004,70(12):1094-1098.
[4]Galluzzi L,Kroemer G.Necroptosis:a specialized pathway of programmed necrosis[J].Cell,2008,135(7):1161-1163.
[5]Degterev A,Huang Z,Boyce M,et al.Chemical inhibitor of nonapoptotic cell death with therapeutic potential for ischemic brain injury[J].Nat Chem Biol,2005,1(2):112-119.
[6]Dewar D,Moore FA,Moore EE,et al.Postinjury multiple organ failure[J].Injury,2009,40(9):912-918.
[7]Deitch EA.Multiple organ failure.Pathophysiology and potential future therapy[J].Ann Surg,1992,216(2):117-134.
[8]Glenn TM,Lefer AM.Protective effect of thoracic lymph diversion in hemorrhagic shock[J].Am J Physiol,1970,219(5):1305-1310.
[9]Hassoun HT,Kone BC,Mercer DW,et al.Post-injury multiple organ failure:the role of the gut[J].Shock,2001,15(1):1-10.
[10]Deitch EA,Xu D,Kaise VL.Role of the gut in the development of injury an shock induced SIRS and MODS:the gut-lymph hypothesis,a review[J].Front Biosci,2006(11):520-528.
[11]Deitch EA,Adams CA,Lu Q,et al.Mesenteric lymph from rats subjected to trauma-hemorrhagic shock are injurious to rat pulmonary microvascular endothelial cells as well as human umbilical vein endothelial cells[J].Shock,2001,16(4):290-293.
[12] Dayal SD,Haskó G,Lu Q,et al.Trauma/hemorrhagic shock mesenteric lymph upregulates adhesion molecule expression and IL-6 production in human umbilical vein endothelial cells[J].Shock,2002,17(6):491-495.
[13]Adams JM,Hauser CJ,Adams CA Jr,et al.Entry of gut lymph into the circulation primes rat neutrophil respiratory burst in hemorrhagic shock[J].Crit Care Med,2001,29(11):2194-2198.
[14]Adams CA Jr,Xu DZ,Lu Q,et al.Factors larger than 100 kd in post-hemorrhagic shock mesenteric lymph are toxic for endothelial cells[J].Surgery,2001,129(3):351-363.
[15]Qin X,Dong W,Sharpe SM,et al.Role of lipase-generated free fatty acids in converting mesenteric lymph from a noncytotoxic to a cytotoxic fluid[J].Am J Physiol Gastrointest Liver Physiol,2012,303(8):969-978.
[16]Kaczmarek A,Vandenabeele P,Krysko DV.Necroptosis:the release of damage-associated molecular patterns and its physiological relevance[J].Immunity,2013,38(2):209-223.
[17]Vanden Berghe T,Vanlangenakker N,Parthoens E,et al.Necroptosis,necrosis and secondary necrosis converge on similar cellular disintegration features[J].Cell Death Differ,2010,17(6):922-930.
[18]Lu Q,Xu DZ,Davidson MT,et al.Hemorrhagic shock induces endothelial cell apoptosis,which is mediated by factors contained in mesenteric lymph[J].Crit Care Med,2004,32(12):2464-2670.
