乙型肝炎外周血T淋巴细胞上CD28分子表达与病毒载量的关系
2014-05-06齐青松刘志华徐建明钟培星章小东
齐青松,刘志华,徐建明,钟培星,章小东
(广东医学院附属东莞厚街医院感染科,广东 东莞 523945)
乙型肝炎外周血T淋巴细胞上CD28分子表达与病毒载量的关系
齐青松,刘志华,徐建明,钟培星,章小东
(广东医学院附属东莞厚街医院感染科,广东 东莞 523945)
目的 分析HBeAg阳性慢性乙型肝炎患者、HBeAg阳性乙肝病毒携带者外周血T淋巴细胞上CD28表达情况及其与HBV病毒载量的关系。方法采集健康人、HBeAg阳性乙肝病毒携带者、HBeAg阳性慢性乙型肝炎患者的外周血,抗体标记,采用流式细胞技术检测C、C、CC、CCT淋巴细胞,同时检测肝功能HBV DNA。结果慢性乙型肝炎组、乙肝病毒携带组CCT细胞、CCT细胞百分率明显低于健康对照组(P<0.05);HBV DNA≥107组CCT细胞百分率低于HBV DNA<107组(P<0.05)。结论乙型肝炎病毒感染者CT细胞上CD28的低表达与高病毒载量有关。
乙型肝炎;T淋巴细胞;CD28
乙型肝炎慢性化机制尚未完全弄清,目前已经明确感染者的免疫反应在疾病转归中起重要作用。强有力的免疫反应能对病毒多种抗原产生特异性抗体最终清除病毒,低下的免疫反应不仅不能控制病毒复制还可能导致持续感染和疾病进展。已经有研究表明,CT淋巴细胞在病毒清除过程中起关键作用[1-2]。T淋巴细胞正常行使功能需要被激活,而它的活化需要共刺激信号,CD28是T细胞上重要的共刺激分子,能与抗原递呈细胞上B7分子结合产生共刺激信号,对T细胞活化起关键作用[3]。尽管各种治疗方法的运用包括抗病毒药物的使用,能够最终清除病毒的慢性乙型肝炎病例为数较少,因此我们检测慢性乙型肝炎患者外周血T淋巴细胞亚群并分析其CD28分子表达情况,探究其因果关系。
1 资料与方法
1.1 研究对象 研究对象来自2012年7月至2013年8月广东医学院附属东莞市厚街医院传染科门诊和住院患者,对照组来自本院职工。从符合抗病毒标准[4]的HBeAg阳性慢性乙型肝炎患者中,知情同意后,抽取22例患者准备接受抗病毒治疗为A组,其中男性13例,女性9例,年龄21~45岁,平均(29.59± 7.35)岁;另抽取21例HBeAg阳性慢性乙肝病毒携带者为B组,其中男性13例,女性8例,年龄20~45岁,平均(31.33±7.81)岁;本院HBsAg阴性的健康职工中抽取20例为C组,其中男性12例,女性8例,年龄21~42岁,平均(31.15±5.04)岁。排除标准为:(1)6个月内使用过抗乙肝病毒、免疫抑制剂等药物;(2)同时感染甲型肝炎、丙型肝炎、丁型肝炎、戊型肝炎、HIV;(3)伴有其他系统严重疾病(恶性肿瘤、严重心脏病、糖尿病等)或免疫性疾病。
1.2 研究方法
1.2.1 主要试剂仪器 Anti-Human CD3PE-Cy7、Anti-Human CD4FITC、Anti-Human CD8APC、Anti-Human CD28PE购自美国 ebioscience公司,BD-FACS CaliburⅡ流式细胞分析仪生产商为美国Becton,Dickinson and Company。
1.2.2 细胞染色流式细胞仪检测分析 EDTA抗凝管抽取静脉血3 ml,1 500 r/min离心5 min后3 ml D-Hanks液小心稀释沉淀,再次1 500 r/min离心20 min后小心将白膜层细胞吸出。D-Hanks液洗涤一次后,加入Anti-Human CD3PE-Cy7、Anti-Human CD4FITC、Anti-Human CD8APC、Anti-Human CD28PE抗体室温避光染色30 min,然后2%小牛血清磷酸盐缓冲液(PBS)洗涤两次后,BD-FACS CaliburⅡ流式细胞分析仪进行检测并分析结果。
1.2.3 其他项目检测 HBV-DNA定量检测采用ABI 7000检测仪,乙肝六项、甲丙丁戊肝抗体、HIV抗体检测采用ELISA方法进行,肝功能使用贝克曼DXC800自动化分析仪。
1.3 统计学方法 应用SPSS19.0统计分析软件进行,各组标准化的样本数值用均数±标准差(±s)表示,两组间比较采用t检验,多组间比较采用单因素方差分析,以P<0.05表示差异有统计学意义。
2 结果
2.1 比较三组外周血T淋巴细胞亚群 各T细胞亚群数值以其占CT细胞百分比计算。A组(慢性乙型肝炎组)、B组(乙肝病毒携带组)CCT细胞、CCT细胞、CT细胞百分率低于C组(健康对照组),差异有统计学意义(P<0.05),A组、B组之间差异无统计学意义(P>0.05),见表1。
2.2 按病毒载量高低分组比较两组外周血T淋巴细胞亚群 高病毒载量组(HBV DNA≥107)、低病毒载量组(HBV DNA<107)比较:高病毒载量组CT细胞、CCT细胞百分率低于低病毒载量组,差异有统计学意义(P<0.05),高病毒载量组CCT细胞百分率低于低病毒载量组,差异无统计学意义(P>0.05),见表2。
2.3 单个研究对象T淋巴淋巴亚群检测结果举例 慢性乙型肝炎患者CCT淋巴细胞占26.96%、CCT淋巴细胞占19.86%(见图1);乙肝携带者CCT淋巴细胞占26.65%、CCT淋巴细胞占17.84%(见图2);健康人CCT淋巴细胞占30.36%、CCT淋巴细胞占20.42%(见图3)。
表1 三组T细胞亚群结果比较(%,±s)
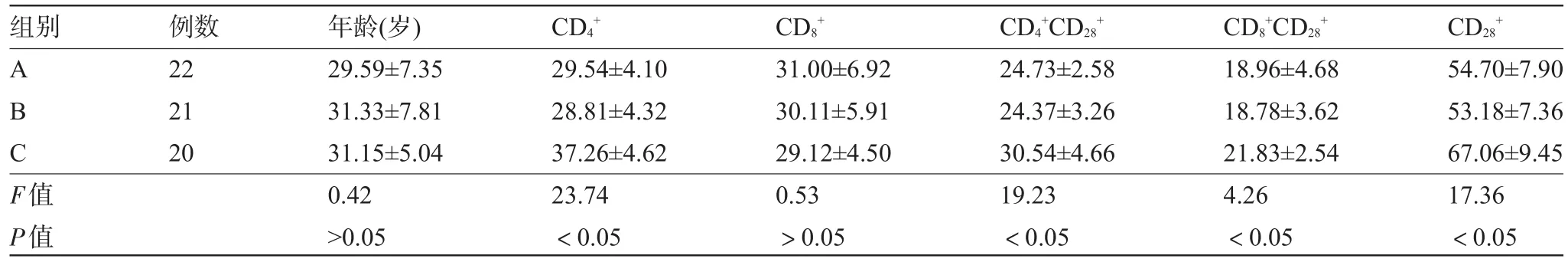
表1 三组T细胞亚群结果比较(%,±s)
表2 不同病毒载量患者T细胞亚群结果比较(%,±s)
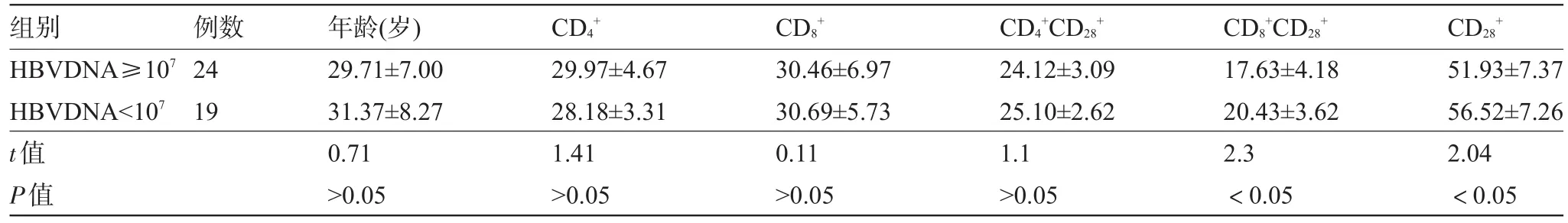
表2 不同病毒载量患者T细胞亚群结果比较(%,±s)

图1 慢乙肝患者外周血T淋巴细胞亚群上CD28分子表达

图2 乙肝携带外周血T淋巴细胞亚群上CD28分子表达

图3 健康人外周血T淋巴细胞亚群上CD28分子表达
3 讨论
本研究采用流式细胞仪对慢性乙型肝炎、乙肝携带者、健康人群外周血T淋巴细胞亚群进行检测,比较CD28分子表达情况,检测数据为各T淋巴细胞亚群占CT细胞的百分率。结果显示:慢性乙型肝炎组、乙肝病毒携带组CCT细胞、CCT细胞百分率低于健康对照组,差异有统计学意义,与国内外研究结果相同。虽然乙肝病毒携带者CCT细胞、CCT细胞百分率低于慢性乙型肝炎,但两组差异无统计学意义,究其原因,可能慢性乙型肝炎、乙肝病毒携带者同处免疫耐受状态,只是免疫耐受程度稍有差异,没有本质上的区别。我们按照病毒载量高低分为HBV DNA≥107、HBV DNA<107两组,结果显示病毒载量越高,CCT细胞百分率越低,差异有统计学意义,而CCT细胞百分率并不受HBV病毒载量的影响,提示HBV高复制只影响CCT细胞。国外曾经有报道称HIV、EBV等病毒感染也出现同样表现[9-10],结合目前实验结果,初步得出结论,乙型肝炎病毒感染者CCT细胞减少与高病毒载量有关,其原因可能是特异性CTL长期暴露于大量HBV抗原刺激,导致CCT细胞消耗性减少。
最近有研究发现[11],慢性乙型肝炎患者外周血游离CD28较健康人增多,结合慢性乙型肝炎患者CCT细胞减少这一现象是否暗示着:CCT细胞减少另外一个原因可能是CCT细胞上C分子与之解离导致?这需要进一步论证。本研究没有对各T细胞亚群的绝对数进行分析,不能完全准确反映其数量变化,因此存在一定的局限性,这些问题将在下一步研究中完善。
(志谢:感谢广东医学院东莞松山湖校区临床免疫学教研室陈章权、检验医学研究所曾今诚两位教授在标本检测技术方面的支持。)
[1]Thimme R,Wieland S,Steiger C,et al.CD8(+)T cells mediate viral clearance and disease pathogenesis during acute hepatitis Bvirus infection[J].J Virol,2003,77(1):68-76.
[2]Tang TJ,Kwekkeboom J,Mancham S,et al.Intrahepatic CT-lymphocyte response is important for therapy-induced viral clearance in chronic hepatitis B infection[J].J Hepatol,2005,43(1):45-52.
[3]Acuto O,Michel F.CD28-mediated co-stimulation:a quantitative support for TCR signaling[J].Nat Rev Immunol.2003,3(12):939-951.
[4]中华医学会肝病学分会.慢性乙型肝炎防治指南[J].中国临床医生,2012,40(4):66-78.
[5]王沂芹,柏健鹰,傅晓岚,等.慢性乙型肝炎患者HBV特异性CTL的CD28表达研究[J].第三军医大学学报,2006,28(4):342-344.
[6]Arasli M,Ustundag Y,DelikanlibB,et al.Peripheral blood lymphocyte dynamics and viral kinetics in patients with chronic active hepatitis B virus infection treated by tenofovir[J].Hepatogastroenterology,2012,59(115):851-857.
[7]范振平,张玲霞,杨 斌,等.乙型肝炎患者外周血T淋巴细胞亚群的特点和意义[J].世界华人消化杂志,2005,13(2):194-197.
[8]Khanolkar A,Fuller MJ,Zajac AJ.CD4T cell-dependent CD8T cell maturation[J].J Immunol,2004,172(5):2834-2844.
[9]Paul ME,Shearer WT,Kozinetz CA,et al.Comparison of CD8(+) T-cell subsets in HIV-infected rapid progressor children versus non-rapid progressor children[J].J Allergy Clin Immunol,2001, 108(2):258-264.
[10]Catalina MD,Sullivan JL,Brody RM,et al.Phenotypic and functional heterogeneity of EBV epitope-specific CT cells[J].J Immunol, 2002,168(8):4184-4191.
[11]彭文丽,毕小云.血清可溶性共刺激因子CTLA-4和CD28在乙型肝炎患者血清中的表达及意义[J].第三军医大学学报,2013,35 (1):82-84.
Correlation between the expression of CD28on T-lymphocyte and virus load in peripheral blood of patients with hepatitis B
QI Qing-song,LIU Zhi-hua,XU Jian-ming,ZHONG Pei-xing,ZHANG Xiao-dong
Department ofInfectious Diseases,Dongguan Houjie Hospital Affiliated to Guangdong Medical College,Dongguan 523900,Guangdong, CHINA
ObjectiveTo analyze the correlation between the expression of CD28on T-lymphocyte and virus load in peripheral blood of chronic hepatitis B patients and HBV carriers with HBeAg-positive.MethodsPeripheral blood samples were collected from healthy individuals(n=20),HBV carriers(n=21)and patients with chronic hepatitis B(n=22).After marked with the specific fluorescent antibodies,Cand Cand CCand CCT lymphocytes were detected using two or three-color flow cytometry.Meanwhile,serum ALT and hepatitis B virus(HBV) viral loads were evaluated.ResultsThe percentages of CCand CCT lymphocyte subsets were significantly higher in healthy individuals than those in chronic patients and HBV carriers(P<0.05).The percentage of CCT lymphocyte subset was lower in the patients with high replication of HBV-DNA(more than 107copies/L)than those with low HBV replication(P<0.05).ConclusionThe lower expression of CD28on the CT lymphocytes is related to the high HBV virus load in patients with chronic HBV infection.
Hepatitis B;T-lymphocyte;CD28
R512.6+2
A
1003—6350(2014)15—2234—04
10.3969/j.issn.1003-6350.2014.15.0868
2014-01-07)
东莞市科技计划项目(编号:201210515023167)
齐青松。E-mail:qqs666@163.com
