雷公藤内酯醇对ApoE-/-小鼠动脉粥样硬化的作用研究
2014-05-06程治平余斌熊军刘正军陆京伯
程治平,余斌,熊军,刘正军,陆京伯
(1.西藏自治区人民医院骨科,西藏拉萨 850000;2.南方医科大学南方医院,广东广州 510515;3.海南省人民医院,海南海口 570100)
·论著·
雷公藤内酯醇对ApoE-/-小鼠动脉粥样硬化的作用研究
程治平1,余斌2,熊军3,刘正军2,陆京伯2
(1.西藏自治区人民医院骨科,西藏拉萨 850000;2.南方医科大学南方医院,广东广州 510515;3.海南省人民医院,海南海口 570100)
目的研究不同剂量雷公藤内酯醇对ApoE-/-小鼠动脉粥样硬化(Atherosclerosis,AS)的治疗效果。方法将4只10周龄雄性ApoE-/-小鼠作为模型组,4只10周龄雄性C57BL/6J小鼠作为对照组,适应性喂养1周后处死,取主动脉标本做HE染色。另将10周龄雄性ApoE-/-小鼠32只作为实验组,按每天每千克体重给药量随机分为4组:50µg/(kg·d)、75 μg/(kg·d)组、100µg/(kg·d)、空白对照组,每组8只。10周龄雄性C57BL/ 6J小鼠8只作为阴性对照组。给药3周后处死小鼠,取主动脉标本做HE染色;收集血清,测定IL-10、IL-12含量。结果(1)在11周龄时两组主动脉HE染色Roberts&Thompson方法评分分别为:模型组[(5.250±0.500)分]>对照组[(0.500±0.577)分],差异有统计学意义。(2)经不同浓度雷公藤内酯醇处理3周后,各组主动脉HE染色Roberts&Thompson方法评分分别为:空白对照组[(6.500±0.189)分]>100µg/(kg·d)组[(4.625±0.183)分]>50µg/(kg·d)组[(3.375±0.183)分]>75µg/(kg·d)组[(1.375±0.183)分]>阴性对照组[(0.000±0.000)分],差异有统计学意义。(3)75µg/(kg·d)组血清中IL-10浓度升高最明显,与各组比较差异均有统计学意义(P<0.001);各组血清中IL-12浓度均较空白对照组降低,其中75µg/(kg·d)组降低最明显,两者之间的差异有统计学意义(P<0.01)。结论(1)在11周龄时,ApoE-/-小鼠能形成AS模型。(2)不同浓度雷公藤内酯醇处理3周后,ApoE-/-小鼠AS病变有不同程度缓解,其中75µg/(kg·d)浓度下效果最佳。(3)雷公藤内酯醇能够上调IL-10、下调IL-12的表达水平,抑制炎症反应,减轻粥样斑块的形成,此可能为免疫抑制剂抗动脉粥样硬化的机制之一。
动脉粥样硬化;雷公藤内酯醇;ApoE-/-小鼠;IL-10;IL-12
动脉粥样硬化是许多心血管疾病的发病基础,严重危害人类健康。迄今为止,AS确切的病因和发病机制仍不十分清楚。先后有许多学者提出了各种假说,包括脂质浸润、平滑肌细胞(Smooth muscle cell,SMC)增殖、血栓源学说等,但都不能很好的解释AS的发病机制。随着研究不断深入,我们逐渐发现AS的发展过程中始终伴随有炎症的基本特征。因此,Ross等[1]提出“AS是一种炎症性疾病”的观念,炎症反应始终与免疫过程相伴随[2]。随着研究的深入,发现T细胞的活化与分化在动脉粥样硬化形成过程中至关重要[3-6]。DC作为功能最强大的抗原提呈细胞,能够调节T细胞的活化与分化,在AS发生机制中意义重大[7]。我们在临床工作中发现,雷公藤具有治疗AS的功效,结合其主要活性成分——雷公藤内酯醇可以抑制DC活性的特点[8-9],我们推测雷公藤能够抑制炎症反应而达到治疗AS的效果,为AS的防治提供新线索。
1 材料与方法
1.1 实验材料10周龄雄性C57BL/6J小鼠12只,20~30 g,由南方医科大学实验动物中心提供;10周龄雄性ApoE-/-小鼠(C57BL/6J背景)36只,20~30 g,由北京大学医学部实验动物中心提供。雷公藤内酯醇、IL-10、IL-12 ELLISA试剂盒(广州梦怡美生物科技有限公司)。
1.2 模型的建立与分组将两种品系小鼠予普通小鼠饲料适应性喂养1周后,随机抽取4只ApoE-/-小鼠作为模型组,4只C57BL/6J小鼠作为对照组,两组小鼠均不予药物干预,麻醉后处死,无菌条件下取出主动脉,常规脱水,石蜡包埋并切片,苏木素-伊红(HE)染色。光镜下观察粥样斑块病变情况,Roberts &Thompson方法[10-11]评价两组间差异。
1.3 实验分组将剩余32只ApoE-/-小鼠作为实验组,随机分均为4个亚组:空白对照组(每日腹腔注射等量二甲基亚砜溶液)、50µg/(kg·d)[按50µg/(kg·d)的量给予雷公藤内酯醇,稀释后腹腔注射,1次/d]、75µg/(kg.d)组[按75µg/(kg·d)的量给予雷公藤内酯醇,稀释后腹腔注射,1次/d]、100µg/(kg·d) [按100µg/kg.d的量给予雷公藤内酯醇,稀释后腹腔注射,每日1次]。剩余8只10周龄雄性C57BL/6J野生型小鼠作为阴性对照组(每日腹腔注射等量二甲基亚砜溶液)。所有小鼠均予普通饲料连续喂养3周后处死。
1.4 标本检测
1.4.1 主动脉标本苏木素-伊红(HE)染色小鼠麻醉后处死,取出主动脉固定、石蜡包埋、切片、HE染色后制作成病理切片,光镜下观察仔细观察各组间主动脉内膜厚度、纤维化程度、内外弹力层厚度及完整性、单位面积内泡沫细胞数量、钙化情况及炎性细胞浸润情况,参照Roberts&Thompson方法[10-11]对评价动脉粥样斑块病变情况,评判雷公藤内酯醇治疗动脉粥样硬化的效果。
1.4.2 血清样本收集及IL-10、IL-12的含量测定实验终点时2%戊巴比妥钠腹腔麻醉下开胸心脏采血,肝素钠抗凝,3 000 r/s离心30 min,抽吸上清液至4℃冰箱保存待检测。血清中IL-10、IL-12的含量测定严格按照ELISA试剂盒附带操作方法进行检测。
1.5 统计学方法数据统计使用SPSS16.0软件,Roberts&Thompson方法评分结果为有序分类变量,依据实验分组情况使用俩独立样本Kruskal-Wallis检验或者多个独立样本比较的Kruskal-Wallis H检验,从总体上分析各组之间有无差别。经Kruskal-Wallis H检验后,如果各组之间差异有统计学意义则进行组间多重比较的Nemenyi检验。血清中IL-10、IL-12的检测结果应用One-way ANOVA进行分析,多组均数多重比较方差齐性时采用Student-Newman-Keuls(SNK)法,方差不齐时采用Dunnett T3法。检验水准为α=0.05,P<0.05表示差异有统计学意义。结果以均数±标准差()表示。
2 结果
2.1 动脉粥样硬化模型鉴定如图1A所示,对照组即C57BL/6J小鼠组的主动脉内膜光滑,厚薄均匀,内弹力纤维完整;主动脉的中膜无增厚,外弹力纤维无增殖迁移,细胞形态为长梭形、杆状,排列规则,外膜结缔组织无异常,可以看出病理切片未见动脉粥样硬化改变迹象。图1B可见,模型组即ApoE-/-小鼠组主动脉内膜厚薄不一,可见增厚隆起,内弹力板不连续;主动脉的中膜明显增厚,可见明显的钙化,平滑肌细胞增殖及泡沫化,外弹力板增殖增生明显,细胞数目明显增多,排列紊乱,内部呈空泡状,并向内膜迁移。其病理变化为动脉粥样硬化表现[12]。适应喂养1周后,两组主动脉粥样硬化斑块病变情况的Roberts&Thompson方法评分分别为:模型组[(5.250±0.500)分]>对照组[(0.500±0.577)分]。经Kruskal-Walli秩和检验,得出P=0.017,差异有统计学意义。

图1 各组主动脉壁组织学观察结果(HE×200)
2.2 雷公藤内酯醇治疗后的疗效评价经不同浓度雷公藤内酯醇治疗3周后,各组主动脉壁在光镜下组织学观察结果为显示药物治疗组动脉粥样硬化病变均有不同程度缓解。如图2所示,空白对照组病变最为严重,该组大部分病理切片HE染色能观察到明显的粥样斑块,75µg/(kg·d)组病变缓解最为明显,主要病理变化表现为内膜下细胞数目增加、排列紊乱,少有纤维斑块等形成。各组主动脉粥样硬化斑块病变情况的Roberts&Thompson方法评分由高到低分别为:空白对照组[(6.500±0.189)分]>100µg/(kg·d)组[(4.625±0.183分)]>50µg/(kg·d)组[(3.375±0.183分)]>75µg/(kg·d)组[(1.375±0.183)分]>阴性对照组[(0.000±0.000)分]。经Kruskal-Walli秩和检验,得出P=0.000,差异有统计学意义。进行组间多重比较的Nemenyi检验后显示各组间两两比较差异均有统计学意义(P<0.05),见表1。

图2 各组主动脉壁组织学观察结果(HE×400)
表1 各组主动脉标本组织学Roberts&Thompson方法评分结果(分,)
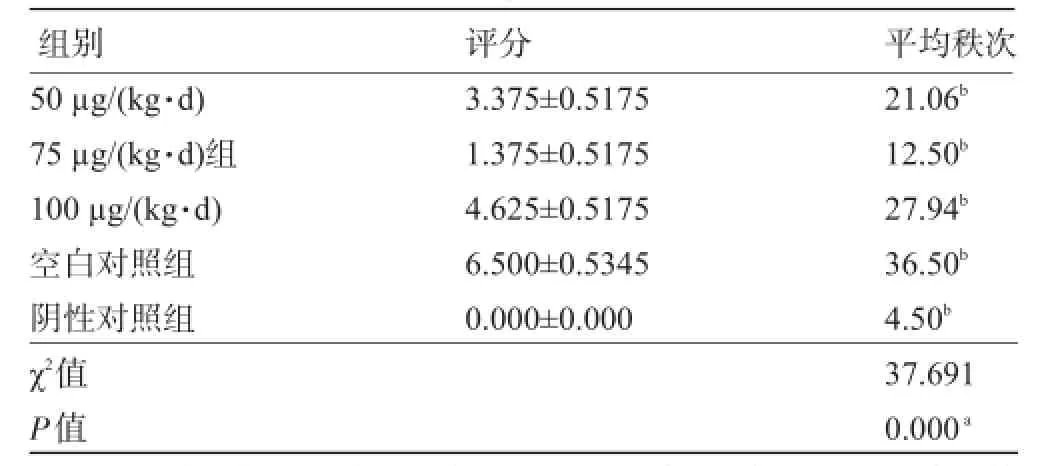
表1 各组主动脉标本组织学Roberts&Thompson方法评分结果(分,)
注:a需继续进行组间多重比较的Nemenyi检验;b据Nemenyi检验结果,各组别间比较差异有统计学意义。
?
2.3 各组血清中IL-10、IL-12水平的比较如表2所示,各组血清中IL-10表达情况的检测结果为:75µg/(k·d)组>100µg/(kg·d)组>50µg/(kg·d)组>空白对照组>阴性对照组。模型组与阴性对照组比较,血清中IL-10浓度均明显升高,其中75µg/(kg·d)组血清中IL-10浓度升高最明显,各组间比较差异有显著性统计学意义。与此同时,IL-12表达情况由高到低排列为:空白对照组>100µg/(kg·d)>阴性对照组>50µg/(kg·d)>75µg/(kg·d)组。75µg/(kg·d)组血清中IL-12浓度降低最明显,与各亚组间比较差异有显著统计学意义。表明在75µg/(kg·d)处理条件下,血清中IL-10上调和IL-12下调效果最为明显。
表2 各组血清中IL-10含量的比较()

表2 各组血清中IL-10含量的比较()
注:a方差齐性检验结果P>0.05,需继续使用两两之间均数比较的SNK法进行分析;b根据SNK检验结果,各组别间比较差异无统计学意义。
3 讨论
AS是一种炎症性疾病的观念已逐渐获得认同,T细胞的活化贯穿AS始终。大量的研究发现,DC作为功能最强大的抗原提呈细胞,其增殖、分化、迁移等与T细胞活化密切相关[3,13-15]。体外试验表明雷公藤内酯醇能够抑制T细胞的增生,诱导活化T细胞凋亡从而抑制T细胞免疫环节[9,16],其具体机制目前尚不清楚。有研究证实,雷公藤内酯醇可能是通过抑制DC免疫活性而调节机体的免疫状态[8]。
本实验首次尝试以雷公藤内酯醇防治动脉粥样硬化。在本实验中11周龄ApoE-/-小鼠主动脉出现了AS病灶,经不同浓度雷公藤内酯醇腹腔注射处理3周后,可见ApoE-/-小鼠主动脉的损伤程度较空白对照组均有不同程度缓解。75µg/(kg·d)组动脉病变缓解最为明显,而50µg/(kg·d)组、100µg/(kg·d)组病变程度缓解相对较少,但多数主动脉内膜基本完整,平滑肌细胞增殖及泡沫化较少。进行组间多重比较的Nemenyi检验后显示各组间两两比较差异均有统计学意义(均P<0.05)。
各组主动脉粥样硬化斑块病变情况的Roberts &Thompson方法评分结果提示雷公藤内酯醇浓度从50µg/(kg·d)到75µg/(kg·d)升高的过程中,减轻主动脉粥样硬化斑块病变的能力增强,而在75µg/(kg·d)到100µg/(kg·d)的范围内,随着雷公藤内酯醇浓度的增高,防治主动脉粥样硬化斑块病变的能力下降,到达100µg/(kg·d)时,其主动脉病变程度接近于空白对照组。若继续增加雷公藤内酯醇浓度可能不仅起不到治疗的作用,反而会加重主动脉损害。
IL-10由Th2细胞、B细胞、单核细胞和巨噬细胞产生,是平衡Th1和Th2免疫反应的一个重要的调节因子。研究显示IL-10缺陷小鼠动脉硬化管壁胶原蛋白含量减少及T细胞的聚集现象[17]。在有关IL10-/-ApoE-/-动脉粥样硬化的早期阶段研究证实IL-10对动脉硬化有保护作用,结果表明,IL-10也能增加早期斑块的稳定性[18]。
我们的研究发现,模型组相对于阴性对照组,血清中IL-10浓度显著性升高,而在模型组内,各药物处理组IL-10的表达水平均高于空白对照组,其中75µg/(kg·d)组的IL-10表达水平最高。我们认为,在雷公藤内酯醇作用下,使得Th2细胞分泌IL-10水平上调。其结果是:高表达IL-10抑制了Th1细胞合成分泌IFN-γ和IL-2等细胞因子的能力,阻止单核巨噬细胞活化和DC细胞的抗原提呈功能,从而抑制T细胞介导的免疫反应[19-21];高表达IL-10下调DC合成分泌IL-12和TNF-α的能力,抑制T细胞的增殖[19],降低单核细胞的粘附能力,降低CD54、CD80、CD86共刺激分子的表达,抑制抗原提呈细胞功能,从而减弱或消除T、B细胞介导的免疫应答,导致T细胞无能,使机体的迟发型变态反应受到抑制[19,22-23];此外,IL-10能直接作用于T细胞上的CD28协同刺激受体,阻断CD28分子介导的信号传导通路,从而有效抑制T细胞的增殖、分化,诱导T细胞免疫耐受[22-23]。这些生物学活性显示IL-10是一个免疫增殖反应和炎症反应的负性调节因子,具有多效性及广泛的生物学作用。
我们的研究发现,各组相对于空白对照组,血清中IL-12浓度显著性降低,组间差异均有统计学意义,其中75µg/(kg·d)组的IL-12表达水平最低。75µg/(kg·d)组的IL-12表达水平与阴性对照比较差异也有统计学意义。有文献报道[3-5],在AS形成过程中,IL-12的表达会显著上调。我们的实验表明,雷公藤内酯醇作用下,可以使得DC细胞分泌IL-12水平下调。IL-12主要由活化的巨噬细胞、树突状细胞和中性粒细胞产生,其中DCs是体内IL-12的主要来源细胞。一方面,下调IL-12,使其与Th0细胞表面IL-12受体结合减少,促使Th0细胞向Th1细胞分化分离减弱,从而削弱Th1细胞介导的细胞毒和局部炎症有关的免疫应答及其参与的细胞免疫及迟发型超敏性炎症的形成[24];另一方面,低表达IL-12能下调T细胞、NK细胞产生干扰素-γ(IFN-γ)的能力,削弱NK细胞、T细胞介导的细胞毒性,下调Th1细胞为主的免疫应答水平[25]。在Apoe-/-小鼠斑块中可以检测到IL-12,并且上调IL-12能够增加Apoe-/-小鼠斑块面积[26]。在30周龄的IL-12p40缺失的IL12b-/-Apoe-/-小鼠斑块面积减少了52%[27]。另一项研究表明,在小鼠体内的T细胞在抗原刺激的情况下,IL-12激活后上调CCR5的表达,趋化,并朝CCL5迁移[28-29]。总之这些结果支持这一概念:IL-12能加速动脉粥样硬化进程和促进炎症反应。这一观念与我们的研究结果是一致的。
综上所述,本研究发现,经过3周雷公藤内酯醇腹腔注射治疗后,ApoE-/-小鼠主动脉的动脉粥样硬化病变程度均有不同程度缓解;与此同时也能使血清中抗炎因子IL-10的表达水平上调、促炎因子IL-12表达下调;其中,在75µg/(kg·d)给药处理下效果最佳。抑制炎症反应可能为雷公藤内酯醇治疗AS的机制之一。
[1]Ross R.Atherosclerosis--an inflammatory disease[J].N Engl J Med,1999,340(2):115-126.
[2]Shimada K,Mokuno H,Watanabe Y,et al.High prevalence of seropositivity for antibodies to Chlamydia-specific lipopolysaccharide in patients with acute coronary syndrome[J].J Cardiovasc Risk, 2000,7(3):209-213.
[3]Bobryshev YV.Dendritic cells and their role in atherogenesis[J]. Lab Invest,2010,90(7):970-984.
[4]Cybulsky MI,Jongstra-Bilen J.Resident intimal dendritic cells and the initiation of atherosclerosis[J].Curr Opin Lipidol,2010,21(5): 397-403.
[5]Galkina E,Ley K.Immune and inflammatory mechanisms of atherosclerosis(a)[J].Annu Rev Immunol,2009,27:165-197.
[6]Gawaz M,Stellos K,Langer HF.Platelets modulate atherogenesis and progression of atherosclerotic plaques via interaction with progenitor and dendritic cells[J].J Thromb Haemost,2008,6(2): 235-242.
[7]Cao X,Zhang W,He L,et al.Lymphotactin gene-modified bone marrow dendritic cells act as more potent adjuvants for peptide delivery to induce specific antitumor immunity[J].J Immunol,1998, 161(11):6238-6244.
[8]李明松,王晓芽,袁爱力,等.雷公藤内酯醇抑制树突状细胞免疫功能[J].中国药理学通报,2000,6:711-712.
[9]吴俊,梁晓燕,杨奕,等.雷公藤对Ly-22.2~+细胞(抑制性T淋巴细胞)的激活作用[J].中国病理生理杂志,1996,1:30-32.
[10]Renier G,Skamene E,Desanctis J,et al.Dietary n-3 polyunsaturated fatty acids prevent the development of atherosclerotic lesions in mice.Modulation of macrophage secretory activities[J].Arterioscler Thromb,1993,13(10):1515-1524.
[11]Paigen B,Morrow A,Holmes PA,et al.Quantitative assessment of atherosclerotic lesions in mice[J].Atherosclerosis,1987,68(3): 231-240.
[12]杨小毅,杨永宗,谭健苗,等.一种纯系小鼠动脉粥样硬化病理模型的建立[J].中国动脉硬化杂志,1996,4(1):54-57.
[13]Bobryshev YV.Dendritic cells and their role in atherogenesis[J]. Lab Invest,2010,90(7):970-984.
[14]Bobryshev YV,Lord RS.Mapping of vascular dendritic cells in atherosclerotic arteries suggests their involvement in local immune-inflammatory reactions[J].Cardiovasc Res,1998,37(3):799-810.
[15]Hansson G K.Atherosclerosis--an immune disease:The Anitschkov Lecture 2007[J].Atherosclerosis,2009,202(1):2-10.
[16]王治校,周建华,毛山,等.负向调控调节性T细胞对小鼠动脉粥样硬化形成的影响[J].中国动脉硬化杂志,2011,19(8):627-631.
[17]Tedgui A,Mallat Z.Cytokines in atherosclerosis:pathogenic and regulatory pathways[J].Physiol Rev,2006,86(2):515-581.
[18]Caligiuri G,Rudling M,Ollivier V,et al.Interleukin-10 deficiency increases atherosclerosis,thrombosis,and low-densitylipoproteins in apolipoprotein E knockout mice[J].Mol Med,2003,9 (1-2):10-17.
[19]Canivet C,Bohler T,Galvani S,et al.In vitro mitogen-stimulated T-cell from hepatitis C virus-positive liver transplantation candidates,increases T-cell activation markers and T-cell proliferation [J].Transpl Immunol,2008,19(2):112-119.
[20]Ye Z,Huang H,Hao S,et al.IL-10 has a distinct immunoregulatory effect on naive and active T cell subsets[J].J Interferon Cytokine Res,2007,27(12):1031-1038.
[21]Rosenberg B,Juckett DA,Aylsworth CF,et al.Protein from intestinal Eimeria protozoan stimulates IL-12 release from dendritic cells, exhibits antitumor properties in vivo and is correlated with low intestinal tumorigenicity[J].Int J Cancer,2005,114(5):756-765.
[22]Yang S,Li W,Liu W,et al.ILc10 gene modified dendritic cells induced antigen-specific tolerance in experimental autoimmune myocarditis[J].Clin Immunol,2006,121(1):63-73.
[23]Zhang M,Wang Q,Liu Y,et al.Effective induction of immune tolerance by portal venous infusion with IL-10 gene-modified immature dendritic cells leading to prolongation of allograft survival[J].J Mol Med(Berl),2004,82(4):240-249.
[24]Colombo MP,Trinchieri G.Interleukin-12 in anti-tumor immunity and immunotherapy[J].Cytokine Growth Factor Rev,2002,13(2): 155-168.
[25]Ferro JM,Canhao P,Stam J,et al.Prognosis of cerebral vein and dural sinus thrombosis:results of the International Study on Cerebral Vein and Dural Sinus Thrombosis(ISCVT)[J].Stroke,2004,35(3): 664-670.
[26]Lee TS,Yen HC,Pan CC,et al.The role of interleukin 12 in the development of atherosclerosis in ApoE-deficient mice[J].Arterioscler Thromb Vasc Biol,1999,19(3):734-742.
[27]Davenport P,Tipping PG.The role of interleukin-4 and interleukin-12 in the progression of atherosclerosis in apolipoprotein E-deficient mice[J].Am J Pathol,2003,163(3):1117-1125.
[28]顾洪丰,孙慧,杨永宗.慢性应激对ApoE~(-/-)小鼠动脉粥样硬化病变与TLR4表达的影响[J].中国动脉硬化杂志,2009,7:584.
[29]Zhang X,Niessner A,Nakajima T,et al.Interleukin 12 induces T-cell recruitment into the atherosclerotic plaque[J].Circ Res, 2006,98(4):524-531.
Effect of triptolide on atherosclerosis of ApoE knock-out mice.
CHENG Zhi-ping1,YU Bin2,XIONG Jun3,LIU Zheng-jun2,LU Jing-bo2.
1.Department of Orthopedics,Tibet People's Hospital,Lhasa 850000,Tibet,CHINA;2. Nanfang Hospital,Southern Medical University,Guangzhou 510515,Guangdong,CHINA;3.Hainan General Hospital, Haikou 570100,Hainan,CHINA

Atherosclerosis;Triptolide;ApoE-/-mice;IL-10;IL-12
R-332
A
1003—6350(2014)12—1725—05
10.3969/j.issn.1003-6350.2014.12.0672
2014-01-17)