大鼠脊髓损伤后勿动蛋白受体的动态表达
2014-05-06杨俊锋张亚峰马勇吴毛郭杨顾晓林王建伟
杨俊锋,张亚峰,马勇,吴毛,郭杨,顾晓林,王建伟
·基础研究·
大鼠脊髓损伤后勿动蛋白受体的动态表达
杨俊锋1,张亚峰1,马勇2,吴毛1,郭杨2,顾晓林2,王建伟1
目的观察大鼠脊髓损伤后勿动蛋白受体(NgR)在脊髓组织中的动态表达变化。方法108只Sprague-Dawley大鼠随机分成正常组、假手术组和模型组,每组36只,其中模型组采用改良Allen法造模。3组分别于干预后24 h、3 d、7 d、14 d处死大鼠,每组9只,以免疫组化及Western blotting检测各组大鼠脊髓组织中NgR表达的变化,以荧光定量PCR检测NgR mRNA表达变化。结果正常组、假手术组各时间点NgR表达无明显变化(P>0.05)。模型组在损伤后24 h NgR及其mRNA表达较低,3 d后下降至最低,7 d后迅速上升达到高峰,14 d时有所下降。与正常组比较,模型组在损伤后各时间点,NgR免疫组化及Western blotting蛋白表达差异均有统计学意义(P<0.05);与假手术组比较,模型组在损伤后各时间点,NgR mRNA表达差异均有统计学意义(P<0.01)。结论大鼠脊髓损伤后,NgR及其mRNA表达均在7 d时上升至峰值,并较长时间保持高水平表达。这可能是造成脊髓损伤后轴突再生困难的重要原因之一。
脊髓损伤;勿动蛋白受体;轴突再生;大鼠
[本文著录格式]杨俊锋,张亚峰,马勇,等.大鼠脊髓损伤后勿动蛋白受体的动态表达[J].中国康复理论与实践,2014,20 (10):919-923.
脊髓损伤(spinal cord injury,SCI)后如何促进轴突再生一直是脊髓损伤修复研究的重点和难点。目前,大多数国内外学者认为脊髓损伤后髓磷脂相关抑制蛋白的抑制作用是中枢神经系统(central nervous system, CNS)轴突再生的关键因素之一[1-2]。勿动蛋白受体(Nogo receptor,NgR)是CNS髓磷脂相关蛋白Nogo-A、髓磷脂相关糖蛋白(myelin-associated glycoprotein, MAG)、少突胶质细胞-髓磷脂糖蛋白(oligodendrocyte-myelin glycoprotein,OMgp)共同作用的靶点[3]。明确NgR在脊髓组织中的表达规律,并针对性地阻断NgR的抑制作用已成为近年来研究的热点[4-6]。
本研究旨在观察大鼠脊髓组织NgR及其基因表达,进一步探讨NgR在神经再生过程中的意义和作用。
1 材料与方法
1.1 实验动物与分组
108只清洁级Sprague-Dawley大鼠,雌性,体质量180~220 g,由南京中医药大学动物实验中心提供。按5只/笼饲养于南京中医药大学动物实验中心恒温恒湿动物房,自由进食、饮水。
采用随机数字表法,将大鼠随机分为正常组、假手术组和模型组,每组各36只。正常组不做任何处理;假手术组咬除T9~T11棘突及椎板,避免损伤脊髓;模型组按照改良Allen法造模。
1.2 模型制备
10%水合氯醛0.4 ml/100 g腹腔注射麻醉,将大鼠俯卧位固定于手术台上。以T10棘突为中心取背部后正中纵行切口,长约3 cm,逐层进入,沿棘突剥离椎旁肌,显露T9~T11棘突及椎板,仔细咬除T9~T11全部椎板至椎弓根部,暴露硬脊膜并保持其完整性。采用改良Allen法[7]制备动物模型:25 g⋅cm(10 g×2.5 cm)垂直打击大鼠T9~T11节段脊髓,可见大鼠后肢痉挛性抽搐数次后软瘫,逐层缝合至皮肤。术后每天予以青霉素8×104U腹腔注射预防感染,保持会阴部干燥,每天两次挤压膀胱协助排尿。
1.3 标本采集
按照实验分组,每组分别于干预后24 h、3 d、7 d、14 d各取9只,随机取3只用于免疫组化检测,3只用于PCR检测,3只用于Western blotting检测。
10%水合氯醛0.3~0.4 ml/100 g腹腔注射麻醉,经左心室-升主动脉插管,用生理盐水100 ml灌注后,用于免疫组化实验的大鼠以4%多聚甲醛PBS溶液500 ml灌注固定2 h,以造模损伤区为中心,取出长约1 cm的脊髓组织,投入4%多聚甲醛液内继续固定24 h,然后以2 ml冻存管4℃冰箱保存。用于PCR和Western blotting实验的大鼠以PBS溶液500 ml灌注固定2 h,以造模损伤区为中心,取出长约1 cm的脊髓组织放于2 ml冻存管液氮中,-70℃冰箱保存。
1.4 免疫组化法检测脊髓组织NgR蛋白表达
所取标本依次经梯度乙醇组织脱水、二甲苯透明后,行石蜡包埋,以脊髓直接损伤处为中心冠状位连续行厚约4~5 μm的超薄切片,每个样本切片10张,随机取石蜡切片5张按Envision试剂盒行免疫组织化学分析。DAB显色,苏木素复染,以胞浆内淡黄色或棕黄色颗粒染色为阳性表达。每张切片随机选取5个高倍镜视野(200×),各组所选部位相同,以Image-Pro Plus 6.0软件分析平均光密度值(mean density, MD),以5个视野平均光密度的平均值作为该张切片的测量值。
1.5 Western blotting检测脊髓组织NgR蛋白表达
取各组脊髓组织40 mg,在冰浴下依次加入细胞裂解液200 μl,研磨匀浆,15000 r/min离心,提取上清总蛋白,按BCA法蛋白定量,生理盐水调平,加入2×上样缓冲液后98℃下加热变性5 min,冷却后-70℃冰箱保存。β-actin、NgR均采用5%浓缩胶和10%分离胶进行SDS-PAGE凝胶电泳,Trans-blot®SD蛋白半干转印仪转印蛋白。然后,脱脂奶粉室温封闭2 h后以1×TBST洗膜3次,每次5 min,一抗(β-actin,1∶1000,美国CST;NgR,1∶1000,美国Abcam)4℃下孵育过夜。再次以1×TBST洗膜3次,每次5 min,二抗(美国Bioworld)室温孵育2 h(1∶5000)后再次以1×TBST洗膜3次,每次5 min,ECL法显色,Image Quant LAS 4000mini超灵敏化学发光成像仪成像。采用Image-Pro Plus 6.0软件分析蛋白条带灰度值,以β-actin作为内参蛋白进行校准,采用NgR条带灰度值/β-actin条带灰度值的比值表示NgR的相对表达量。
1.6 荧光定量PCR法检测脊髓组织NgR mRNA表达
-70℃分别取出各组脊髓组织,每50~100 mg组织加入Trizol裂解液1 ml,球磨仪研磨匀浆,Trizol法提取总mRNA,严格按照说明书进行。以逆转录(RT法)合成cDNA,再进行PCR扩增。
参照GenBank公布的NgR和GAPDH cDNA序列,设计NgR上游引物5'-TGACTTAGAGGGTTGTGCTGTG-3',下游引物5'-CATTGCCTGGTGGAGTGTC-3'(扩增产物206 bp);GAPDH上游引物5'-CTGAGCACTCTCCCTCACAATTC-3',下游引物5'-GTGCAGCGAACTTTATTGATGGT-3'(扩增产物102 bp)。由生工生物工程(上海)股份有限公司合成目的基因NgR和GAPDH的引物。反应条件:95℃预变性30 s,95℃变性5 s,60℃退火34 s,上述变性、退火步骤循环40次。随后继续进行建立熔解曲线的反应:95℃15 s,60℃1 min,95℃15 s。以管家基因GAPDH作为内参基因,采用2-△△Ct法分析NgR基因在脊髓组织中的相对表达量。
1.7 统计学分析
采用SPSS 17.0统计软件包进行分析,正态分布定量资料以(±s)表示,采用单因素方差分析及LSD-t检验法两两比较,不满足方差分析条件时采用Wilcoxon秩和检验。显著性水平α=0.05。
2 结果
2.1 脊髓组织NgR免疫组化动态表达
正常组、假手术组脊髓组织中NgR在24 h、3 d、7 d、14 d各时间点表达相对稳定,且两组间表达量差异无统计学意义(P>0.05)。模型组NgR表达在24 h下降,3 d时达到低谷,7 d时显著增高至峰值,14 d时有所下降,但仍高于正常组表达量,其中24 h、3 d、7 d、14 d时模型组与正常组比较差异均有统计学意义(P<0.05)。见表1和图1。
2.2 脊髓组织NgR Western blotting动态表达
Western blotting分析显示,正常组和假手术组在4个时间点NgR表达较为恒定,两组各时间点比较,无显著性差异(P>0.05)。假手术组与正常组于同一时间点比较,无显著性差异(P>0.05)。模型组在脊髓损伤后24 h NgR表达下降,至3 d时表达水平最低,于7 d时上升至峰值,之后有下降的趋势,且与正常组比较,各时间点NgR蛋白表达量均有非常高度显著性差异(P<0.001)。见图2和表2。

表1 各组大鼠脊髓组织中NgR表达(MD)
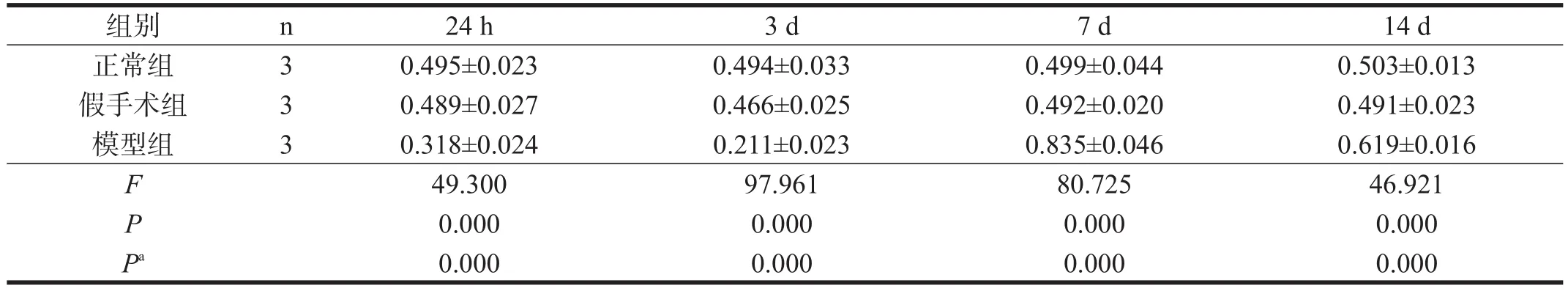
表2 各组大鼠NgR蛋白表达相对水平
2.3 脊髓组织NgR mRNA动态表达
假手术组各时间点NgR mRNA表达量稳定,在各时间点无显著性差异(P>0.05)。模型组在24 h NgR mRNA表达下降,3 d后下降至最低,7 d后迅速上升至峰值,至14 d下降,但仍高于假手术组,各时间点与假手术组比较,有非常显著性差异(P<0.01)。见表3。

表3 各组大鼠NgR mRNA在脊髓组织中的动态变化(n=3)
3 讨论
NgR作为Nogo、MAG和OMgp的共同受体,介导三者轴突再生的抑制作用[8]。NgR家族包括NgR1、NgR2、NgR3等,其中NgR1为通常所说NgR,共含有473个氨基酸,其信号肽段位于N端,中间段由两组富亮氨酸重复序列组成(其中一组含有8个氨基酸,另一组富含半胱氨酸),此区域为Nogo-66结合的识别位点,C端则通过糖基磷脂酰肌醇(GPI)结构锚定在细胞膜上[9]。NgR因为缺乏细胞内组分而不能介导跨膜和/或细胞内信号传导过程,故NgR和p75NTR、LINGO-1组成复合体,与配体结合后,通过第二信使cAMP、Ca2+启动下游Rho/ROCK信号通路,引起生长锥局部肌动蛋白细胞骨架改变,导致丝状伪足和薄片状伪足收缩,从而改变生长锥的形态和稳定性,最终造成生长锥萎缩[10]。因此,NgR作为髓磷脂相关抑制蛋白的重要靶点,抑制其表达可有效改善CNS微环境,是目前脊髓损伤修复研究的热点[11-13]。
本实验采用改良Allen法成功复制大鼠脊髓挫裂伤模型。通过观察大鼠脊髓损伤组织内NgR及基因的表达变化,发现NgR表达的一般动态规律。在脊髓损伤24 h时,NgR及其mRNA均呈低水平表达。考虑主要原因可能是脊髓损伤早期原发性损伤启动的一系列细胞和分子水平的生化级联反应,导致组织缺血、水肿、细胞凋亡、微循环障碍、脂质过氧化反应、轴突脱髓鞘等,组织蛋白呈低水平表达所致。
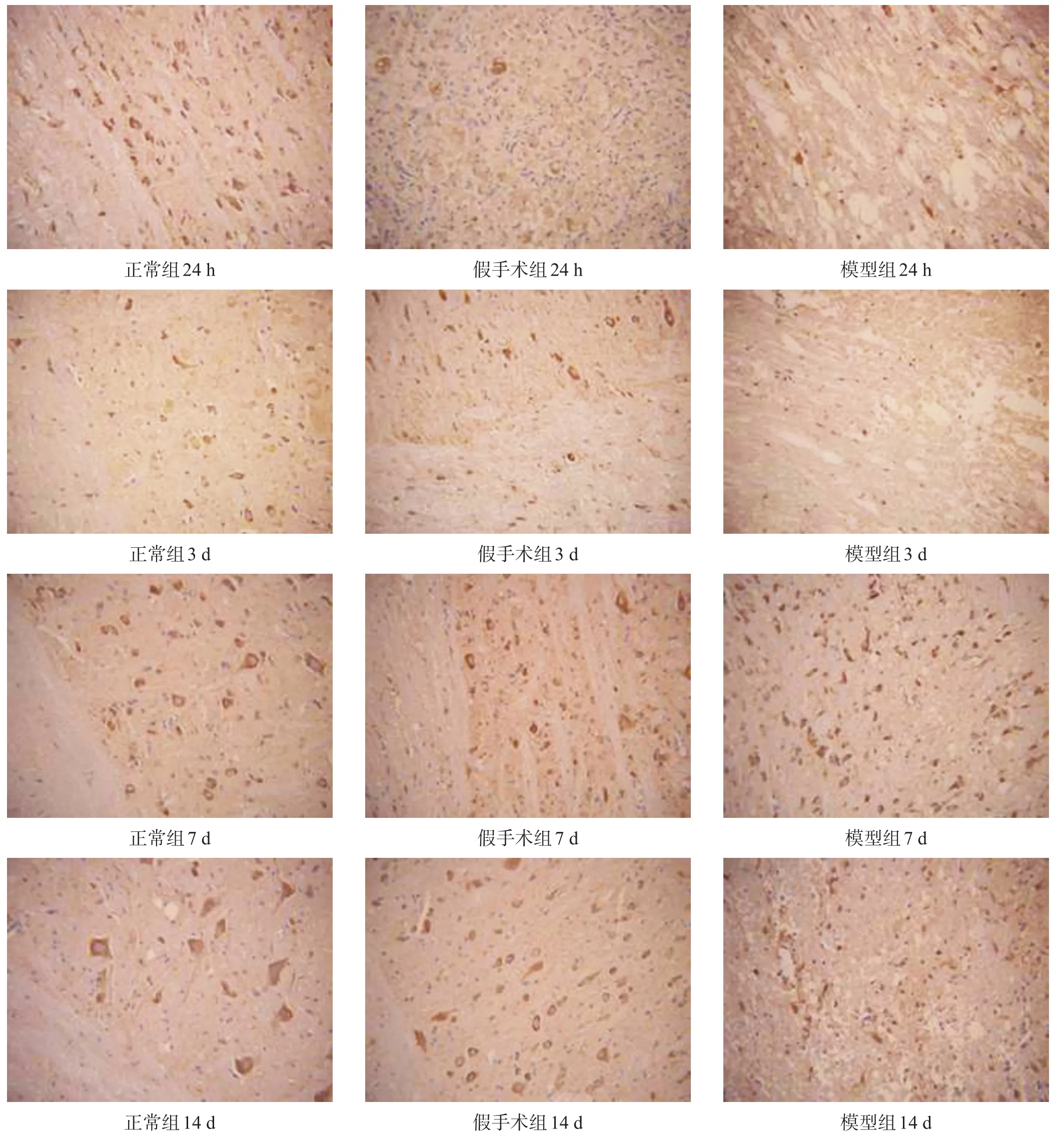
图1 各组大鼠脊髓组织NgR动态表达(免疫组化,200×)
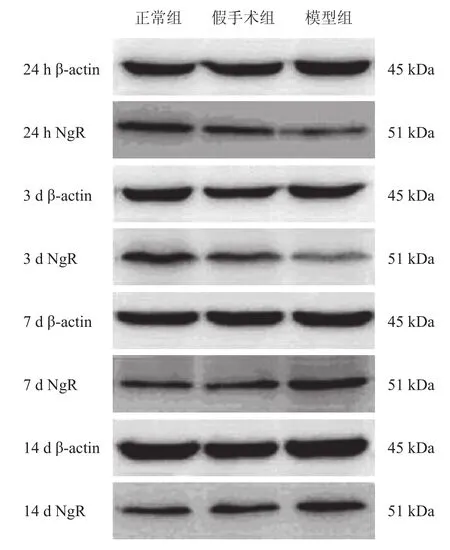
图2 各组大鼠NgR在脊髓组织中的表达
当脊髓损伤至3 d时,NgR表达下降至最低,7 d后迅速上升至峰值,14 d时虽然逐渐下降,但仍较长时间维持高水平表达。
目前国内外针对髓磷脂相关抑制因子的抑制作用进行了一系列研究和实验,主要有Nogo-A单克隆抗体LN-1、NgR拮抗剂NEP 1-40、单克隆抗NgR抗体、LINGO-FC、基因敲除技术、巨噬细胞干预以及提高细胞内cAMP或Ca2+等[14-15]。虽然在一定程度上可促进轴突再生,但实验动物的脊髓损伤仍不能完全修复,神经功能恢复仍不理想。
本研究明确了NgR表达的一般动态规律,发现脊髓损伤后7 d是个重要的时间点。我们可以在今后的实验研究中,在选择特异性阻断NgR表达的方法时,注重脊髓损伤后1周左右的治疗重要窗口期,并为了保证治疗效果,适当延长治疗周期。当然,由于动物模型、造模方式以其观察周期不同,NgR表达的变化规律以及NgR高峰表达时机、维持周期均有可能出现一定出入[16],应相应灵活调整,以利于提高脊髓损伤修复疗效。
[1]Scholze AR,Barres BA.A Nogo signal coordinates the perfect match between myelin and axons[J].Proc Natl Acad Sci U S A,2012,109(4):1003-1004.
[2]Nocentini S,Reginensi D,Garcia S,et al.Myelin-associated proteins block the migration of olfactory ensheathing cells:an in vitro study using single-cell tracking and traction force microscopy[J].Cell Mol Life Sci,2012,69(10):1689-1703.
[3]Guo Q,Li SR,Su BY.Expression of oligodendrocyte myelin glycoprotein and its receptor NgR after the injury of rat central nervous system[J].Neurosci Lett,2007,422(2):103-108.
[4]Wang X,Duffy P,McGee AW,et al.Recovery from chronic spinal cord contusion after Nogo receptor intervention[J].Ann Neurol,2011,70(5):805-821.
[5]Gonzenbach RR,Zoerner B,Schnell L,et al.Delayed anti-nogo-a antibody application after spinal cord injury shows progressive loss of responsiveness[J].J Neurotrauma,2012,29 (3):567-578.
[6]Zhilai Z,Hui Z,Yinhai C,et al.Combination of NEP 1-40 infusion and bone marrow-derived neurospheres transplantation inhibit glial scar formation and promote functional recovery after rat spinal cord injury[J].Neurol India,2011,59(4):579-585.
[7]Allen AR.Surgery of experimental lesion of spinal cord equivalent to crush injury of fracture dislocation of spinal column.A preliminary report[J].JAm MedAssoc,1911,57(11):878-880.
[8]Lee JK,Geoffroy CG,Chan AF,et al.Assessing spinal axon regeneration and sprouting in Nogo,MAG and OMgp deficient mice[J].Neuron,2010,66(5):663-670.
[9]Cafferty WB,Duffy P,Huebner E,et al.MAG and OMgp synergize with Nogo-A to restrict axonal growth and neurological recovery after spinal cord trauma[J].J Neurosci,2010,30(20): 6825-6837.
[10]McGeeAW,Yang Y,Fischer QS,et al.Experience-driven plasticity of visual cortex limited by myelin and Nogo receptor[J]. Science,2005,309(5744):2222-2226.
[11]Lv B,Yuan W,Xu S,et al.Lentivirus-siNgR199 promotes axonal regeneration and functional recovery in rats[J].Int J Neurosci,2012,122(3):133-139.
[12]Stanwick JC,Baumann MD,Shoichet MS.In vitro sustained release of bioactive anti-NogoA,a molecule in clinical development for treatment of spinal cord injury[J].Int J Pharm,2012, 426(1):284-290.
[13]Schnell L,Hunanyan AS,Bowers WJ,et al.Combined delivery of Nogo-A antibody,neurotrophin-3 and the NMDA-NR2d subunit establishes a functional'detour'in the hemisected spinal cord[J].Eur J Neurosci,2011,34(8):1256-1267.
[14]Guo X,Zahir T,Mothe A,et al.The effect of growth factors and soluble Nogo-66 receptor protein on transplanted neural stem/progenitor survival and axonal regeneration after complete transection of rat spinal cord[J].Cell Transplant,2012,21 (6):1177-1197.
[15]Deng Q,Cai W,Li S,et al.Small Nogo-66-binding peptide promotes neurite outgrowth through RhoA inhibition after spinal cord injury[J].Brain Res Bull,2013,99:140-144.
[16]吴继彬.Nogo受体拮抗剂与甲基强的松龙联合治疗对脊髓损伤修复的影响[D].苏州:苏州大学,2010:18-33.
Dynamic Expression of Nogo Receptor after Spinal Cord Injury in Rats
YANG Jun-feng,ZHANG Ya-feng,MA Yong,WU Mao,GUO Yang,GU Xiao-lin,WANG Jian-wei.Wuxi Hospital of Chinese Medicine,Institute of Orthopaedics and Traumatology of Nanjing University of Chinese Medicine,Wuxi,Jiangsu 214000,China
ObjectiveTo observe the dynamic expression of Nogo receptor(NgR)in spinal cord of rats after spinal cord injury.Methods108 Sprague-Dawley rats were randomly assigned into normal group,sham operated group and model group,with 36 rats in each group. The model of spinal cord injury was established with the modified Allen's method.The rats were killed 24 h,3 days,7 days and 14 days respectively after intervention(9 rats from each group),and expression of NgR in the spinal cord tissue of the rats was detected with immunohistochemistry and Western blotting,and expression of NgR mRNA was detected with fluorescence quantitative PCR.ResultsThere was no significant change in the expression of NgR in the normal group and the sham operated group(P>0.05).The expression of protein and mRNA of NgR was less in the model group 24 h after modeling,dropped to the lowest on the 3rd day,then rapidly peaked on the 7th day, and gradually declined on the 14th day after spinal cord injury.Compared with the normal group,there were significant differences in expression of NgR in immunohistochemistry and Western blotting in the model group at each time point after spinal cord injury(P<0.05). Compared with the sham operated group,there were significant differences in expression of NgR mRNA in the model group at each time point after spinal cord injury(P<0.01).ConclusionThe expression of NgR and mRNA peaks on the 7th day after spinal cord injury in the rats,and maintains at high level for a long time,which may associated with the difficulty of axonal regeneration after spinal cord injury.
spinal cord injury;Nogo receptor;axonal regeneration;rats
10.3969/j.issn.1006-9771.2014.10.006
R651.2
A
1006-9771(2014)10-0919-05
2014-03-06
2014-04-16)
1.江苏省自然科学基金资助项目(No.BK2011180);2.江苏省2013年度普通高校研究生科研创新计划项目(No.CXZZ13-0614);3.江苏省2012年度普通高校研究生科研创新计划项目(No.CXZZ12-0609)。
1.无锡市中医医院,南京中医药大学骨伤研究所,江苏无锡市214000;2.南京中医药大学,江苏南京市210023。作者简介:杨俊锋(1979-),男,汉族,江苏宜兴市人,硕士,主治医师,主要研究方向:脊柱脊髓损伤。通讯作者:王建伟(1963-),男,汉族,江苏无锡市人,博士,教授,博士生导师,主要研究方向:脊柱脊髓损伤、脊髓肿瘤、脊柱侧弯。E-mail:905966615@qq.com。
时间:2014-06-30 15:56
http://www.cnki.net/kcms/detail/11.3759.R.20140808.0915.003.html
