苦参碱对HT29人结肠癌细胞凋亡及Bax和BcL-2蛋白表达的影响*
2014-05-05胡晓岚
常 城 胡晓岚
(湖北理工学院附属黄石市中心医院,湖北 黄石 435000)
苦参碱对HT29人结肠癌细胞凋亡及Bax和BcL-2蛋白表达的影响*
常 城 胡晓岚△
(湖北理工学院附属黄石市中心医院,湖北 黄石 435000)
目的研究苦参碱对人结肠癌HT29细胞凋亡及Bax和Bcl-2蛋白表达的影响。方法取HT29人结肠癌细胞体外培养,加苦参碱处理24~48 h。采用MTT法检测细胞增殖,使用流式细胞仪检测细胞周期和细胞凋亡,采用Western Blot法检测 Bax和Bcl-2蛋白表达。结果在2~16 mg/mL苦参碱作用下,HT29细胞增殖被明显抑制,且呈剂量和时间依赖性(P<0.05或P<0.01);给予4、8和16 mg/mL苦参碱作用HT29细胞24 h后,细胞凋亡率分别为(14.84±2.35)%、(37.80±2.49)%和(54.10±1.60)%,均明显高于对照组(4.36± 0.23)%(P<0.05);经苦参碱作用24 h后,细胞Bax蛋白表达增加,而BcL-2表达减少,呈剂量依赖性。结论苦参碱能抑制HT29细胞增殖,并促进其凋亡,其机制可能与抑制BcL-2和促进Bax蛋白表达有关。
HT29细胞 凋亡 苦参碱 Bax Bcl-2
苦参碱(matrine)系豆科槐属植物苦参的主要有效成分之一,其分子式为C15H24N2O。有实验研究表明,苦参碱对肺癌、肝癌、胃癌、乳腺癌、宫颈癌和白血病等多种肿瘤细胞的生长具有抑制作用[1-5],但其能否抑制结肠癌细胞的生长,目前尚无文献报道。本实验观察苦参碱对人结肠癌HT29细胞凋亡及凋亡相关蛋白Bax和Bcl-2表达的影响。现报告如下。
1 材料与方法
1.1 细胞与试剂 人结肠癌HT29细胞由武汉大学中南医院肿瘤实验中心提供。苦参碱购自Sigma公司;Annexin V-FITC凋亡检测试剂盒购自南京凯基生物科技发展有限公司;噻唑蓝(MTT)、二甲基亚砜(DMSO)和碘化丙锭(PI)为上海华臣生物试剂有限公司产品;胎牛血清购自杭州四季青公司;RPM1640培养基购自杭州微生物试剂公司;蛋白酶K(Proteinase K)、抗Bcl-2和抗Bax鼠抗人单克隆抗体购自武汉博士德公司。
1.2 实验方法 细胞增殖抑制实验:取人结肠癌HT29细胞,复苏后加10%灭活胎牛血清、青霉素100 U/mL、链霉素100 U/mL的RPMI 1640培养液,置于37℃的5%CO2加湿细胞培养箱内培养[6]。取对数生长期的细胞,在0.25%胰酶消化后,用培养液吹打成单细胞悬液。将细胞密度调整为1×105/mL。以每孔200 μL接种于96孔细胞培养板,分别加入不同质量浓度的苦参碱,终质量浓度分别为2、4、8、16和32 mg/mL,每组各设3个复孔。37℃、5%CO2恒温细胞培养箱中分别培养24、36和48 h,弃去培养液,代之以无血清RPMI 1640培养液0.2 mL/孔,加入MTT 20 μL/孔(终质量浓度为0.5 mg/mL),置于CO2培养箱中继续培养4 h,吸去上清,加入DMSO 150 μL/孔,在酶标仪570 nm波长处读取OD值,计算细胞增殖抑制率。每组实验至少重复3次[7-8]。细胞形态超微观察:取对数生长期HT29细胞,弃培养液,PBS洗涤2次。加0.25%胰酶消化细胞,调整细胞密度,将细胞按1×106个接种于6孔培养板。加入终质量浓度为8 mg/mL的苦参碱,培养24 h。将胰酶消化收集的细胞置于琼脂离心管中,以1 mL 2.5%戊二醛和1%锇酸固定,纯环氧树脂包埋,按常规电镜样本制作程序处理,铅-铀双染色,在透射电镜(JEM-2010HR型,日本电子株式会社)下观察。细胞凋亡检测:应用不同质量浓度的苦参碱处理HT29细胞24 h,用冷PBS缓冲液冲洗2次,重悬于Binding Buffer中。调整细胞密度至1×106/mL,取100 μL重悬后的细胞,加入5 μL Annexin V-FITC和10 μL PI。随即上流式细胞仪(FACScan,美国BD公司)检测,分析细胞凋亡的百分比。凋亡相关蛋白Bax和Bcl-2表达的检测:用Western Blot法,取 HT29细胞,经 MA(4 mg/mL、8 mg/mL和16 mg/mL)处理24 h,消化收集细胞,加入细胞裂解液(20mmoL/mLTris-HCl,pH7.4;150mmoL/mL NaCl,0.5%NP-40,1 mmoL/mL EDTA,50 μg/mL亮肽素,1 mmoL/mL PMSF)100 μL,于4℃12000 r/min离心10 min。等量样品(30 μg/mL)经12.5%SDS–PAGE胶分离蛋白质,将分离后的蛋白质转移到硝酸纤维素膜上。加入一抗过夜,再加入二抗。洗膜后,加入ECL化学显影剂,X光片曝光。
1.3 统计学处理 应用SPSS13.0统计软件。计量资料以(±s)表示,采用方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 苦参碱对HT29细胞生长的抑制作用 见表1。不同质量浓度的苦参碱在24、36、48 h时对HT29细胞都有抑制作用。
2.2 细胞凋亡的形态学变化 见图1。对照组细胞形态正常,细胞膜结构完整,染色质丰富,可见多个核仁;MA处理组细胞出现染色质浓缩、凝固,染色质边集,核固缩。
2.3 细胞凋亡率的变化 经MA作用24 h后,对照组细胞凋亡率为(4.36±0.23)%,3个实验组(4 mg/mL、8 mg/mL和16 mg/mL)细胞凋亡率分别为(14.84± 2.35)%、(37.80±2.49)%和(54.10±1.60)%,与对照组比较,差异均有统计学意义(P<0.05)。
表1 不同质量浓度苦参碱对HT29细胞的生长抑制作用(±s)
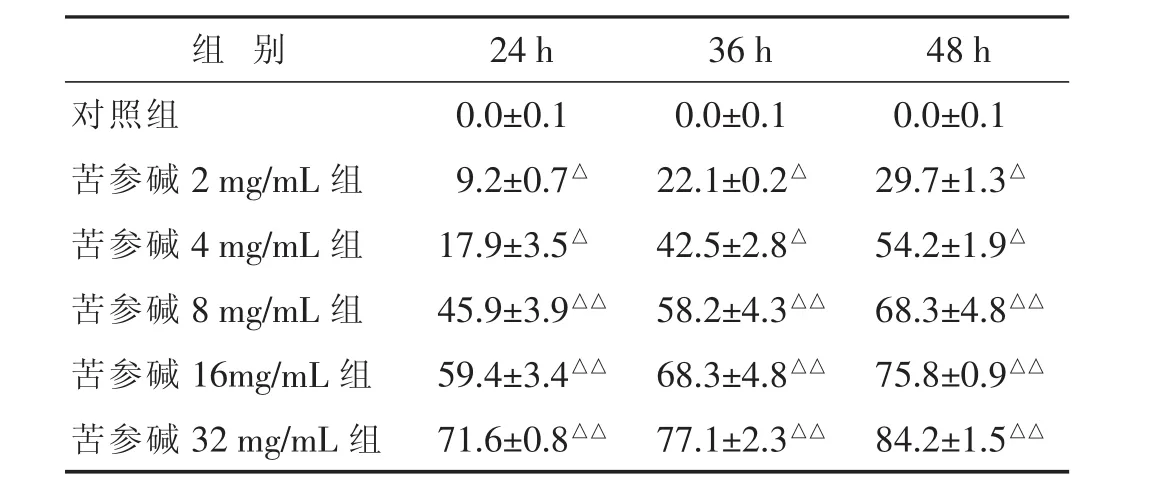
表1 不同质量浓度苦参碱对HT29细胞的生长抑制作用(±s)
与对照组比较,△P<0.05,△△P<0.01。
组 别 24 h 36 h 48 h对照组 0.0±0.1 0.0±0.1 0.0±0.1苦参碱2 mg/mL组 9.2±0.7△ 22.1±0.2△ 29.7±1.3△苦参碱4 mg/mL组 17.9±3.5△ 42.5±2.8△ 54.2±1.9△苦参碱8 mg/mL组 45.9±3.9△△ 58.2±4.3△△ 68.3±4.8△△苦参碱16mg/mL组 59.4±3.4△△ 68.3±4.8△△ 75.8±0.9△△苦参碱32 mg/mL组 71.6±0.8△△ 77.1±2.3△△ 84.2±1.5△△
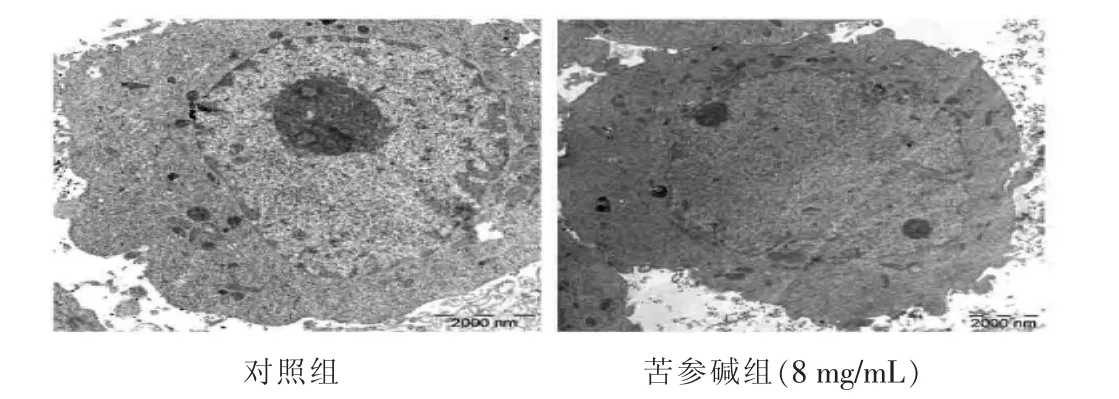
图1 8 mg/mL苦参碱作用细胞24 h后细胞形态变化(5000倍)
2.4 苦参碱对Bax和Bcl-2表达的影响 见图2。苦参碱能够显著降低细胞内Bcl-2表达,并增加细胞内Bax表达,呈剂量依赖性。
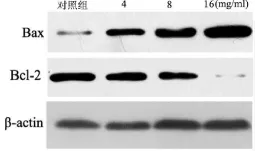
图2 苦参碱作用HT29细胞24 h后Bax和Bcl-2蛋白表达的变化
3 讨论
苦参碱具有较强的抗肿瘤活性,能够抑制多种肿瘤细胞的生长[9-12]。本研究观察到随着药物质量浓度的增高和作用时间的延长,肿瘤细胞增殖受到明显抑制。同时还发现苦参碱能诱导结肠癌细胞凋亡,随着药物质量浓度的增加,细胞凋亡率明显增加,呈剂量依赖性。本实验以8 mg/mL苦参碱作用HT29细胞24 h后,发现细胞核体积缩小,染色质浓缩凝固,染色质边聚、核固缩、核碎裂及凋亡小体出现,进一步证实了苦参碱诱导结肠癌HT29细胞凋亡的作用。笔者还观察到苦参碱对凋亡相关调节蛋白Bax和Bcl-2表达有影响,苦参碱能够显著降低细胞内Bcl-2表达,增加细胞内Bax表达,呈剂量依赖性。由此笔者推测苦参碱通过增加促凋亡蛋白 Bax的表达和减少抑制凋亡蛋白Bcl-2的表达来发挥抗肿瘤作用。
苦参碱在体外可直接抑制或杀伤人结肠癌HT29细胞,具有较强的增殖抑制及诱导凋亡能力,是一种有应用前景的抗肿瘤药物。
[1]韩丹,叶胜龙,刘彬彬,等.Survivin在原发性肝细胞癌中的表达及其与侵袭、转移关系[J].中华实验外科杂志,2007,24(12):1502-1504.
[2]Bosetti C,Levi F,Rosato V,et aL.Recent trends in coLorectaLcancermortaLityinEurope[J].IntJCancer,2011,129(2):180-191.
[3]郑如珍,张静宜,邵喜英.苦参碱促进三苯氧胺诱导乳腺癌Bcap-37细胞凋亡的机制研究[J].肿瘤学杂志,2012,18(6):840-843.
[4]任路平,宋光耀,霍丽静.氧化苦参碱对高果糖喂养诱导大鼠脂肪肝和肝脏内质网应激的干预作用[J].中国医科大学学报,2012,10(7):892-899.
[5]李圆,周雪华,刘亭彦.苦参碱对喉鳞癌细胞株Hep-2侵袭转移的影响[J].中国中西医结合外科杂志,2012,3(2):261-264.
[6]常城,朱尤庆,梅娟娟.去甲斑蝥素对人肝癌HepG2细胞生长抑制作用的实验观察[J].实用癌症杂志,2010,5(5):450-452.
[7]张金梅,常城.去甲斑蝥素对肝癌细胞增殖和凋亡的影响[J].中国肿瘤生物治疗杂志,2011,1(1):33-37.
[8]陈武,陈鹏英,刘鹏.巴豆生物碱对人肝癌SMMC-7721细胞凋亡及Bax,BcL-2蛋白表达的影响[J].中国实验方剂学杂志,2011,11(2):199-201.
[9]Indran IR,Tufo G,Pervaiz S,et al.Recent advances in apoptosis,mitochondria and drug resistance in cancer cells[J]. Biochim Biophys Acta,2011,1807(5):735-745.
[10]Heit B,Yeung T,Grinstein S.Changes in mitochondriaL surface charge mediate recruitment of signaLing moLecuLes during apoptosis[J].Am J PhysioL Cell PhysioL,2011,300(1):33-41.
[11]Lee YS,Jin DQ,Kwon EJ,et al.Asiatic acid,a triterpene,induces apoptosis through intraceLLuLar Ca2+human hepatoma cells[J].Cancer Lett,2002,18(6):83-91.
[12]Venkatesan P,Bhutia SK,Singh AK,et al.AEE788 potentiates ceLecoxib-induced growth inhibition and apoptosis in human coLon cancer cells[J].Life Sci,2012,91(5):789-799.
Effect of Matrine on Apoptosis of HT29 Cells and Inhibition of Bcl-2/Bax Expression in Vitro
CHANG Cheng,HU Xiaolan. Huangshi Central Hospital of Hubei Polytechnic University,Hubei,Huangshi 435000,China
Objective:To study the effect of matrine(MA)on apoptosis and Bcl-2/Bax expression in HT29 cells(human colon cancer cells).Methods:HT29 cells cultured in vitro were subjected to MA at concentration of 2~32 mg/mL for 24 h or 48 h.Cell proliferation and apoptosis were determined by MTT assay and flow cytometry,respectively,and the expression of Bcl-2 and Bax was detected by Western blot.Results:MA(2~16 mg/mL)significantly inhibited the proliferation of HT29 cells in a dose-and time-dependent manner(P<0.05).After intervention of MA at 4,8 or 16 mg/mL for 24h,the percentage of apoptotic cells was increased to (14.84±2.35)%,(37.80±2.49)%and (54.10±1.60)%,respectively,all of which were significantly higher than (4.36±0.23)%in the control group(P<0.05).MA(at 4~16 mg/mL)significantly increased the expression of Bax and decreased the expression of Bcl-2 in a dose-depended manner.Conclusion:MA inhibits proliferation and induces apoptosis of HT29 cells in vitro,probably through down-regulation of Bcl-2 and up-regulation of Bax.
HT29 cell lines;Apoptosis;Matrine;Bax;Bcl-2
R730.59
A
1004-745X(2014)08-1463-03
10.3969/j.issn.1004-745X.2014.08.026
2014-04-03)
湖北省自然科学基金资助(2013CFC061)
△通信作者
