用改进的重叠延伸PCR技术构建三位点突变载体
2014-05-04郭紫芬轩贵平陈方方张式一
郭紫芬,轩贵平,陈方方,张式一
南华大学 药物药理研究所,湖南 衡阳 421001
定点突变是分子生物实验常用的技术之一[1],目前实验室研究常规使用试剂盒进行定点突变,如Ta⁃KaRa公司的多点突变试剂盒[2]、Stratagene公司的定点突变试剂盒[3]。试剂盒不仅价格较昂贵,技术要求程度相对较高,且具体的突变效率也有待进一步验证。重叠延伸PCR技术(splicing by overlap exten⁃sion PCR,SOE PCR)是一种特殊的PCR技术,该技术采用具有互补末端的引物,使PCR产物形成重叠链,从而在随后的扩增反应中通过重叠链的延伸,将不同来源的扩增片段重叠拼接起来。因此,此技术能在体外进行有效的基因拼接、重组,在基因的定点突变方面有着广泛而独特的应用[4-11]。但传统的重叠延伸PCR技术需要依靠琼脂糖凝胶电泳回收PCR产物,此过程繁琐、不经济。在本实验中,我们采用重叠延伸PCR技术结合冷冻析出目的片段的方法,减少了繁琐的琼脂糖凝胶回收步骤,同时设计的点突变引物使突变位点位于引物中间位置,且上下游引物完全互补,使引物设计更加方便,突变成功率也有所保证,节省了大量时间,突变效率高,能一次实现多位点的突变,方便廉价,目前不失为一种值得推广的节约资源的多位点突变方法。
1 材料与方法
1.1 材料
大肠杆菌DH5ɑ为本实验室保存;野生型质粒模板是将人线粒体基因中包含热点突变位点的基因片段插入T载体,且经测序确证序列,用质粒提取试剂盒提取野生型质粒作为模板,在此基础上实现不相邻三位点的同时突变,为试验前期工作结果。质粒小提试剂盒(离心柱形)Plasmid Mini KitⅠ购自Omega公司;琼脂糖凝胶DNA回收试剂盒Wizard SV Gel and PCR Clean-Up System购自Promega公司;高保真度Pfx DNA聚合酶购自Invitrogen公司;限制性内切酶HindⅢ、EcoRⅠ,10×M缓冲液、10×上样缓冲液购自TaKaRa公司。
1.2 引物合成
利用Muta Primer 2.0设计3对定点突变引物,突变位点分别位于人线粒体基因的961、1494和1555位,且均在引物的中间位置,每对引物均为完全互补引物;同时合成pMD-19T载体的一对通用引物。引物序列见表1。
1.3 单重PCR反应
以野生型质粒为模板,引物如表2所示,进行高保真DNA聚合酶介导的双向引物延伸反应,分别得到A、B、C、D共4段PCR产物。PCR反应体系包括模板1 μL,上、下游引物各1 μL,10 mmol/L dNTP 0.5 μL,50 mmol/L MgSO40.5 μL,Enhanced 缓冲液1.25 μL,Pfx酶0.5 μL,10×Pfx酶缓冲液2.5 μL,加水至25 μL。PCR反应条件:94℃预变性2 min;94℃变性15 s,55℃退火 30 s,68℃延伸 60 s,30个循环;4℃降温。
用2.5%的琼脂糖凝胶电泳检测A、B、C、D各段,分别切下含各目的片段的胶条,于-80℃冷冻20 min后,于4℃、12 000 r/min离心5 min,取上清析出液作为模板,进行重叠PCR。
1.4 重叠PCR反应
分别取单重PCR的冷冻析出液2 μL混合,作为模板将2段融合,引物与模板的组合如表3,其他反应体系和反应条件同单重PCR,用2%的琼脂糖凝胶电泳检测反应产物,证实为两目的片段并同单重PCR进行冷冻析出。取重叠PCR产物A+B、C+D段的冷冻析出液各2 μL混合作为模板,以RVM、M13为引物,按单重PCR体系和条件再次进行重叠PCR反应。用1.5%的琼脂糖凝胶电泳检测,回收重叠PCR产物,即融合片段A+B+C+D段。
1.5 突变目的片段的体外重组
将回收的突变目的片段用HindⅢ、EcoRⅠ双酶切,与经相同酶切的野生型质粒模板连接,用化学转化法转入大肠杆菌DH5ɑ感受态细胞,37℃培养于含100 μg/mL氨苄西林的LB固体培养基上,挑取单克隆阳性菌落过夜振荡培养,并以RVM和M13为引物,通过菌液PCR法鉴定阳性克隆,取阳性克隆的菌液交上海生工生物工程公司测定其基因序列。
2 结果
2.1 重叠延伸PCR反应
通过单重PCR扩增得到A、B、C、D共4个PCR片段,与各段预计目的片段A(251 bp)、B(530 bp)、C(82 bp)、D(242 bp)大小一致(图1)。通过重叠PCR得到融合A+B段、C+D段和融合全长目的片段,也与预计目的片段A+B段(781 bp)、C+D段(324 bp)和融合全长(1105 bp)大小一致(图2)。
2.2 突变目的片段的体外重组
全长突变目的片段与野生质粒模板的HindⅢ、EcoRⅠ双酶切结果如图3,各条带位置正确。回收酶切目的片段和质粒,连接后转化大肠杆菌DH5ɑ感受态细胞,随机挑取12个单克隆阳性菌落,振荡培养,得到10管单克隆阳性菌液,分别用M13和RVM引物进行菌液PCR初步筛选,得到转化成功的阳性菌液8管。取PCR反应阳性的菌液各1 mL,交上海生工生物工程公司进行基因测序,结果经Blast同源性分析,表明6个样本同时包含3个定点突变位点,而其他2个样本同时出现了1个非定点突变位点。突变成功的部分测序结果如图4。
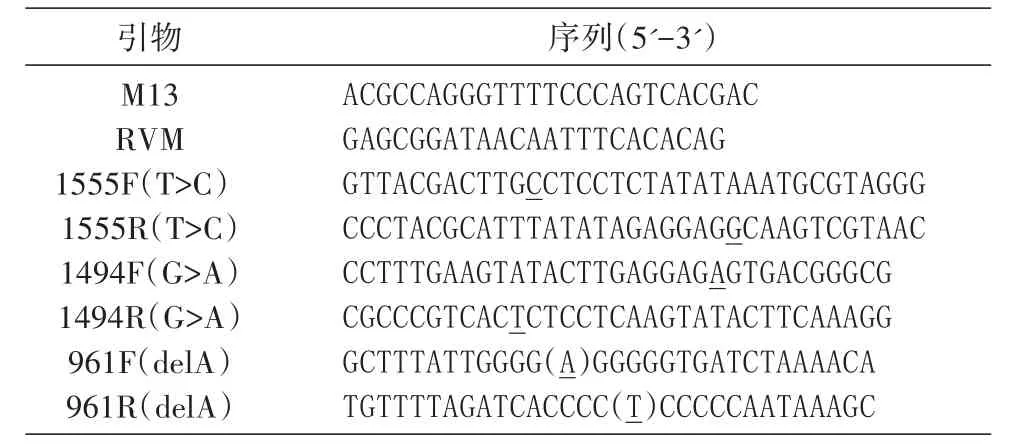
表1 重叠延伸PCR引物序列
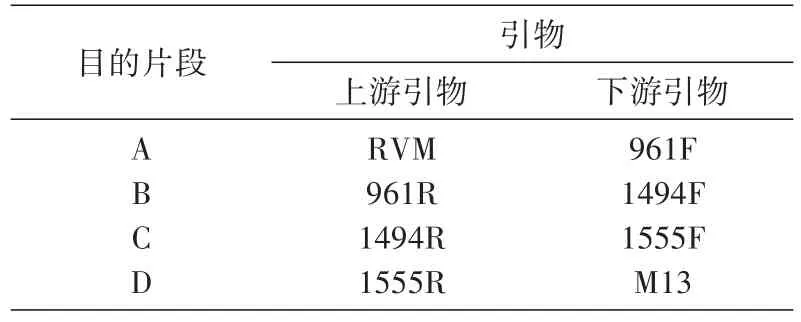
表2 单重PCR各段引物名称
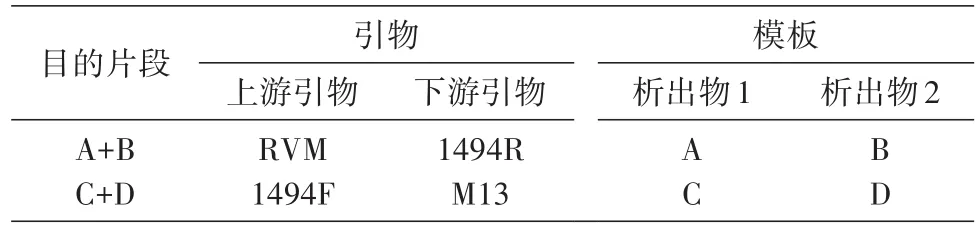
表3 重叠PCR反应引物与模板
3 讨论
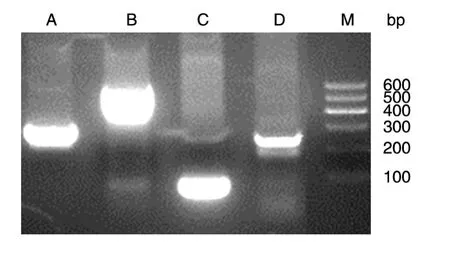
图1 单重PCR扩增各片段
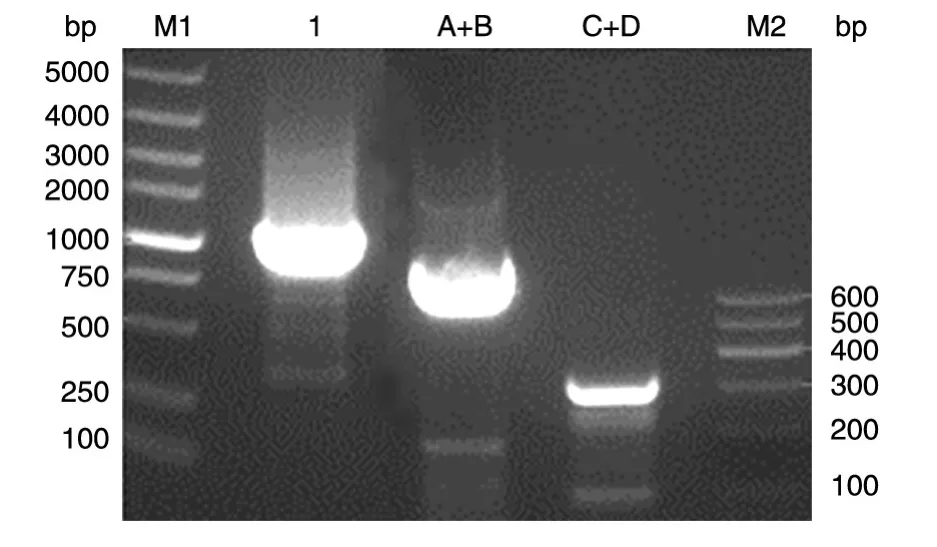
图2 重叠PCR扩增各片段
目前的多点突变试剂盒层出不穷。TaKaRa公司的Multipoints Mutagenesis Kit的原理,是设计合成同一方向的锚定引物及定点突变引物,将锚定引物及定点突变引物用T4多聚核苷酸激酶磷酸化后与模板质粒DNA进行退火,再用T4DNA聚合酶和T4DNA连接酶进行延伸和连接形成突变单链,然后用锚定引物“尾巴”上的特异性引物(ETail F/ETail R)和高保真DNA聚合酶PrimeSTAR对突变单链进行PCR扩增,再将获得的双链PCR产物克隆回原载体中,即可达到实验目的,获得目的突变体。本实验室曾3次运用该试剂盒进行三位点突变,结果3次的测序结果均显示无任何定点突变产生。其原因可能是定点突变引物同锚定引物与质粒退火过程不能保证所有引物均与模板相连,从而导致突变位点的引入困难。应用重叠延伸PCR技术,采用突变位点位于引物中间位置的完全互补引物,PCR扩增出的产物也必定包含引物上的突变位点,相比传统的突变位点位于引物两端而言,既能方便引物设计,又能保证突变位点的顺利引入,提高突变效率。同时,采用冷冻析出法代替各步PCR产物回收,是考虑到PCR需要的模板量相对较少。也有用上一步PCR产物直接作为模板进行下一步PCR反应的[12],但PCR产物中有酶、引物和质粒模板,会使非特异性扩增几率加大,也可能会干扰重叠PCR反应条件,使产物特异性下降。对于剩余引物的干扰问题,虽然有学者提出不对称PCR解决方法,但该方法过于繁琐,需要反复优化条件[13-15]。本实验采用切胶条冷冻析出法,切下的只是包含单重PCR目的条带的部分,经-80℃快速冷冻,离心析出,可方便快捷地得到少量目的产物,作为模板既能保证特异性和需要量,又能使PCR反应更易调控。因此,这种改进的重叠延伸PCR构建同时包含多位点突变质粒,相比本实验室前期所应用的试剂盒,具有高效、廉价、突变特异性高的优点,同时又简便于传统的重叠延伸PCR技术,值得在分子生物学领域发挥更高的使用价值。
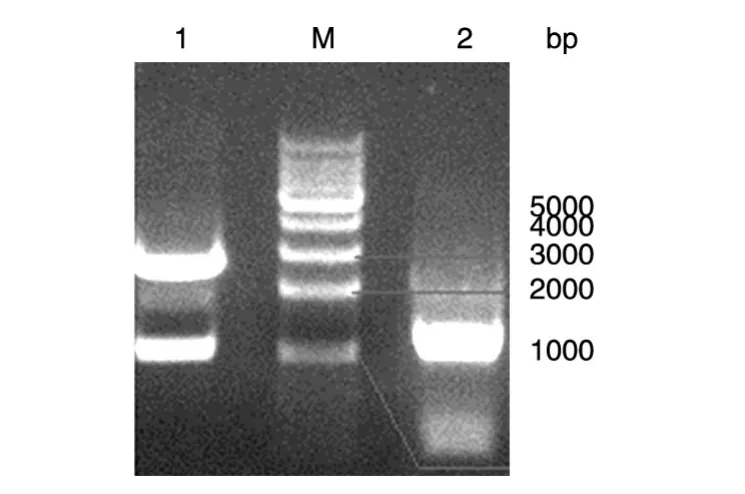
图3 质粒与融合全长片段的双酶切

图4 质粒载体部分测序结果比对图A、B、C:前期构建的野生型质粒;D、E、F:本实验构建的突变型质粒D:1555位T突变为C;E:1494位G突变为A;F:961位缺失A
[1] Heaslet H,Shaw B,Mistry A,et al.Characterization of the activesiteofS.aureusmonofunctionalglycosyltransferase(Mtg)by site-directed mutation and structural analysis of the protein complexed with moenomycin[J].J Struct Biol,2009,167(2):129-135.
[2] Seyfang A,Jin J H.Multiple site-directed mutagenesis of more than 10 sites simultaneously and in a single round[J].Anal Biochem,2004,324(2):285-291.
[3] Deng Q W,Luo W S,Donnenberg M S.Rapid site-directed domain scanning mutagenesis of enteropathogenic Escherichia coli espD[J].Biol Proced Online,2007,(9):18-26.
[4] 赵志英,朱宏谦,张璇.Kir2.1/Kir2.3嵌合体的构建与表达[J].中国药理学通报,2013,29(5):33-36.
[5] Tan L,Chen H,Yu S,et al.A SOE-PCR method of intro⁃ducing multiple mutations into Mycoplasma gallisepticum neur⁃aminidase[J].J Microbiol Methods,2013,94(2):117-120.
[6] 汤辉,石楠,于淼,等.重叠延伸PCR克隆三孢布拉霉carRA基因及其功能活性检测系统的构建[J].生物工程学报,2011,27(7):990-997.
[7] Reddy P K,Ramlal S,Sripathy M H,et al.A simple and universal ligation mediated fusion of genes based on heterostaggered PCR for generating immunodominant chimeric pro⁃teins[J].Gene,2012,509(1):104-109.
[8] 胡正龙,肖旭倩,沈文涛,等.以P型PRSV-VPg为模板多位点突变获得W型PRSV-VPg的研究[J].生命科学研究,2009,13(2):104-108.
[9] 叶程,邵坤彦,王亚南,等.重叠延伸PCR法定点突变微生物产谷氨酰胺转氨酶基因[J].中国生物制品学杂志,2013,26(5):670-674.
[10]谈丹,陈雄,黄敬华,等.微生物谷氨酰胺转胺酶对大鼠创伤愈合作用研究[J].中国生物工程杂志,2007,27(9):85-90.
[11]Chen K K,Liu S,Ma J L,et al.Deletion combined with sat⁃uration mutagenesis of N-terminal residues in transglutamin⁃ase from Streptomyces hygroscopicus results in enhanced activ⁃ity and thermostability[J].Proc Biochem,2012,47(12):2329-2334.
[12]Tan L,Chen H,Yu S.A SOE-PCR method of introducing multiple mutations into Mycoplasma gallisepticum neuramini⁃dase[J].J Microbiol Methods,2013,94(2):117-120.
[13]Ge L,Rudolph P.Simultaneous introduction of multiple muta⁃tions using overlap extension PCR[J].Biotechniques,2009,22(1):28-30.
[14]Xiao Y H,Yin M H,Hou L,et al.Asymmetric overlap exten⁃sion PCR method bypassing intermediate purification and the amplification of wild-type template in site-directed mutagene⁃sis[J].Biotechnol Lett,2007,29(6):925-930.
[15]郭志义,郝小惠,延晋雷,等.改进重叠延伸法引入DNA定点突变的新方法[J].生物技术,2009,19(6):34-36.
