腺病毒55型抗原表位分析及评价
2014-05-04李鹏飞陈堃修冰水张庆波张贺秋
李鹏飞,陈堃,修冰水,张庆波,张贺秋
1.河北联合大学,河北 唐山 063000;2.军事医学科学院 基础医学研究所,北京 100850
腺病毒(adenovirus,Ad)包括1~55血清型[1],能引起急性腺病毒肺炎、急性胃肠炎、眼角膜炎和急性间质性肾炎等多种临床症状[2]。我国常见的呼吸道传播的腺病毒类型主要为3型、7型[3]。腺病毒可以引起呼吸道感染暴发,特别是生活在军队、学校等封闭环境内的人群[4-5]。2006年,陕西省岐山县中学暴发急性呼吸道疾病疫情;2012年2月,河北保定解放军252医院发生聚集性疫情。经鉴定,这2起集中发热事件均由腺病毒55型(Ad55)感染所致。Ad55是由Ad11与Ad14基因重组而形成的新型毒株[6],其临床表现新特征,如发热38.5℃以上、流鼻涕、咽痛、咳嗽、伴有呼吸困难,可能更易于暴发流行,一度被怀疑为SARS、甲流、禽流感[7],可引起公众恐慌。由于缺少有效的针对腺病毒的治疗手段和疫苗,因此针对呼吸道症候群,研制包含Ad55在内的广谱性腺病毒早期快速诊断试剂,对疾病预警、确定隔离人群,控制疾病传播具有重要意义。
人腺病毒基因组长约36 kb,其衣壳呈规则的20面体结构,由六邻体、五邻体和纤突等蛋白组成复合结构[8-9]。六邻体含有型、组和亚组抗原决定簇,是诊断不同血清型的标准[10]。六邻体含有重要的中和性抗原表位,也是疫苗研究的重要靶点[11]。纤突有血清特异性,且含有体外血细胞凝集的种属特异性抗原决定位点。有研究显示,纤突抗体的产生略早于六邻体[12],因此,纤突抗原在早期诊断中具有重要地位。由于Ad55发现较晚,有关其抗原表位分析尚未见报道。我们用生物信息学技术预测了Ad55六邻体和纤突抗原表位,为研制包括Ad55在内的腺病毒血清学检测和疫苗提供免疫学基础。
1 材料和方法
1.1 材料
47份疑似腺病毒呼吸道感染临床样本血清由本室保存;48份正常人血清样本来自北京血站红十字血液中心;大肠杆菌HB101和表达载体pBVIL-1由本室保存;Taq DNA聚合酶为北京百泰克生物技术有限公司产品;T4DNA连接酶为TaKaRa公司产品;DNA限制性内切酶EcoRⅠ和BamHⅠ购自Pro⁃mega公司;配制LB培养基的胰蛋白胨及酵母提取物购自本院条件处;PCR产物回收试剂盒由北京百泰克生物技术有限公司生产。引物全部由上海英骏生物技术有限公司合成;DNA序列测定由中美泰和生物技术有限公司完成。
1.2 抗原表位分析
从 NCBI网站(http://www.ncbi.nlm.nih.gov/guide/proteins/)下载Ad55的氨基酸序列,运用Biosun生物软件比对序列,分析六邻体、纤突的抗原表位情况,确定克隆表达的表位区间。
1.3 引物设计与基因合成
根据抗原表位的氨基酸序列,采用大肠杆菌优势密码子设计并优化优势抗原表位区间的基因(分段设计并合成引物,采用重叠延伸PCR方法合成各基因片段,并逐步将各片段搭桥扩增,最终得到完整的优势抗原区间基因)。
1.4 原核表达载体的构建
设计含酶切位点的上下游引物,对上述基因进行PCR扩增,从而在基因片段两端引入酶切位点,经双酶切后插入经同样酶切的表达载体pBVIL-1,转化大肠杆菌HB101,挑选鉴定阳性克隆并测序。
1.5 抗原表达与纯化
鉴定出的阳性克隆在37℃培养过夜后,转至新鲜的LB培养基,37℃培养2~3 h,至D600nm值为0.4~0.6,42℃诱导表达4 h以上,离心收集菌体,用TE缓冲液冲洗菌体并悬起,超声波破碎细胞,离心收集上清,用阴离子交换柱Sephrose 4B和分子筛Sephdex G50纯化抗原,SDS-PAGE鉴定各步分离产物。
1.6 间接ELISA法评价Ad55主要抗原表位活性
以纯化的Ad55主要抗原表位蛋白包被酶联板,用间接ELISA法对疑似患者和正常人血清样本进行测定,根据D450nm值计算S/c,评价重组抗原的反应活性。
2 结果
2.1 序列比对与抗原表位选择
运用Biosun生物软件预测Ad55六邻体、纤突蛋白抗原表位,表位峰值较高的区段如图1中横线所示,Ad55六邻体含有4个连续表位(130~190、180~240、230~280和270~322 aa,以下分别称为表位1~表位4)和2个非连续表位(410~460和620~680 aa,以下分别称为表位5、表位6),纤突含有2个主要抗原表位(135~165和210~260 aa,以下分别称为表位7、表位8),作为克隆表达的目的序列。
2.2 抗原表达与纯化
测序结果显示基因插入正确。将测序正确的表达菌株进行大量诱导表达,超声波裂解后的菌悬液几乎无沉淀,经SDS-PAGE鉴定,8个融合Ad55蛋白为包涵体形式表达,纯化后,其纯度可达95%以上。
2.3 间接ELISA评价8个融合Ad55蛋白的抗原性
以纯化的融合Ad55蛋白包被酶联板,用间接ELISA初步检测48例正常人和47例疑似患者的血清,ROC曲线分析结果见图3。其中表位4、5和8的ROC 曲线下面积(AUC)分别为 0.76(P<0.05)、0.77(P<0.05)和0.81(P<0.05),具有一定的诊断意义。
2.4 3种Ad55诊断抗原的变异分析
考虑到腺病毒具有多个血清型,我们对筛选的表位4、5和7等3个Ad55表位与其他血清型之间的变异情况进行了比较,主要筛选了临床具有呼吸道症状,且在我国有流行传播的3、7、11和14共4种血清型,结果见表1。筛选的Ad55表位与不同腺病毒血清型之间的序列同源性并不相同,3个Ad55表位均与Ad11相关表位之间的同源性最高,与Ad3的同源性最低,提示3个表位除了可检出Ad55外,对Ad11也有相同的检出能力。表位7除了与Ad3差异较大外,与Ad7、Ad11、Ad14其他型别之间具有较高的同源性;表位5除了与Ad11高度同源外,与Ad3、Ad7、Ad11存在较大差异,是最有可能具有Ad55血清学特异性的抗原。这一结果提示,可通过一定的抗原组合达到针对多种腺病毒血清型的检测目的。
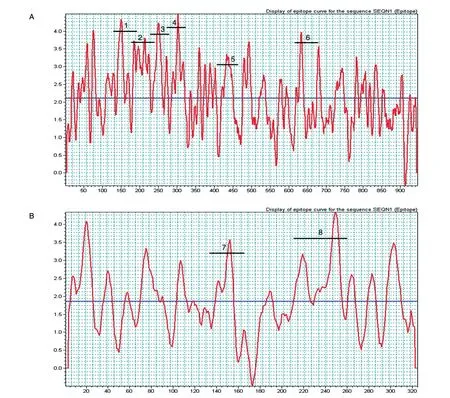
图1 Ad55六邻体(A)和纤突(B)的抗原表位分析
3 讨论
腺病毒在我国上世纪50~60年代出现过大规模流行,其中儿童感染肺炎死亡率高达30%[13]。沉寂了半个世纪后,近些年国内又暴发了多起腺病毒感染造成的集体发热疫情。由于腺病毒引发的肺炎症状并不典型,且对抗生素不敏感,一度被怀疑为SARS、甲流、禽流感等,给公众造成一定的恐慌,因此,对腺病毒的早期诊断具有重要意义。

图2 8种Ad55表位抗原的纯化M:蛋白marker;1~8:依次为表位1~8
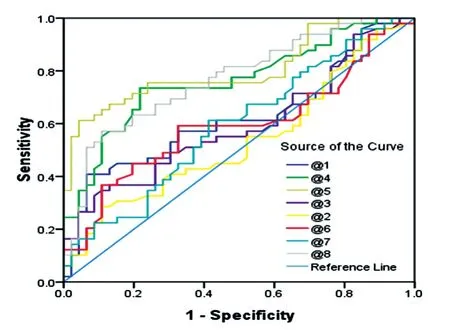
图3 8种Ad55表位抗原检测的ROC曲线

表1 Ad55筛选表位氨基酸序列的同源性分析
目前针对腺病毒的检测主要是基因检测,具有灵敏度高、能分型等特点[14],但操作复杂,仪器昂贵,无法用于基层。20世纪60年代临床建立的以免疫荧光为主的腺病毒抗原检测,主要针对3型和7型,往往难以检测新的腺病毒血清型[15]。本研究针对新发腺病毒55开展相关抗原研究,为研发广谱性腺病毒免疫学检测技术打下基础。
Ad55是由腺病毒11型与14型基因重组形成的新型毒株[3],是新发传染病原。我们初步用疑似腺病毒感染者血清筛选出3个Ad55抗原表位,序列比较结果提示Ad55抗原与Ad11高度同源,与Ad3、Ad7的同源性较差。因此,针对Ad3、Ad7的单抗无法识别新发的Ad55表位,是造成Ad55漏检的主要原因。本研究获得的3个表位,特别是135~165 aa表位,与除Ad3型外所有的腺病毒血清型高度同源。因此,补充Ad3型相关表位,联合本研究筛选的表位,能提高检测腺病毒血清型的覆盖面,最终为研制包括Ad3、Ad7、Ad11、Ad14、Ad55在内的我国通用性呼吸道症状腺病毒的免疫检测奠定基础。
[1] Matsushima Y,Shimizu H,Kano A,et al.Novel human ade⁃novirusstrain,Bangladesh[J]. Emerg Infect Dis, 2012,18(5):846-848.
[2] Athappilly F K,Murali R,Rux J J,et al.The refined crystal structureof hexon,the major coat protein of adenovirus type 2,at 2.9A resolution[J].Mol Biol,1994,30;242(4):430-455.
[3] 辛若雷,包怡华,张勤,等.用抗合成多肽抗体分析呼吸道HAdV六邻体保守区抗原表位[J].细胞与分子免疫学杂志,2002,18(5):481-485.
[4] Noda M,Yoshida T,Sakaguchi T,et al.Molecular and epide⁃miological analyses of human adenovirus type 7 strains isolat⁃ed from the 1995 nationwide outbreak in Japan[J].Clin Micro⁃biol,2002,40(1):140-145.
[5] Xu W,Erdman D D.Type-specific identification of human ad⁃enovirus 3,7,and 21 by a multiplex PCR assay[J].Med Vi⁃rol,2001,64(4):537-542.
[6] Walsh M P,Seto J,Jones M S,et al.Computational analysis identifies human adenovirus type 55 as a re-emergent acute⁃respiratory disease pathogen[J].Clin Microbiol,2010,48(3):991-993.
[7] Tang L,Wang L,Tan X J,et al.Adenovirus serotype 7 asso⁃ciated with a severe lower respiratory tract disease outbreak in infants in Shaanxi Province,China[J].Virol J,2011,8:23.
[8] Cardona C J,Nazerian K,Reed W M,et al.Characterization of a recombinant fowlpox virus expressing the native hexon of hemorrhagic enteritisvirus[J].VirusGenes,2001,22(3):353-361.
[9] Reubel G H,Studdert M J.Identification,cloning and se⁃quence analysis of the equine adenovirus1 hexon gene[J].Arch Virol,1997,142(6):1193-1212.
[10]Thomson D,Meers J,Harrach B.Molecular confirmation of an adenovirus in brushtail possums(Trichosurus vulpecula)[J].Virus Res.,2002,26;83(1-2):189-195.
[11]Roy S,Shirley P S,McClelland A,et al.Circumvention of im⁃munity to the adenovirus major coat protein hexon[J].J Virol,1998,72(8):6875-6879.
[12]Yu B,Dong J,Wang C,et al.Characteristics of neutralizing antibodies to adenovirus capsid proteins in human and animal sera[J].Virology,2013,15;437(2):118-123.
[13]Walls T,Shankar A G,Shingadia D.Adenovirus:an increas⁃ingly important pathogen in paediatric bone marrow transplant patients[J].Lancet Infect Dis,2003,3(2):79-86.
[14]Blyn L B,Hall T A,Libby B,et al.Rapid detection and mo⁃lecular serotyping of adenovirus by use of PCR followed by electrospray ionization mass spectrometry[J].Clin Microbiol,2008,46(2):644-651.
[15]Shetty A K,Treynor E,Hill D W et al.Comparison of con⁃ventional viral cultures with direct fluorescent antibody stains for diagnosis of community-acquired respiratory virus infec⁃tions in hospitalized children[J].Pediatr Infect Dis J,2003,22(9):789-794.
