活化相关分泌蛋白1单克隆抗体的制备及其在保守结构域鉴定中的应用
2014-05-04郭晶晶于虹杨裔孙维来肖文珺郭彦寇志华周育森
郭晶晶,于虹,杨裔,孙维来,肖文珺 ,郭彦 ,寇志华,周育森
1.中南大学 基础医学院,湖南 长沙 410000;2.军事医学科学院 微生物流行病研究所,病原生物学国家重点实验室,北京 100071
活化相关分泌蛋白1(activation-associated se⁃creted protein-1,ASP-1)是盘尾丝虫L3期分泌的一种重要蛋白[1],在宿主体内具有免疫调节功能,可降低宿主的免疫应答[2-3],起到免疫逃逸作用[4],其相对分子质量为 24.9×103[5]。研究发现,ASP-1 无需佐剂就能诱导机体产生高水平的IgG抗体,包括IgG1、IgG2a类抗体,诱导的免疫应答具有Th1型优势[6]。ASP-1作为非毒素类生物佐剂,还可以增强多种形式的抗原,如蛋白抗原、多肽抗原或疫苗的免疫原性,能同时诱导体液免疫和细胞免疫[7-8]。ASP-1发挥佐剂活性的机制研究表明,ASP-1通过与抗原提呈细胞上的TLR2、TLR4结合,激活APC,进而诱导Th1型和Th2型细胞因子,包括IFN-γ、TNF-α,IL-5等分泌,发挥佐剂活性[9]。同时还发现ASP-1的免疫原性较强,在诱导机体产生自身抗体的情况下,其佐剂活性有所下降[10]。因此,降低ASP-1的免疫原性的同时保留其佐剂活性有重要意义,但目前ASP-1的佐剂活性功能区及作用机制尚不清楚。因此,研究ASP-1佐剂的活性功能区及作用机制,对于深入认识并应用这种新型佐剂具有重要意义。
单克隆抗体是系统研究ASP-1的佐剂活性功能区及发挥佐剂活性作用机制的重要工具,但目前国内外尚无ASP-1单克隆抗体,因此,制备ASP-1特异性单克隆抗体并明确其抗原结合域具有重要的应用价值。我们制备了5株能稳定分泌抗ASP-1单克隆抗体的杂交瘤细胞株,并用制备的单抗对ASP-1保守结构域进行了鉴定,为深入研究ASP-1佐剂活性功能域奠定了基础。
1 材料与方法
1.1 材料
6~8周龄BALB/c雌性小鼠由军事医学科学院实验动物中心提供;小鼠骨髓瘤细胞系Sp2/0由本实验室保存;甘油中保存的重组菌pQE30/M15/ASP-1、无关抗HA单抗及无关蛋白TF由本室提供;IPTG购自金科宏达公司;Ni-charged resin及内毒素鲎试剂检测试剂盒购自金斯瑞公司;PEG-6000购自Roche公司;蛋白marker、蛋白定量试剂盒购自天根公司;鼠抗His抗体、HRP-山羊抗小鼠IgG抗体购自北京中杉金桥公司;ELISA显色液A、B及终止液购自北京万泰生物制药公司;超敏发光液、PVDF膜购自MILLIPORE公司;RPMI-1640培养基、HAT选择培养基、1%HT培养液购自北京天润善达科技有限公司;透析袋MD34购自北京瑞达恒辉公司;酶联免疫检测仪(ELx808)购自BioTek公司。
1.2 ASP-1重组蛋白的表达纯化及鉴定
重组ASP-1的表达纯化参照文献进行[11]。利用梯度复性法,即6 mol/L尿素-2 mol/L尿素-PBS对目的蛋白进行复性,用Balford法测定蛋白浓度,对重组ASP-1进行内毒素检测,即在分装有100 μL鲎试剂溶液的试管中加入100 μL样品,设立阴性对照(无内毒素水)、阳性对照(内毒素标准品),37℃恒温器孵育60 min取出观察结果,依据是否出现凝胶判断是否为阳性。
1.3 抗ASP-1单克隆抗体杂交瘤细胞的制备、筛选及细胞培养上清抗体效价测定
取6只6~8周龄BALB/c雌性小鼠,不加佐剂免疫重组ASP-1(每只25 μg/次),每3周免疫1次,共免疫3次,用间接ELISA检测至血清中抗ASP-1抗体效价达到106以上。
融合前1周复苏小鼠骨髓瘤Sp2/0细胞,用含20%胎牛血清的RPMI-1640完全培养基培养。选取对数生长期且状态良好的细胞制得小鼠骨髓瘤细胞悬液,同时处死免疫小鼠,无菌取脾制得脾细胞悬液,待融合。
细胞融合采用常规方法进行[12]。融合前1 d取正常小鼠的腹腔巨噬细胞作为饲养细胞,取骨髓瘤Sp2/0细胞和免疫小鼠脾细胞,以PEG1500为融合剂进行融合,采用间接ELISA筛选杂交瘤细胞。将初步筛选得到的阳性细胞克隆株用有限稀释法进行4次亚克隆,筛选出稳定高表达单克隆抗体的特异性杂交瘤细胞株。用ASP-1包被,采用间接ELISA测定杂交瘤细胞株培养液上清中的抗体效价。
1.4 含单克隆抗体腹水的制备及效价测定
选择扩大培养后状态良好的亚克隆筛选出的高表达阳性细胞株冻存;复苏冻存的杂交瘤细胞,10~15 d后收集处于对数生长期的细胞,用PBS洗涤3次,配成浓度为1×106/mL的细胞悬液,腹腔注射事先用液体石蜡致敏的BALB/c雌性小鼠,每只0.5 mL;10~12 d后小鼠腹部明显膨大,采集腹水并离心,收集上清,置-70℃保存;用ASP-1蛋白包被,采用间接ELISA测定腹水效价。
1.5 单克隆抗体特性鉴定
1.5.1 单克隆抗体的特异性鉴定 用ASP-1蛋白包被抗原,以稀释的腹水单抗为一抗、无关腹水抗HA单抗为阴性对照、HRP-羊抗小鼠IgG为二抗,测量D450nm值,>2倍对照组D450nm平均值即判断为阳性。
1.5.2 单克隆抗体的亚类鉴定 采用间接ELISA,以ASP-1重组蛋白为抗原,包被浓度为2 μg/mL,以收集的杂交瘤细胞上清为一抗,使用不同IgG亚类鉴定试剂盒里的酶标二抗(IgG1、IgG2a、IgG2b、IgG3、IgM、IgA)进行鉴定。酶标仪检测D450nm值,>2倍对照组D450nm平均值即判断为阳性。
1.6 单克隆抗体识别ASP-1保守结构域的鉴定
1.6.1 单抗识别8个保守结构域单肽的ELISA检测 运用生物信息学技术对ASP-1全长序列进行预测分析,设计并合成了8个保守结构域的单肽。采用间接ELISA,以合成的ASP-1的8个单肽为包被抗原,包被浓度为5 μg/mL,以5株腹水为一抗,多克隆阳性血清及阴性血清分别为阳性、阴性对照,HRP-山羊抗小鼠IgG为二抗,检测D450nm值,>2倍对照组D450nm平均值即判断为阳性。
1.6.2 单抗识别ASP-1及截短片段PRM的ELISA、Western印迹检测 为了进一步验证单抗识别的保守结构域,我们设计并构建了不含单抗识别保守结构域的ASP-1截短片段PRM,并采用间接ELISA及Western印迹检测单抗是否识别不含保守结构域的PRM。ELISA分别以ASP-1和PRM为包被抗原,以免疫ASP-1的小鼠阳性血清为一抗,阴性血清为对照,验证阳性血清是否和2种蛋白反应;然后以单抗为一抗、无关腹水抗HA单抗为阴性对照,验证单抗对2种蛋白的识别,检测D450nm值,判定标准同上。Western 印 迹 取 ASP-1、PRM 各 0.5 μg 进 行 12%SDS-PAGE,转膜封闭后,以单抗为一抗,按1∶5000稀释,以HRP-羊抗小鼠IgG为二抗,按1∶8000稀释,用化学发光法进行发光检测。
2 结果
2.1 重组ASP-1在原核系统中的表达纯化及鉴定
重组ASP-1表达形式以包涵体为主。过柱纯化后,经Alphalmager HP扫描软件扫描,100 mmol/L咪唑洗脱液中目的蛋白占总条带的99.1%,说明纯度大于95%(图1)。用梯度复性方法复性,收集蛋白后进行内毒素检测,发现内毒素含量小于0.25 EU/mL,可作为抗原免疫小鼠。
2.2 稳定分泌特异性抗体的杂交瘤细胞株的筛选
采用杂交瘤技术及有限稀释传代法筛选稳定分泌特异性抗体的杂交瘤细胞株。融合后数日观察,大多数孔出现透亮并聚集生长的细胞,筛选出21孔分泌阳性抗体的杂交瘤细胞,选取其中阳性值较高者进行有限稀释。在显微镜下观察,发现220孔内有单个细胞集落,用间接ELISA筛选鉴定,发现其中14个克隆为阳性克隆。亚克隆3次后扩大培养,获得5株稳定分泌特异性抗体的杂交瘤细胞株。收集细胞培养上清进行ELISA检测,发现4株杂交瘤细胞上清在1/320的稀释度下,与ASP-1反应的D450nm值为1.5以上(上清3-1的D450nm值较低,为0.7,也判断为阳性),而与无关蛋白TF反应时D450nm值均在0.1以下(图2)。说明5株杂交瘤细胞上清仅与ASP-1发生特异性反应,不与无关蛋白TF反应。
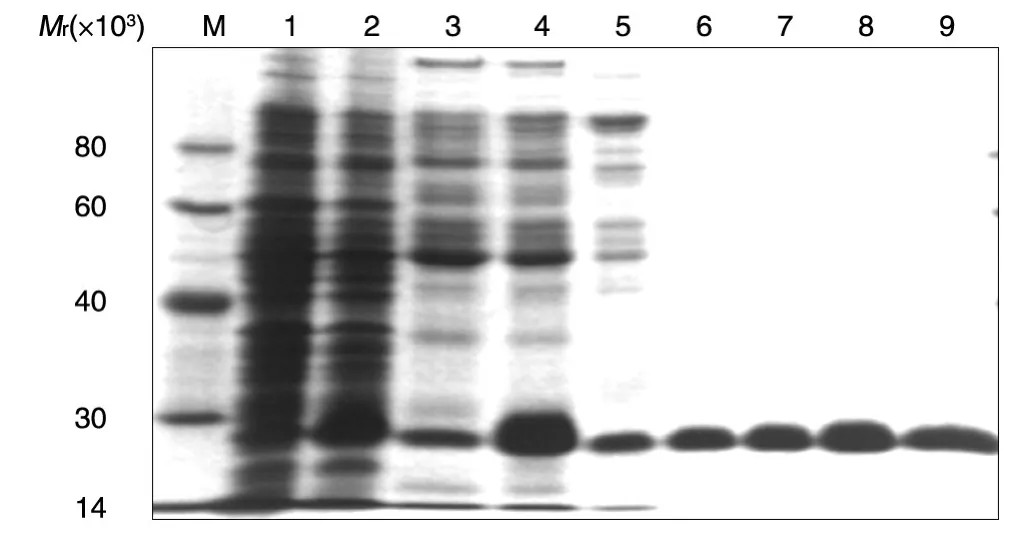
图1 ASP-1在大肠杆菌中的表达及纯化

图2 杂交瘤细胞上清抗体水平检测结果ASP-1:5株单抗与ASP-1反应;无关蛋白:5株单抗与无关蛋白反应
2.3 含抗ASP-1单克隆抗体的腹水效价测定及亚类鉴定
复苏5株杂交瘤细胞株,注射小鼠腹腔获得5株能稳定分泌特异性抗体的腹水单抗。间接ELISA检测结果显示,5株单抗均能和ASP-1蛋白发生特异性结合,其中4株效价均在106以上,单抗3-1效价较低,为103,但仍为阳性(图3)。进一步做亚类鉴定,5株单抗亚类均为IgG1,轻链均为λ型。
2.4 单克隆抗体识别区域的确定
ASP-1属于CAP蛋白超家族,在空间结构上具有该家族的保守结构域[13]。为进一步研究ASP-1的佐剂活性功能区,对ASP-1全长序列进行了预测分析,设计并合成了8个保守结构域的单肽,其氨基酸序列及所属功能域见表1。
ELISA检测结果表明,5株单抗只识别单肽P2,对其余7个单肽均不识别。单肽P2(21~35 aa)和P3(29~43 aa)的重叠部分为29~35氨基酸残基,重叠序列是RKKIVGQ,因此这5株单抗的识别区域是21~28氨基酸残基的保守结构域GGKLTALE(图4)。
为了进一步验证单抗识别21~28氨基酸残基的保守结构域,我们设计并构建了不含21~28 aa的ASP-1截短片段PRM。由于5株单抗均识别同一区域,故只用单抗1-1进行保守结构域的研究。ELISA检测结果显示,ASP-1多克隆阳性血清可以和ASP-1、PRM反应(图5A),而单抗1-1不识别不含21~28 aa的PRM,但识别ASP-1(图5B)。说明单抗1-1识别21~28氨基酸残基的保守结构域。Western印迹及SDS-PAGE结果也证明了这一结论(图5C、D)。

图3 单克隆抗体腹水效价测定

表1 ASP-1 8个单肽的氨基酸序列及所属功能域

图4 不同单抗与8个单肽的反应检测1~5:分别为单抗1-2、2-2、3-1、4-1和7-2;6:阳性血清
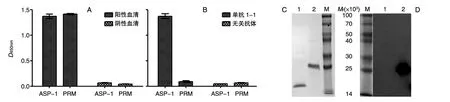
图5 ELISA和Western印迹鉴定单抗1-1识别ASP-1的保守结构域
3 讨论
ASP-1作为一种有应用前景的微生物来源的佐剂,具有直接与抗原混合即可发挥佐剂活性、诱导免疫反应具有Th1型偏倚、可降低联合免疫疫苗的使用剂量、平衡免疫应答等特点。ASP-1属CAP[cys⁃teine-rich secretory proteins(CRISPS),antigen 5(Ag5),and pathogenesis-related 1(Pr-1)]蛋白超家族。该家族的核心区域是一个类似三明治的空间结构αβα,即3条反向平行的β折叠夹在2个α螺旋层面之间,其中一个α螺旋层面由2个平行的α螺旋构成,另一个层面由单独的一条α螺旋构成[14-16]。由于ASP-1的免疫原性较强,产生自身抗体后会使佐剂活性下降,因此降低其免疫原性,同时保留其佐剂活性有重要意义。单抗作为系统研究ASP-1佐剂活性功能域的有效工具,可在鉴定ASP-1保守结构域的应用方面发挥重要作用。
本实验选择有限稀释法进行亚克隆,因为该法简单、易操作,易从细胞群中筛选遗传稳定且同源的细胞系。经过3次亚克隆后筛选出5株阳性克隆细胞株,上清效价在103以上。注射小鼠后获得5株单抗腹水,除单抗3-1外,效价均在106以上,亚类均为IgG1,轻链均为λ型。最终获得的5株单抗,抗体效价高,特异性好,但所得单抗数量少,且均识别21~28氨基酸残基的保守结构域。经Lasergene软件的Protean分析,发现ASP-1的21~28氨基酸残基是B细胞优势表位,在不加佐剂条件下机体产生的抗体主要针对该表位。
由于5株单抗均识别同一区域,故只应用单抗1-1进行了保守结构域的研究,分别与ASP-1、不含21~28 aa保守结构域的PRM蛋白进行ELISA,结果显示在ASP-1多克隆抗体血清可识别ASP-1及PRM的情况下,单抗1-1不识别PRM,但识别ASP-1。进一步验证了单抗1-1识别ASP-1上21~28氨基酸残基的保守性结构域GGKLTALE。
综上,ASP-1单抗的制备,为深入研究ASP-1佐剂活性功能域及其发挥佐剂活性的作用机制奠定了基础。
[1] Joseph G T,Huima T,Lustigman S.Characterization of an Onchocerca volvulus L3-specific larval antigen,Ov-ALT-1[J].Mol Biochem Parasitol,1998,96(1-2):177-183.
[2] Maizels R M,Balic A,Gomez-Escobar N,et al.Helminth parasites-masters of regulation[J].Immunol Rev,2004,201:89-116.
[3] MacDonald A J,Turaga P S,Harmon-Brown C,et al.Differ⁃entialcytokineand antibodyresponsestoadultand larval stagesofOnchocercavolvulusconsistentwith thedevelop⁃ment of concomitant immunity[J].Infect Immun,2002,70(6):2796-2804.
[4] Hawdon J M,Hotez P J.Hookworm:developmental biology of the infectious process[J].Curr Opin Genet Dev,1996,6(5):618-623.
[5] Tawe W,Pearlman E,Unnasch T R,et al.Angiogenic activi⁃ty of Onchocerca volvulus recombinant proteins similar to ves⁃pid venom antigen 5[J].Mol Biochem Parasitol,2000,109(2):91-99.
[6] MacDonald A J,Tawe W,Leon O,et al.Ov-ASP-1,the On⁃chocerca volvulus homologue of the activation associated se⁃creted protein familyisimmunostimulatoryand can induce protective anti-larval immunity[J].Parasite Immunol,2004,26(1):53-62.
[7] MacDonald A J,Cao L,He Y,et al.rOv-ASP-1,a recombi⁃nant secreted protein of the helminth Onchocercavolvulus,is a potent adjuvant for inducing antibodies to ovalbumin,HIV-1 polypeptide and SARS-CoV peptide antigens[J].Vaccine,2005,23(26):3446-3452.
[8] Xiao W,Du L,Liang C,et al.Evaluation of recombinant On⁃chocerca volvulus activation associated protein-1(ASP-1)as a potent Th1-biased adjuvant with a panel of protein or pep⁃tide-based antigensand commercialinactivated vaccines[J].Vaccine,2008,26(39):5022-5029.
[9] He Y,Barker S J,MacDonald A J,et al.Recombinant Ov-ASP-1,a Th1-biased protein adjuvant derived from the hel⁃minth Onchocerca volvulus,can directly bind and activate an⁃tigen-presenting cells[J].J Immunol,2009,182(7):4005-4016.
[10]Wang J,Tricoche N,Du L,et al.The adjuvanticity of an O.volvulus-derived rOv-ASP-1 protein in mice using sequential vaccinations and in non-human primates[J].PLoS One,2012,7(5):e37019.
[11]MacDonald A,Libri N,Lustigman S,et al.A novel,hel⁃minth-derived immunostimulantenhanceshuman recallre⁃sponses to hepatitis C virus and tetanus toxoid and is depen⁃dent on CD56+cells for its action[J].Clin Exp Immunol,2008,152(2):265-273.
[12]朱学泰,谢溱,马瑞君.单克隆抗体制备技术研究进展[J].甘肃科技,2005,21(3):108-109.
[13]Yatsuda A,Eysker M,Vieira-Bressan M,et al.A family of activation associated secreted protein(ASP)homologues of Coo⁃peria punctata[J].Res Vet Sci,2002,73(3):297-306.
[14]Gibbs G M,Roelants K,O'Bryan M K.The CAP superfami⁃ly:cysteine-rich secretory proteins,antigen 5,and pathogene⁃sis-related 1 proteins-roles in reproduction,cancer,and im⁃mune defense[J].Endocrine Rev,2008,29(7):865-897.
[15]Asojo O A.Structure of a two-CAP-domain protein from the human hookworm parasite Necator americanus[J].Acta Crystal⁃logr D,2011,67(Pt 5):455-462.
[16]Asojo O A,Goud G,Dhar K,et al.X-ray structure of Na-ASP-2,a pathogenesis-related-1 protein from the nematode parasite,Necator americanus,and a vaccine antigen for hu⁃man hookworm infection[J].J Mol Biol,2005,346(3):801-814.
