芽胞杆菌发酵产2,3-丁二醇的研究进展及展望
2014-05-04李理想马翠卿
张 帜,李理想,马翠卿
(山东大学 微生物技术国家重点实验室,济南 250100)
2,3-丁二醇(2,3-butanediol,2,3-BD)是一种 C4平台化合物,被广泛应用于食品、化工和航空航天燃料等领域,它可直接用作增湿剂、软化剂和风味添加剂等,也可用来制备聚合物、油墨、香水、熏蒸剂、增塑剂、炸药以及药物的手性载体等[1-5]。2,3-丁二醇的燃烧值为27 200 kJ/kg,与乙醇(29 055 kJ/kg)和甲醇(22 081 kJ/kg)相当,是一种潜在价值很高的燃料添加剂[6]。如(2R,3R)-2,3-丁二醇由于具有较低的凝固点(-60℃),因此可以作为抗冻剂[2,7],而 meso-2,3-丁 二 醇 还 可 用 于 聚 合 物 的生产[8]。
2,3-丁二醇的衍生物也具有重要用途。例如,2,3-丁二醇在脱氢酶的作用下生成的3-羟基丁酮,是一种常用的香料,用作奶油、干酪、咖啡和果实的香味增强剂[9];2,3-丁二醇脱水产物甲乙酮,是一种优良的有机溶剂,在胶黏剂、合成革、油墨和涂料等工业领域具有广泛的应用[2,5];2,3-丁二醇脱水产生的1,3-丁二烯,可用于合成树脂和橡胶等;2,3-丁二醇与甲乙酮缩合并进行加氢反应生成的辛烷,可用来产生高质量的航空燃料[2,5]。目前,2,3-丁二醇及其衍生物的市场需求据估计可达到每年3 000万t以上,其市场价值高达430 亿美元[10]。
芽胞杆菌属(Bacillus)微生物是革兰氏染色阳性菌,具有产生芽胞、需氧或兼性厌氧的特性。芽胞杆菌由于能够产生芽胞,具有较强的环境抗逆性;同时,芽胞杆菌具有较强的C源利用能力,可利用包括葡萄糖、果糖和木糖等单糖,蔗糖和纤维二糖等二糖以及淀粉等复杂C源,因此,广泛应用于生产乳酸、聚谷氨酸和乙偶姻等化学品[9,11-12]。目前,枯草芽胞杆菌(Bacillus subtilis)、地衣芽胞杆菌(B.licheniformis)、多粘类芽胞杆菌(Paenibacillus polymyxa)和淀粉液化芽胞杆菌(B.amyloliquefaciens),被用于 2,3-丁二醇的生产研究。本文中,笔者综述近年来利用芽胞杆菌进行2,3-丁二醇生产的研究进展,并对其研究方向进行展望。
1 芽胞杆菌发酵2,3-丁二醇能力对比
芽胞杆菌广泛分布于土壤、水体和空气中。芽胞杆菌与其他细菌相比,具有生长繁殖迅速、代谢快、体积大、生命力顽强等优点。芽胞杆菌发酵产2,3-丁二醇的研究已有很多年的历史[5],目前已有报道的产2,3-丁二醇的菌株主要包括多粘类芽胞杆菌、地衣芽胞杆菌、枯草芽胞杆菌、地芽胞杆菌和解淀粉芽胞杆菌,这些菌株属于非致病性芽胞杆菌,被认为是GRAS(generally recongnized as safe)细菌。各菌株特点及产2,3-丁二醇能力见表1。
1.1 多粘类芽胞杆菌
多粘类芽胞杆菌(Paenibacillus polymyxa)是目前研究较多的2,3-丁二醇生产菌株。其早期在分类学上归为芽胞杆菌属,且由于其在形态特征、生理生化特征、发酵特性等很多方面与芽胞杆菌类似,因此,本文中笔者将其与其他芽胞杆菌一起进行比较。

表1 利用芽胞杆菌进行2,3-丁二醇生产的研究Table 1 Researches for production of 2,3-BD by Bacillus sp.
多粘芽胞杆菌是目前报道的唯一一种可产光学 纯 (2R,3R)-2,3-丁 二 醇 的 野 生 菌 株。Nakashimada等[24]研究发现,在厌氧条件下,pH 6.3、稀释率为0.2 h-1时,(2R,3R)-2,3-丁二醇的光学纯度大于98%,其最高产量为74.4 mmol/L。进一步的研究发现,添加乙酸可以促进多粘芽胞杆菌产2,3-丁二醇。在初始pH 6.8条件下,补料分批发酵中按照每摩尔葡萄糖中添加0.35 mol乙酸的量添加乙酸,2,3-丁二醇产量可达637 mmol/L,其光学纯度大于98%,转化率达到理论转化率的81%[25]。Häßler等[17]研究发现多粘芽胞杆菌 DSM 365 具有较高的(2R,3R)-2,3-丁二醇生产能力,在60 g/L酵母粉条件下,补料分批发酵 54 h,(2R,3R)-2,3-丁二醇产量达到111.0 g/L,生产强度达到 2.1 g/(L·h),这是目前多粘芽胞杆菌生产2,3-丁二醇的最高水平。
多粘芽胞杆菌也可利用戊糖为底物发酵产2,3-丁二醇。Laube等[26]对比了10株多粘芽胞杆菌的木糖利用能力,发现菌株9035具有较高的利用木糖产2,3-丁二醇的能力,其利用木糖可产生4.4 g/L 2,3-丁二醇,相同条件下其利用L-阿拉伯糖可产生8.7 g/L 2,3-丁二醇。该菌株还可分别利用甘露糖、半乳糖、纤维二糖和淀粉产生 7.3、8.5、8.5 和 5.0 g/L的2,3-丁二醇,表明该菌株具有较广的底物谱。Marwoto等[19]研究发现,在39℃条件下多粘芽胞杆菌批次发酵24 h可消耗100 mmol/L的木糖,共计产生39 mmol/L 的(2R,3R)-2,3-丁二醇,同时还生产了65 mmol/L的乙醇和47 mmol/L的乙酸。而当底物为100 mmol/L葡萄糖和100 mmol/L木糖的混合物时,菌株仍能在24 h内消耗完糖,产生82 mmol/L 的(2R,3R)-2,3-丁二醇、124 mmol/L乙醇和33 mmol/L乙酸。以上结果表明,与葡萄糖相比,多粘芽胞杆菌利用戊糖能力较弱。
菊粉是一种主要由果糖聚合而成的链状非消化性寡糖,其来源于非粮原料菊芋。由于多粘类芽胞杆菌可以产生菊粉酶,因此其可以直接以菊粉为底物进行2,3-丁二醇的发酵生产。Gao等[18]优化了多粘类芽胞杆菌利用菊粉发酵产2,3-丁二醇的培养基,研究发现菊粉、K2HPO4和NH4Cl是影响2,3-丁二醇发酵生产的关键因素,并通过中心组合实验得到了各因素的最适浓度。在5 L发酵罐分批发酵实验中,(2R,3R)-2,3-丁二醇的质量浓度达到36.92 g/L,光学纯度大于98%。
1.2 枯草芽胞杆菌
枯草芽胞杆菌(B.subtilis)是芽胞杆菌属的一种呈革兰氏染色阳性的菌,该菌能利用多种糖类以及淀粉,能利用蛋白质,分解色氨酸形成吲哚。在工业上,枯草芽胞杆菌是重要的α-淀粉酶、中性蛋白酶和5'-核苷酶生产菌株,具有重要的经济价值。与地衣芽胞杆菌类似,枯草芽胞杆菌及其生产的酶制剂被美国FDA认定为GRAS(generally recognized as safe),菌体本身在污水处理和生物菌肥行业中广泛应用。枯草芽胞杆菌(最广泛应用的菌株为枯草芽胞杆菌168)作为芽胞杆菌属的模式菌株,已经测序获得多个菌株的全基因组信息,其遗传操作体系也是芽胞杆菌属内最成熟,应用最广泛的。早在20世纪40年代,科学家就发现枯草芽胞杆菌能够发酵葡萄糖产生2,3-丁二醇,但是相关报道很少。Biswas等[13]报道了1株枯草芽胞杆菌168的工程菌能够增加2,3-丁二醇的发酵生产能力,采用AlsSD操纵子的启动子PalsSD替换budA基因的启动子,使菌株能够在对数生长前期表达budA基因,经过基因工程改造后的菌株开始积累2,3-丁二醇的时间由对数后期提前到对数前期,通过添加乙酸盐,采用好氧-厌氧两步发酵法等策略使菌株生产强度提高6.7倍,达到 0.4 g/(L·h),2,3-丁二醇的最终总质量浓度达到6.1 g/L。枯草芽胞杆菌发酵生产2,3-丁二醇的构型以(2R,3R)-丁二醇为主。
1.3 淀粉液化芽胞杆菌
淀粉液化芽胞杆菌近年来被发现是较好的2,3-丁二醇生产菌株。Yang等[14]筛选到1株产2,3-丁二醇的淀粉液化芽胞杆菌B10-127,该菌株能够在200 g/L的葡萄糖培养基中生长并生产2,3-丁二醇,显示出较高的葡萄糖耐受性。该菌株的最适发酵温度为37℃,最适初始pH在5.5~7.5之间,其补料分批发酵产量可达92.3 g/L,生产强度为0.96 g/(L·h)。该菌株的转化率为理论转化率的84%,主要副产物为琥珀酸。进一步的研究表明:玉米浆、豆粕和柠檬酸铵是影响该菌株发酵产2,3-丁二醇的关键因素,并利用响应面法优化得到了以上因素的最适浓度,在最优培养基中,该菌株的产量提高至 62.7 g/L,生产强度提高至 1.49 g/(L·h),是原有水平的2.4倍。当发酵体积放大到20 L后,发酵 36 h,2,3-丁二醇的终质量浓度达到 61.4 g/L,其生产强度达到1.71 g/(L·h),转化率为理论转化率的76%[15]。该菌株还能够利用甘油作为发酵底物进行2,3-丁二醇的生产。研究结果表明,粗甘油的发酵特性与纯甘油接近,且不抑制菌体生长。同时还发现,添加葡萄糖或者蔗糖能够显著促进甘油利用和2,3-丁二醇生产的速率,但其中葡萄糖对甘油的利用有抑制作用,而蔗糖没有抑制甘油的利用,其促进甘油利用和2,3-丁二醇生产的效果更为显著。在此基础上,Yang[16]利用富含蔗糖的甜菜糖蜜作为共代谢底物,补料分批发酵96 h,2,3-丁二醇产量达到83.3 g/L,转化率为理论转化率的84%,生产强度为0.87 g/(L·h),为目前报道的利用粗甘油发酵的最高水平。
1.4 地衣芽胞杆菌
在工业上,地衣芽胞杆菌(B.licheniformis)应用广泛,主要用来生产蛋白酶、淀粉酶和抗生素等。虽然,研究者很早就发现地衣芽胞杆菌可以产生2,3-丁二醇,但是有关地衣芽胞杆菌发酵生产2,3-丁二醇的文献报道不多,产物浓度也很低。Nilegaonkar等[27]利用地衣芽胞杆菌,以葡萄糖为C源(20 g/L),在37 ℃、pH 6.0 条件下,发酵 72 h,2,3-丁二醇质量浓度为8.7 g/L,转化率达到理论转化率的 94%,但生产强度仅有 0.12 g/(L·h)。Nilegaonkar等[28]进一步研究发现,地衣芽胞杆菌能够利用葡萄糖、果糖、纤维二糖、淀粉、蔗糖和甘露糖进行2,3-丁二醇的生产,表明该菌具有较广的底物谱。
Wang等[21]筛选得到一株能够在高温(50℃)条件下积累乳酸的菌株B.licheniformis BL1,经过木糖驯化以及敲除乳酸脱氢酶基因(ldh)后得到的菌株B.licheniformis BL8能够在50℃高温条件下发酵葡萄糖和木糖生产高光学纯度(98%)的(2R,3R)-丁二醇。在pH 5.0、5%通气条件下,发酵30 g/L的葡萄糖和木糖分别获得135 mmol(12.16 g/L)和153.3 mmol(13.82 g/L)2,3-丁二醇,转化率分别为0.9 mol/mol葡萄糖和0.73 mol/mol木糖,最大生产速率分别为 29.4 和 26.1 mmol/(L·h)。Perego等[29]利用 B.licheniformis NCIMB 8095 发酵玉米淀粉水解液生产2,3-丁二醇,在最佳条件下,二醇(2,3-丁二醇与乙偶姻的总量)生产强度达到0.58 g/(L·h),转化率达到 0.87 mol/mol,其中 2,3-丁二醇为6.44 g/L,乙偶姻为0.47 g/L。Li等[23]筛选得到了高温高产2,3-丁二醇的地衣芽胞杆菌10-1-A,其可在50℃条件下高效发酵葡萄糖生产2,3-丁二醇,产量高达 115.7 g/L,同时生产强度达到 2.4 g/(L·h),转化率为理论转化率的94%,为目前高温菌株产2,3-丁二醇的最高水平。该菌株的基因组已经完成测序,对基因组的深入分析有望阐明其2,3-丁二醇高温高效生产机制。
1.5 嗜热地芽胞杆菌
目前,关于高温条件下(50~60℃)产乳酸和乙醇的菌株研究较多,而在该条件下产2,3-丁二醇的菌株鲜见报道。Xiao等[22]首次报道了1株在高温条件下产2,3-丁二醇和乙偶姻的嗜热地芽胞杆菌,采油采出水经100℃灭菌后涂布筛选平板,筛选得到了能够产2,3-丁二醇和乙偶姻的菌株XT15,经鉴定为Geobacillus。该菌株的最适生长温度为45~55℃,其在pH 8.0时,产物乙偶姻的产量最高,达到8.0 g/L。在优化后的条件下培养 48 h,2,3-丁二醇和乙偶姻的产量分别为14.5和7.7 g/L。
2 芽胞杆菌发酵2,3-丁二醇的影响因素
微生物发酵生产2,3-丁二醇受到很多因素的影响,其中溶氧(DO)和pH被认为是影响最大的2个因素。此外,部分芽胞杆菌具有在高温下生长并产生2,3-丁二醇的能力,且温度对于2,3-丁二醇产量影响较大。因此,笔者总结了以下3个因素对芽胞杆菌2,3-丁二醇生产的影响。
2.1 溶氧
溶氧是影响微生物2,3-丁二醇发酵的关键因素,其水平高低影响到2,3-丁二醇的产量、生产强度以及副产物的形成[5]。一般来说,高的溶氧水平会导致生物量的提高,从而提高生产强度,但往往会造成2,3-丁二醇产量的降低;而低的溶氧会提高2,3-丁二醇的产量,但由于低溶氧条件下细胞密度的降低,会导致低的2,3-丁二醇生产强度。因此,为了提高2,3-丁二醇的生产效率,需要优化一个适当的溶氧控制策略。
Yang等[14]研究发现转速能显著影响B.amyloliquefaciens B10-127 发酵 2,3-丁二醇产量。随着转速的增加,菌体干质量提高,发酵周期缩短,但是2,3-丁二醇产量有所降低,而副产物乙偶姻的产量逐渐提高。
(2R,3R)-2,3-丁二醇是多粘芽胞杆菌发酵的主要产物,研究表明溶氧水平还影响多粘芽胞杆菌的光学纯度。Nakashimada等[24]研究发现,溶氧水平影响多粘芽胞杆菌所产(2R,3R)-2,3-BD的e.e.值,其首先在摇瓶中验证了装液量对产物e.e.值的影响,发现低装液量条件下发酵产物主要为乙偶姻,(2R,3R)-2,3-BD 仅为 12.9 mmol/L。随着装液量的增加,2,3-丁二醇产量逐渐提高至97.4 mmol/L,e.e.值可达到 94%;而厌氧条件下,产量有所降低,仅为 74.4 mmol/L,但e.e.值则高达 99%。5 L发酵罐水平的实验也表明,多粘芽胞杆菌在厌氧条件下产生的(2R,3R)-2,3-BD光学纯度大于98%[25]。Häßler等[17]在发酵罐上研究了不同搅拌转速和通风速率对多粘芽胞杆菌(2R,3R)-2,3-BD的产量和e.e.值的影响,结果表明随着转速的提高,2,3-丁二醇产量逐渐升高,而产物中(2R,3R)-2,3-BD所占比例不断降低,通风的作用小于转速,这可能是由于高转速条件下的表面产气效应提高了O2的溶解效率。该菌株在500 r/min、0.2 vvm(每分钟通气量与罐体实际料液体积的比值)以及60 g/L酵母粉作为N源的条件下,补料分批发酵54 h,(2R,3R)-2,3-丁 二 醇 产 量 达 到 111.0 g/L,e.e.值 大于98%。
2.2 pH
pH是影响芽胞杆菌2,3-丁二醇产量及其不同异构体的合成的重要因素。一般而言,碱性环境有利于有机酸的形成,从而降低2,3-丁二醇的产量;而在酸性环境中,有机酸的合成量显著降低,醇类化合物的合成量显著提高。不同菌株2,3-丁二醇生产的最适pH往往不同。
嗜热地芽胞杆菌XT15在初始pH 8.0的条件下,2,3-丁二醇和乙偶姻的产量最高[22]。对于 B.amyloliquefaciens B10-127而言,初始 pH在5.5 ~7.5 之间时,2,3-丁二醇产量较高,其中 pH 6.5 时,2,3-丁二醇产量最高,达到 61.6 g/L[14]。Nilegaonkar等[27]研究发现地衣芽胞杆菌发酵生产 2,3-丁二醇的最适 pH是 6.0;而Wang等[21]利用敲除了 ldh基因的地衣芽胞杆菌BL5在50℃条件下发酵2,3-丁二醇时发现:在pH 7.0时,会产生大量副产物甲酸和乙醇;在 pH 5.0条件下,2,3-丁二醇为主要发酵产物,因 此,该 菌 的 最 适 pH 为 pH 5.0。Nakashimada等[24]研究发现,在 pH 5.7 时,多粘芽胞杆菌所产生的meso-2,3-BD含量明显提高,导致(2R,3R)-2,3-BD 的 e.e.值降低至94%;而 pH 在6.0 ~6.9 之间时,(2R,3R)-2,3-BD的e.e.值可达98%。菌株在pH 6.6时的产量降低较为显著,仅为pH 6.0时产量的35%。以上结果表明:pH对于不同菌株2,3-丁二醇的生产有不同的影响,对于筛选到的新菌株,发酵pH的优化尤为重要。
2.3 温度
温度也是影响2,3-丁二醇发酵生产的重要因素。对于 B.amyloliquefaciens B10-127来说,其 2,3-丁二醇的最适发酵温度是37℃,而当温度低于37℃时,该菌株主要发酵产物为乙偶姻,这一现象与菌株 Klebsiella oxytoca M1 相似[14,30],推测其原因可能是菌株B10-127中的2,3-丁二醇脱氢酶的转录水平受到温度的影响,导致其胞内2,3-丁二醇脱氢酶活性在30℃时远低于37℃,从而积累乙偶姻。对多粘芽胞杆菌来说,温度是影响其发酵木糖产2,3-丁二醇的显著因素,当温度在30~39℃范围内,(2R,3R)-2,3-丁二醇产量随着温度的升高而升高[19]。而对菌株嗜热地芽胞杆菌XT15来说,45~55 ℃是其最适生长温度[22]。Nilegaonkar等[27]研究地衣芽胞杆菌发酵生产2,3-丁二醇时发现其最适温度是37℃;但笔者所在课题组Li等[23]利用筛选到的高温菌株10-1-A进行2,3-丁二醇生产研究时发现,与Nilegaonkar等报道的结果不同,地衣芽胞杆菌10-1-A的最适温度是50℃。由此可知,温度对于不同微生物有不同影响,即使是同一个种的不同菌株,也可能有不同的影响,因此有必要对新菌株进行发酵温度的优化。
3 芽胞杆菌2,3-丁二醇合成途径及调控机制
3.1 2,3-丁二醇合成途径
微生物中2,3-丁二醇合成途径是经由混合酸途径得到的,产物中除了2,3-丁二醇还有一系列副产物,主要有乙醇、乳酸、乙酸、甲酸和琥珀酸等副产物[2]。已有报道的2,3-丁二醇合成途径主要包括3条(图1)。其一为丙酮酸在α-乙酰乳酸合成酶作用下生成α-乙酰乳酸,并在α-乙酰乳酸脱羧酶作用下生成(3R)-乙偶姻,(3R)-乙偶姻在2,3-丁二醇脱氢酶的作用下还原得到2,3-丁二醇,这条途径是微生物中2,3-丁二醇合成的主要途径,其关键酶研究较多;其二为在有氧条件下,α-乙酰乳酸发生自发氧化脱羧生成双乙酰,双乙酰在2,3-丁二醇脱氢酶(或者叫做双乙酰还原酶)的作用下,生成乙偶姻,再进一步生成2,3-丁二醇,该途径被认为是2,3-丁二醇合成的支路途径;其三为在葡萄糖消耗完的情况下,碳代谢阻遏(CCR)现象消失,此时双乙酰在乙偶姻脱氢酶复合体(acetoin dehydrogenase enzyme system,AoDH ES)的作用下生成乙酰乙偶姻,并进一步在乙酰乙偶姻还原酶(AACR)的作用下,生成乙酰丁二醇,乙酰丁二醇可进一步生成2,3-丁二醇,但是催化此步反应的酶不详,且由于发酵过程中底物葡萄糖的存在会抑制该途径,因此其在2,3-丁二醇发酵生产中的作用可以忽略[2,5,31-32]。
3.2 芽胞杆菌2,3-丁二醇合成基因簇及关键酶
在芽胞杆菌中2,3-丁二醇合成基因簇总结如图2所示。由图2可以看出:芽胞杆菌中的2,3-丁二醇合成基因簇结构与革兰氏阴性菌(如肺炎克雷伯氏菌),有较大差异,主要表现为3个方面:①在芽胞杆菌中该基因簇的第2个基因是α-乙酰乳酸脱羧酶基因,第3个是α-乙酰乳酸合成酶基因,而肺炎克雷伯氏菌中α-乙酰乳酸合成酶基因在α-乙酰乳酸脱羧酶基因之前,这样会影响2个酶的表达水平;②在芽胞杆菌中2,3-丁二醇脱氢酶独立存在,而肺炎克雷伯氏菌中2,3-丁二醇脱氢酶基因bdh与alsR、alsD和alsS共同组成一个完整的基因簇;③绝大部分芽胞杆菌中的2,3-丁二醇脱氢酶为中链家族2,3-丁二醇脱氢酶(图3),其可同时催化(2R,3R)-2,3-BD 和 meso-2,3-BD 与(3R)-AC 和(3S)-AC间的可逆反应[33-34],而在肺炎克雷伯氏菌中的2,3-丁二醇脱氢酶属于短链家族2,3-丁二醇脱氢酶(图3),该类酶主要催化 meso-2,3-BD与(3R)-AC间的可逆反应[35]。目前,仅有在地衣芽胞杆菌中的2,3-丁二醇脱氢酶属于短链家族2,3-丁二醇脱氢酶[23]。由于α-乙酰乳酸脱羧酶催化α-乙酰乳酸仅生成(3R)-AC,因此,2,3-丁二醇脱氢酶的不同导致了芽胞杆菌生成的2,3-丁二醇异构体和肺炎克雷伯氏菌的不同。

图1 芽胞杆菌中2,3-丁二醇合成途径Fig.1 The 2,3-BD synthesis pathway in Bacillus sp.
3.3 芽胞杆菌2,3-丁二醇合成的调控
在微生物中2,3-丁二醇合成受到乙酸盐、群体感应等因素的调控,对于调控机制的深入研究有望开发基于基因调控的2,3-丁二醇高效生产策略。因此,2,3-丁二醇调控机制是目前生物法生产2,3-丁二醇研究的热点之一。B.subtilis是目前唯一一种2,3-丁二醇合成基因簇调控机制得到研究的芽胞杆菌菌株。

图2 产2,3-丁二醇芽胞杆菌中2,3-丁二醇合成基因簇Fig.2 Gene clusters for 2,3-BD biosynthesis in Bacillus sp.
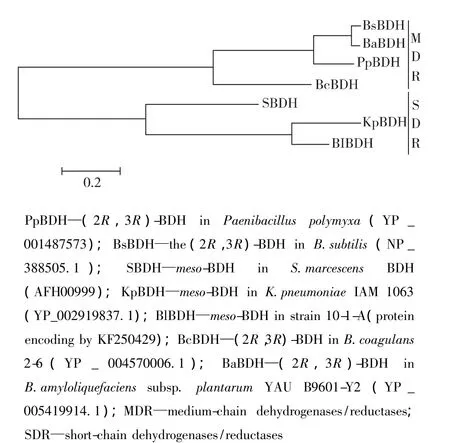
图3 2,3-丁二醇脱氢酶的进化树分析Fig.3 Phylogenetic tree analysis of BDHs
Renna等[36]敲除了 B.subtilis中的 alsR 基因,发现alsSD操纵子不表达,而融合转录实验也表明,AlsR蛋白对于alsSD操纵子的表达是必需的,且在稳定期时表达量明显提高。Frädrich等[37]研究发现,alsSD操纵子对厌氧条件下的乙酸积累、乙酸的添加、低pH和好氧发酵的稳定期等几种条件的响应均依赖于调控基因alsR的存在;利用B.subtilis的RNA polymerase进行的体外转录实验证明,alsSD操纵子的启动子转录需要调控蛋白AlsR的存在;对该启动子分析发现,其包含一个高亲和度结合位点——调控结合区(regulatory binding site)和一个低亲和度结合位点——激活因子结合区(activator binding site),两者对该启动子的转录都是必需的,且AlsR蛋白与RBS和ABS结合后会形成稳定的四聚体结构,该结构的调控蛋白能够起始alsSD操纵子的启动子转录。
由于在B.subtilis中的2,3-丁二醇脱氢酶基因bdhA与alsSD操纵子分布在基因组的不同位置,其是否受到调控蛋白AlsR的调控成为2,3-丁二醇合成调控的另一个问题。de Oliveira等[38]构建了alsR基因敲除的菌株,并分别比较了野生菌株和突变菌株中bdhA-lacZ融合基因表达水平、稳定期bdhA基因mRNA表达水平和2,3-丁二醇脱氢酶活力,结果发现AlsR对bdhA基因表达的激活作用仅在稳定期早期,敲除alsR基因后,bdhA基因的表达降低,但并未完全丧失。同时,体外实验表明,AlsR并不能与bdhA基因的启动子相结合。以上结果表明,AlsR蛋白并不直接调控bdhA基因的表达,其可能通过其他蛋白间接调控bdhA基因的表达。
4 展望
4.1 高效生产2,3-丁二醇的嗜热芽胞杆菌的筛选
目前,产2,3-丁二醇的菌株其生长温度一般为30~40℃,在此温度条件下容易染菌[22]。而在50~60℃条件下进行发酵生产可以大大降低染菌的机会,同时该温度条件有利于纤维素原料的同步糖化发酵,因此高温条件下发酵生产乳酸、乙醇等产品的研究成为近年来研究的热点。但是目前在可高效生产2,3-丁二醇的微生物中,肺炎克雷伯氏菌、产酸克雷伯氏菌和黏质沙雷氏菌均不能在此条件下生长,同时部分芽胞杆菌如枯草芽胞杆菌和多粘芽胞杆菌也不能在50~60℃条件下生长。因此,这些菌株不能够用于高温条件下生产2,3-丁二醇。但部分芽胞杆菌能够在高温条件下生长,如地衣芽胞杆菌、嗜热地芽胞杆菌和凝结芽胞杆菌等,可以在50~60℃时生长并代谢葡萄糖、木糖等C源,生产2,3-丁二醇,但是其产量较克雷伯氏菌低。因此,筛选高效生产2,3-丁二醇的嗜热芽胞杆菌将成为今后2,3-丁二醇发酵生产研究的热点之一。
4.2 芽胞杆菌基因工程改造
芽胞杆菌的遗传操作较为困难,目前在用于生产2,3-丁二醇的芽胞杆菌中,仅枯草芽胞杆菌和地衣芽胞杆菌BL1成功进行了基因工程改造,尚未有关于解淀粉芽胞杆菌和多粘芽胞杆菌基因工程改造的研究报道。虽然以上菌株2,3-丁二醇产量较高,但其转化率较低,对其副产物合成途径进行代谢工程改造,有望提高其转化率,从而提高2,3-丁二醇生产的经济性。同时,凝结芽胞杆菌2-6、XZL9分别是高效利用葡萄糖和木糖生产乳酸的高温菌株,其基因组中有2,3-丁二醇合成基因簇,具有 2,3-丁二醇生产能力,对其进行基因工程改造有望得到高效利用葡萄糖和木糖生产2,3-丁二醇的高温菌株,甚至可实现2,3-丁二醇的开放式发酵生产。
[1] Syu M J.Biological production of 2,3-butanediol[J].Appl Microbiol Biotechnol,2001,55:10-18.
[2] Celinska E,Grajek W.Biotechnological production of 2,3-butanediol:current state and prospects[J].Biotechnol Adv,2009,27:715-725.
[3] 马翠卿,李理想,高超.基于生物质与资源的化工多元醇生物炼制研究进展[J].生物加工过程,2013,11(2):44-52.
[4] 秦加阳,肖梓军,张兆斌,等.一种简单的高产2,3-丁二醇发酵生产方法[J].生物加工过程,2005,3(4):71-73.
[5] Ji X J,Huang H,Ouyang P K.Microbial 2,3-butanediol production:a state-of-the-art review[J].Biotechnol Adv,2011,29:351-364.
[6] Garg S K,Jain A.Fermentative production of 2,3-butanediol:a review[J].Bioresour Technol,1995,51:103-109.
[7] Yan Y,Lee C C,Liao J C.Enantioselective synthesis of pure(R,R)-2,3-butanediol in Escherichia coli with stereospecific secondary alcohol dehydrogenases[J].Org Biomol Chem,2009,7:3914-3917.
[8] Gubbels E,Jasinska-WalcL,KoningC E.Synthesisand characterization of novel renewable polyesters based on 2,5-furandicarboxylic acid and 2,3-butanediol[J].Polym Sci Pol Chem,2013,51:890-898.
[9] Xiao Z J,Liu P H,Qin J Y,et al.Statistical optimization of medium componentsforenhanced acetoin production from molasses and soybean meal hydrolysate[J].Appl Microbiol Biotechnol,2007,74(1):61-68.
[10] Kopke M,Mihalcea C,Liew F,et al.2,3-Butanediol production by acetogenic bacteria,an alternative route to chemical synthesis,using industrial waste gas[J].Appl Environ Microbiol,2011,77(15):5467-5475.
[11] Ko Y H,Gross R A.Effects of glucose and glycerol on γ-poly(glutamic acid)formation by Bacillus licheniformis ATCC 9945a[J].Biotechnol Bioeng,1998,57(4):430-437.
[12] Qin J,Zhao B,Wang X,et al.Non-sterilized fermentative production of polymer-grade L-lactic acid by a newly isolated thermophilic strain Bacillus sp.2-6[J].PLoS One,2009,4(2):e4359.
[13] Biswas R,Yamaoka M,Nakayama H,et al.Enhanced production of 2,3-butanediol by engineered Bacillus subtilis[J].Appl Microbiol Biotechnol,2012,94(3):651-658.
[14] Yang T,Rao Z,Zhang X,et al.Production of 2,3-butanediol from glucose by GRAS microorganism Bacillus amyloliquefaciens[J].J Basic Microbiol,2011,51:650-658.
[15] Yang T,Zhang X,Rao Z,et al,Optimization and scale-up of 2,3-butanediol production by Bacillus amyloliquefaciens B10-127[J].World J Microb Biotech,2011,28(4):1563-1574.
[16] Yang T W,Rao Z M,Zhang X,et al.Fermentation of biodieselderived glycerol by Bacillus amyloliquefaciens:effects of cosubstrates on 2,3-butanediol production[J].Appl Microbiol Biotechnol,2013,97(17):7651-7658.
[17] Häßler T,Schieder D,Pfaller R,et al.Enhanced fed-batch fermentation of 2,3-butanediol by Paenibacillus polymyxa DSM 365[J].Bioresour Technol,2012,124:237-244.
[18] Gao J,Xu H,Li Q,et al.Optimization of medium for one-step fermentation of inulin extract from Jerusalem artichoke tubers using Paenibacilluspolymyxa ZJ-9 to produce R,R-2,3-butanediol[J].Bioresour Technol,2010,101(18):7076-7082.
[19] Marwoto B,Nakashimada Y,Kakizono T,et al.Enhancement of(R,R)-2,3-butanediol production from xylose by Paenibacillus polymyxa at elevated temperatures[J].Biotechnol Lett,2002,24(2):109-114.
[20] Jurchescu I M,Hamann J,Zhou X,et al.Enhanced 2,3-butanediolproduction in fed-batch cultures offree and immobilized Bacillus licheniformis DSM 8785[J].Appl Microbiol Biotechnol,2013,97(15):6715-6723.
[21] Wang Q,Chen T,Zhao X,et al.Metabolic engineering of thermophilic Bacilluslicheniformisforchiralpure d-2,3-butanediol production[J].BiotechnolBioeng,2012,109:1610-1621.
[22] Xiao Z,Wang X,Huang Y,et al.Thermophilic fermentation of acetoin and 2,3-butanediol by a novel Geobacillus strain[J].Biotechnol Biofuels,2012,5:88-98.
[23] Li L,Zhang L,Li K,et al.A newly isolated Bacillus licheniformis strain thermophilically produces 2,3-butanediol,a platform and fuel bio-chemical[J].Biotechnol Biofuels,2013,6(1):123.
[24] Nakashimada Y,Kanai K,Nishio N.Optimization of dilution rate,pH and oxygen supply on optical purity of 2,3-butanediol produced by Paenibacillus polymyxa in chemostat culture[J].Biotechnol Lett,1998,20(12):1133-1138.
[25] Nakashimada Y,Marwoto B,Kashiwamura T,et al.Enhanced 2,3-butanediol production by addition of acetic acid in Paenibacillus polymyxa[J].J Biosci Bioeng,2000,90(6):661-664.
[26] Laube V M,Groleau D,Martin S M.2,3-Butanediol production from xylose and other hemicellulosic components by Bacillus polymyxa[J].Biotechnol Lett,1984,6(4):257-262.
[27] Nilegaonkar S,Bhosale S B,Kshirsagar D C,et al.Production of 2,3-butanediol from glucose by Bacillus licheniformis[J].World J Microbiol Biotechnol,1992,8:378-381.
[28] Nilegaonkar S S,Bhosale S B,Dandage C N,et al.Potential of Bacillus licheniformis for the production of 2,3-butanediol[J].J Ferment Bioeng,1996,82(4):408-410.
[29] Perego P,Converti A,Del Borghi M.Effects of temperature,inoculum size and starch hydrolyzate concentration on butanediol production by Bacillus licheniformis[J].Bioresour Technol,2003,89(2):125-131.
[30] Cho S,Kim K D,Ahn J H,et al.Selective production of 2,3-butanediol and acetoin by a newly isolated bacterium Klebsiella oxytoca M1[J].Appl Biochem Biotechnol,2013,170(8):1922-1933.
[31] Xiao Z,Xu P.Acetoin metabolism in bacteria[J].Crit Rev Microbiol,2007,33(2):127-140.
[32] Ui S,Hosaka T,Watanabe K,et al.Discovery of a new mechanism of 2,3-butanediol stereoisomer formation in Bacillus cereus YUF-4 J[J].J Ferment Bioeng,1998,85(1):79-83.
[33] Yu B,Sun J,Bommareddy R R,et al.Novel(2R,3R)-2,3-butanediol dehydrogenase from potential industrial strain Paenibacillus polymyxa ATCC 12321[J]. Appl Environ Microbiol,2011,77(12):4230-4233.
[34] Xiao Z,Lv C,Gao C,et al.A novel whole cell biocatalyst with NAD+regeneration for production of chiral chemicals[J].PLoS One,2010,5(1):e8860.
[35] Zhang L,Xu Q,Zhan S,et al.A new NAD(H)-dependent meso-2,3-butanediol dehydrogenase from an industrially potential strain Serratia marcescens H30[J].Appl Microbiol Biotechnol,2014,98(3):1175-1184.
[36] Renna M C,Najimudin N,Winik L R,et al.Regulation of the Bacillus subtilis alsS,alsD,and alsR genes involved in postexponential-phase production of acetoin[J].J Bacteriol,1993,175(12):3863-3875.
[37] Frädrich C,March A,Fiege K,et al.The transcription factor AlsR binds and regulates the promoter of the alsSD operon responsible for acetoin formation in Bacillus subtilis[J].J Bacteriol,2012,194(5):1100-1112.
[38] de Oliveira R R,Nicholson W L.The LysR-type transcriptional regulator(LTTR)AlsR indirectly regulates expression of the Bacillus subtilis bdhA gene encoding 2,3-butanediol dehydrogenase[J].Appl Microbiol Biotechnol,2013,97(16):7307-7316.
