融合蛋白CBD-SPA“Z”基因的构建、表达与活性鉴定
2014-05-04朱文杰
朱文杰,马 军,张 妍,金 坚
(1.江南大学 药学院 无锡 214122;2.江南大学 生物工程学院教育部工业生物技术重点实验室,无锡 214122)
各种微生物来源的纤维素酶普遍具有类似的 结构,其中包括没有催化功能的纤维素结合结构域(cellulose binding domain,CBD)[1],其功能在与生物工程技术相关的研究中已经被广泛应用[2]。金黄色葡萄球菌蛋白A(staphylococcal protein A,SPA)中含有E、D、A、B和C 5个高度同源的免疫球蛋白G(immunoglobulin G,IgG)结合结构域,都能独立地与IgG的Fc片段结合,其中B结构域稳定性最好,与IgG的结合能力最强[3-5]。由于只结合 Fc段,所以不会影响抗体的免疫学活性[6],这使得利用 SPA亲和层析柱纯化IgG成为可能。为了提高 SPA及纯化蛋白的稳定性,基于B结构域的优势,研究者们对其进行改造,使结构域中螺旋之间的角度产生改变[7],降低其与IgG的结合强度,使洗脱条件变得温和,最终将其命名为Z结构域[8]。
长期以来,木质生物质被公认为是1种潜在的具有可持续来源的生物多糖材料,在过去近1个世纪研究中,目标明确的是如何在现今的市场中发挥其成本竞争力[9]。纤维素作为自然界中分布最广、含量最多的1种多糖,应用成本低廉。而随着研究重心转移的需求,若能把其与CBD之间的关系与应用广泛的抗体纯化分子SPA有机结合,则不仅能为研究开发提供所需材料,同时在生物工程工业生产中还能产生巨大的经济效益[10]。
由于SPA能与IgG的Fc端特异性结合,一直以来都被广泛应用于抗体纯化工作中,现在应用较为广泛的是把SPA连接到经HBr活化的葡聚糖凝胶而制成的层析柱。由于SPA被包裹在基质里,活性部位的分布具有不确定性,使得在纯化过程中与抗体结合具有随机性,导致SPA的使用效率低。另外葡聚糖等传统基质的抗压性能相对较差[11],使得上样流速不能过快,导致纯化时间较长,影响工作效率。此外HBr有剧毒[12],处理不当将会严重影响纯化产品的质量。针对上述问题,笔者把SPA改造后的Z基因和CBD基因进行融合,构建了一种新型表达载体。
有研究者做过将SPA的5个结构域与CBD或其他活性结构进行融合的工作[13-14],也有将 SPA改造后的Z结构域与其他活性结构进行融合的成果[15],但没有发现把CBD与Z结构域融合的相关研究。笔者尝试将单个Z结构域与CBD进行融合,并在末端新添了1个半胱氨酸(Cys),建立1种新型SPA改良层析材料,以期为在亲和层析方面的应用奠定基础。
1 材料与方法
1.1 材料
带有CBD基因的质粒pET35b(+)和带有Z基因的质粒pEZZ18由药学院药物设计与分子药理研究室保存;E.coli DH5α、E.coli BL21(DE3)感受态细胞购自TIANGEN公司;1 kb plus DNA Ladder和DL2000 DNA Ladder购自Fermentas公司,标准蛋白Ladder和预染蛋白Ladder购自Thermo公司;限制性核酸内切酶SacⅡ购自Fermentas公司,限制性核酸内切酶XhoⅠ购自Thermo公司;实验所用引物由Sangon公司合成;Taq Plus DNA聚合酶、dNTPs、T4DNA连接酶、硫酸卡那霉素、质粒DNA小量抽提试剂盒、DNA胶回收试剂盒和PCR产物纯化试剂盒购自Sangon公司;辣根过氧化物酶(HRP)标记山羊抗兔IgG购自Beyotime公司;微晶纤维素(Type 50)购自Sigma-Aldrich公司。
1.2 重组表达载体pET35b(+)-Z-Cys的构建
1.2.1 引物设计
根据质粒pEZZ18上Z基因片段的编码序列设计引物扩增序列,引物如下。上游引物UZ:5'-TCCCCGCGGCGGTAGACAACAAATTCAAC-3',下游引物 DZ:5'-CCCTCGAGACATTTCGGCGCCTGAGCATC-3'。根据质粒pET35b(+)的多克隆位点,在上游引物中引入SacⅡ酶切位点,为保证开放阅读框(ORF)不变,在SacⅡ酶切位点后添加2个碱基CG;在下游引物中引入XhoⅠ酶切位点,并在XhoⅠ酶切位点后引入Cys反密码子ACA。
根据质粒pET35b(+)上CBD基因片段的编码序列设计引物扩增序列,引物如下。上游引物UC:5'-CATGCCATGGGCATGTCAGTTGAATTTTACAACTCTAAC-3',下游引物DC:5'-GGAATTCCATATGTGGTGCTGTACCAAGAACTTT-3'。
1.2.2 PCR扩增Z序列
将合成的引物用超纯水稀释成终浓度为10 mmol/L,进行温度梯度PCR,通过琼脂糖凝胶电泳分析扩增产物,选择确定最佳退火温度。质粒pEZZ18 6 μL,引物 UZ 和 DZ 各加入 12 μL,10 ×PCR 缓冲溶液(含 MgCl220 mmol/L)30 μL,dNTPs(25 mmol/L)6 μL,Taq plus DNA 聚合酶(5 U/μL)6 μL,加超纯水补足300 μL,分6管进行PCR扩增。扩增条件:95℃预变性5 min,随后进行95℃ 30 s,59℃ 30 s,72℃ 30 s,共35个循环,结束前72℃延伸5 min。
1.2.3 目的片段的连接
合并扩增产物,进行琼脂糖凝胶电泳。由于质粒pEZZ18中有连续的2段Z序列,预计扩增结果会产生Z和ZZ大小2条条带,用DNA胶回收试剂盒回收扩增产物中的Z条带;分别用SacⅡ和XhoⅠ双酶切扩增产物及质粒pET35b(+),用PCR产物纯化试剂盒纯化酶切产物;将回收的片段和载体用T4DNA连接酶于16℃连接过夜。
构建的重组表达载体命名为pET35b(+)-ZCys,其质粒图谱如图1所示。
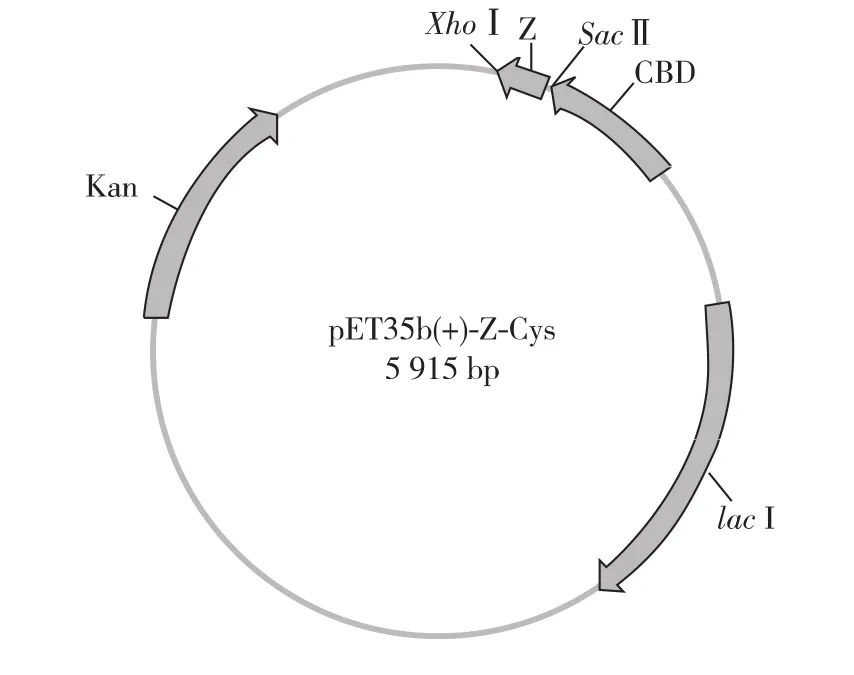
图1 重组pET35b(+)-Z-Cys质粒图谱Fig.1 Map of expression vector pET35b(+)-Z-Cys
1.2.4 转化与筛选
取100 μL E.coli DH5α感受态细胞于冰浴上融化,加入连接液,轻轻吹打混匀,继续冰浴30 min,将菌液放入42℃水浴中热激90 s,立即放入冰浴中2 min,加入900 μL LB 培养基(提前预热至37℃),于37℃恒温摇床上温育1 h,将菌液离心,留200 μL上清将菌体打散,均匀涂布于含0.1 mg/mL硫酸卡那霉素的LB琼脂平板表面,平板于37℃倒置培养过夜。用菌液PCR筛选阳性菌落,将鉴定呈阳性的菌液用质粒DNA小量抽提试剂盒提取质粒,利用PCR进一步验证筛选,排除假阳性菌落后,将鉴定呈阳性的对应菌液送至Sangon公司测序,并将测序正确的重组质粒命名为pET35b(+)-Z-Cys。
1.3 重组质粒pET35b(+)-Z-Cys的表达
将阳性重组质粒转化E.coli BL21(DE3)感受态细胞,涂布于含0.1 mg/mL硫酸卡那霉素的LB琼脂平板表面。挑取单菌落接种于含有硫酸卡那霉素(0.1 mg/mL)的10 mL LB液体培养基中,于37℃培养过夜。按1∶100的比例取过夜培养液转接到含有硫酸卡那霉素(0.1 mg/mL)的新鲜LB液体培养基中,于37℃摇床培养至OD值为0.6~1.0,分别加入浓度为 0、0.6、0.8、1.0、1.2 和 1.4 mmol/L的IPTG,于37℃下诱导培养5 h。离心收集菌体,以10 mL/g(湿质量)加入破碎缓冲液(50 mmol/L Tris、150 mmol/L NaCl,pH 8.3)重悬,在冰水混合液中进行超声破碎(400 W,破碎6 s,停10 s),离心取上清液,进行SDS-PAGE电泳分析。
1.4 重组蛋白的活性鉴定
重组菌于37℃恒温摇床培养至OD值为0.6~1.0后,加入一定浓度的IPTG,在37℃下诱导培养5 h。离心收集菌体,以10 mL/g(湿质量)加入破碎缓冲液进行重悬,在冰水混合液中进行超声破碎,离心取上清液。
1.4.1 重组蛋白与IgG结合活性的鉴定
取蛋白上清液稀释至一定倍数,进行 SDSPAGE电泳分析,进而将蛋白转移到硝酸纤维素膜上。使用浓度为5% 的蛋白液封闭后,用1 000倍稀释的HRP标记的山羊抗兔IgG作为示踪抗体孵育 2 h,用 TBST(0.01 mmol/L Tris、0.15 mmol/L NaCl、体积分数0.05% 吐温20,pH 7.5)洗涤后,用二氨基联苯胺(DAB)作为显色底物进行显色,观察结果。
1.4.2 重组蛋白与纤维素结合活性的鉴定
用磷酸缓冲液(PBS)(10 mmol/L Na2HPO4、2 mmol/L KH2PO4、150 mmol/L NaCl 、3 mmol/L KCl,pH 7.4)作为平衡液,利用恒流泵以流速2 mL/min进行校准洗涤微晶纤维素层析柱。待电脑核酸蛋白检测仪的280 nm的吸光度值稳定以后,破碎菌体上清液以流速2 mL/min上样,待流穿峰过后,用PBS洗涤层析柱至吸光度值稳定。利用50 mmol/L Tris/NaOH(pH 12.5)进行洗脱,收集吸光度值最大峰值处的蛋白洗脱液。把收集的洗脱液和原上清液、流穿液稀释到一定浓度后进行SDS-PAGE电泳分析。
2 结果与讨论
2.1 目的基因片段的获得及阳性克隆的鉴定
以质粒 pEZZ18为模板,UZ/DZ为引物进行PCR扩增的Z基因片段,预计有2条长度分别为351和177 bp的DNA条带(图2)。在琼脂糖凝胶电泳泳道1中,在100~500 bp间有2条明显的条带(图2(a))。该结果与预期的相符,说明质粒pEZZ18中带有Z基因片段。以质粒pET35b(+)为模板,UC/DC为引物进行PCR扩增的CBD基因片段,DNA长度应为471 bp。在琼脂糖凝胶电泳泳道2中,在500 bp附近有1条明显的条带(图2(a)),该结果与预期的相符,说明质粒pET35b(+)中带有CBD基因片段。
把构建好的重组质粒pET35b(+)-Z-Cys在16℃下进行双酶切,结果见图2(b)。由图2(b)可知,在100~250 bp间有1条明显的条带,说明构建的重组质粒中成功连接入了Z基因片段。以重组质粒pET35b(+)-Z-Cys为模板,UC/DZ为引物进行PCR扩增的pCBD-Z基因片段,其DNA长度应为690 bp。结果如琼脂糖凝胶电泳泳道2所示,在500~750 bp间有1条明显的条带(图2(b))。结果与预期的相符,说明成功构建了含有pCBD-Z目的基因片段的重组质粒。
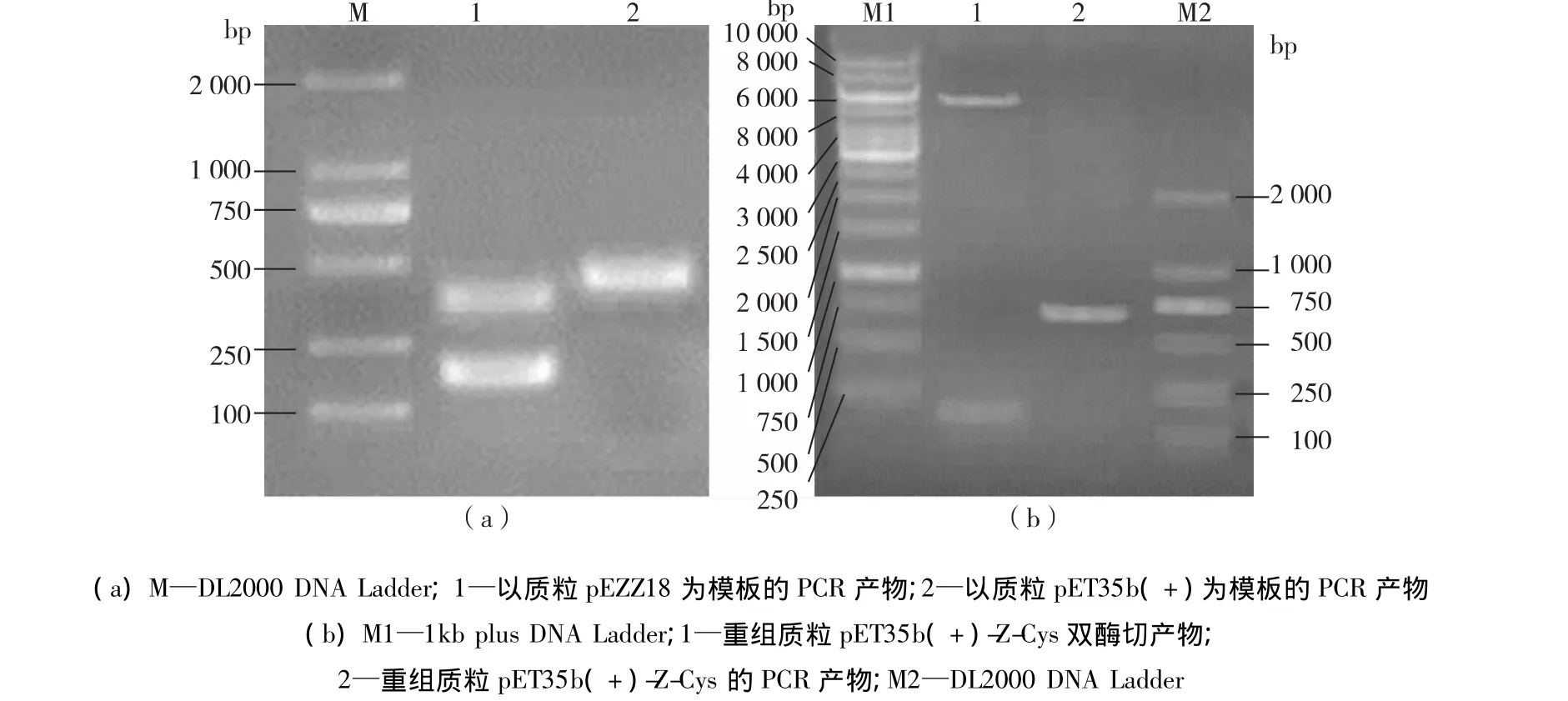
图2 PCR电泳分析及重组质粒pET35b(+)-Z-Cys的双酶切分析Fig.2 Analysis of PCR product and restriction enzyme of the recombinant plasmid
SPA的B结构域通过C末端残留的多肽链,结合邻近IgG的Fc端[16]。因而,选择将SPA改造后的Z结构域插入到质粒pET35b(+)中CBD的 C末端,并新增1个Cys,设计了全长为690 bp的基因重组序列,成功构建了pET35b(+)-Z-Cys融合表达载体。
2.2 CBD-Protein Z融合蛋白的表达
载有重组质粒 pET35b(+)-Z-Cys的 E.coli BL21在OD值达到0.6~1.0后,经不同浓度的IPTG诱导表达5 h后,超声破碎并收集菌体蛋白,稀释至一定浓度后进行SDS-PAGE电泳分析。结果表明,在IPTG的诱导下,目的蛋白得以表达,与预期的蛋白相对分子质量2.53×104相符(图3)。由图3可知:随着IPTG浓度的增加,重组蛋白的表达量也随之增加,在浓度为0.8~1.2 mmol/L时,表达量最高,并且不随IPTG浓度的增大而继续增加,表达量基本不变。实验最后确定本重组菌在OD值达到0.6~1.0后,选用浓度为1.0 mmol/L的IPTG进行诱导表达的结果最佳。
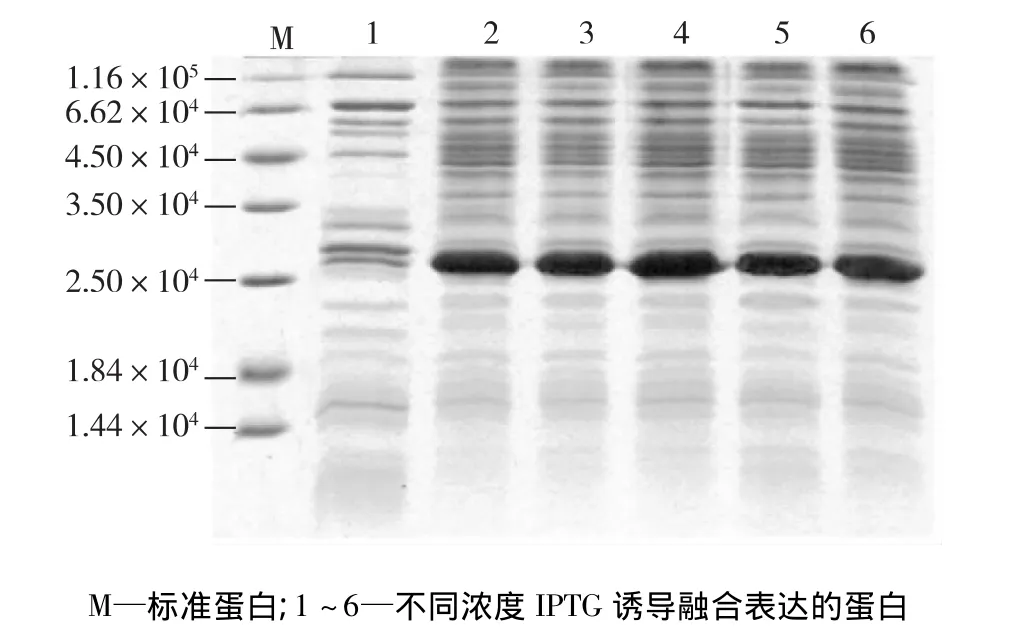
图3 SDS-PAGE电泳分析不同IPTG浓度诱导CBD-Protein Z融合蛋白的表达量Fig.3 SDS-PAGE analysis of CBD-Protein Z fusion protein expressed in E.coli BL21 transformant on different concentrations of IPTG
2.3 CBD-Protein Z融合蛋白与SPA结合活性鉴定
为证明CBD-Protein Z融合蛋白具有与IgG的结合活性,选取了HRP标记的山羊抗兔IgG进行Western Blot分析,结果见图4,如果存在能被显色且蛋白相对分子质量与预期相符的蛋白条带,则说明表达的融合蛋白具有与IgG结合的活性。由图4可知:在蛋白相对分子质量为2.5×104的附近,有1条与目的蛋白相对分子质量相符的明显显色条带,说明经IPTG诱导表达后的重组蛋白具有与IgG的结合活性。

图4 Western Blot鉴定CBD-Protein Z融合蛋白与IgG的结合活性Fig.4 Western Blot Analysis of CBD-Protein Z fusion protein binding to IgG
重组质粒可表达相对分子质量为2.53×104的重组蛋白。这种SPA重组蛋白相对分子质量小,易表达的同时能降低菌体生产强度。该重组蛋白具有与IgG结合的特异性,末端带有的His肽段并不影响Z结构域的生物活性,可用于表达蛋白的纯化,事后可以用酶切除。改造后的Z结构域能使IgG的洗脱条件变得温和,保护IgG的蛋白质活性不受影响,可作为一种较为理想的分离和纯化IgG的材料。
2.4 CBD-Protein Z融合蛋白与纤维素结合活性鉴定
重组菌超声破碎上清中的CBD-Protein Z融合蛋白通过微晶纤维素亲和层析柱,结果见图5,如果在流穿液中的目的蛋白条带消失或变淡,且洗脱液中存在目的蛋白条带,则说明表达的蛋白具有与纤维素结合的活性。由图5可知:在与纤维素作用后的流穿液中,重组蛋白条带明显变淡,而洗脱液中存在蛋白相对分子质量与目的蛋白相符的蛋白条带,说明经IPTG诱导表达后的蛋白具有与纤维素结合的活性。
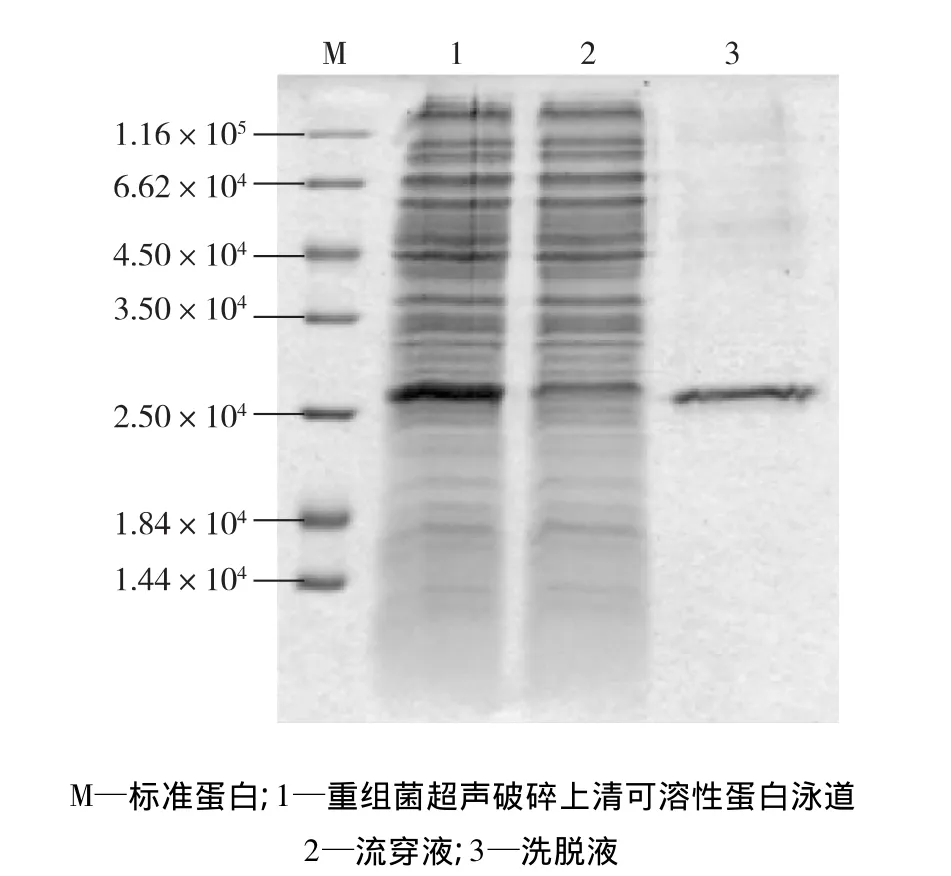
图5 CBD-Protein Z融合蛋白与纤维素的结合活性鉴定Fig.5 Analysis of CBD-Protein Z fusion protein binding to Cellulose
重组质粒表达的融合蛋白在CBD的活性作用下作为亲和层析配基使用时,能定向伸展在基质外侧,这样的顺向分子能够提高IgG的载量。据相关研究发现,末端新引入的—SH能结合并活化介质,增加对IgG的吸附容量[17],提高蛋白配基的使用效率。使用的基质纤维素具有一定的刚性,抗压性能良好,上样流速能有一定幅度的提高,能够缩短纯化时间,提高工作效率。这些效能可以通过与单纯的SPA或Z结构域蛋白的比较得以体现。
3 结论
针对传统SPA亲和层析存在的使用效率低、抗压性能较差以及毒性残留等问题,设计出一种新的免疫亲和材料。构建的含有CBD和Z基因的质粒,经转化得到的重组菌表达出的重组融合蛋白CBDProtein Z,其活性检测结果证明具有IgG和纤维素的结合活性。
对于将来作为工程菌的蛋白表达条件,本研究仅具体探究了诱导剂浓度对蛋白表达作用的影响,并没有对其他表达条件做深入探究。本研究也为利用基因工程等技术生产应用型SPA提供了一条新的借鉴思路。
[1] 乐易林,邵蔚蓝.嗜热真菌纤维素酶的CBD与海栖热袍菌的纤维素酶融合表达[J].微生物学通报,2009,36(6):837-841.
[2] 孙丹,曹宇,白钢,等.纤维素磁性微球的制备及其生物活化研究[J].离子交换与吸附,2009,25(1):17-24.
[3] 徐建生,成大荣,孙怀昌,等.细菌表面表达载体的构建与鉴定[J].河南科技大学学报:农学版,2004,24(4):14-19.
[4] Tomas M,Abrahmsén L,Nilsson B,et al.Staphylococcal protein A consists of five IgG-binding domains[J].Eur J Biochem,1986,156(3):637-643.
[5] Khalili M,Liwo A,Scheraga H A.Kinetic studies of folding of the B-domain of staphylococcal protein A with molecular dynamics and a united-residue(UNRES)model of polypeptide chains[J].J Mol Biol,2006,355(3):536-547.
[6] 李志会,岳盈盈,李鹏,等.金黄色葡萄球菌蛋白A的原核表达及生物亲和特性研究[J].山东大学学报:医学版,2009,47(10):28-31.
[7] Nelson D E,Grishin V N.Folding domain B of protein A on a dynamically partitioned free energy landscape[J].PNAS,2008,105(5):1489-1493.
[8] 逄少堃,梁浩,宋淑亮,等.葡萄球菌蛋白 A活性机制与现代应用[J].生命的化学,2008,28(6):748-751.
[9] Himmel M E,DingSY,JohnsonD K,etal.Biomass recalcitrance:engineering plants and enzymes for biofuels production[J].Science,2007,315:804-807.
[10] 张益谋,邱海霞,稽慧珍.葡萄球菌A蛋白基因的克隆及其IgG受体区新型表达载体的构建[J].生物技术通报,2010(12):201-205.
[11] 唐雪珍.微米级亲和凝胶载体的制备及其亲和吸附蛋白质研究[D].上海:华东理工大学,2011.
[12] 伍学勤,吴岑,凌晓红,等.一种安全制备活化琼脂糖树脂的方法[J].生物化学与生物物理进展,2002,29(2):328-331.
[13] Cao Y,Zhang Q,Wang C,etal.Preparation ofnovel immunomagnetic cellulose microspheres via cellulose binding domain protein A linkage and its use for the isolation of interferon α-2b[J].J Chromatogr A,2007,1149:228-235.
[14] 白芳,张奇,王龙,等.纤维素磁性微球在病原微生物检测中的应用研究[J].离子交换与吸附,2010,26(5):431-438.
[15] 周亚丽,劳兴珍,袁玲,等.免疫球蛋白结合结构域的研究进展[J].药物生物技术,2012,19(3):274-277.
[16] Jendberg L,Tashiro M,Tejero R,et al.The mechanism of binding staphylococcal protein A to immunoglobulin G does not involve helix unwinding[J].Biochemistry,1996,35:22-31.
[17] 夏海锋,吴璞强,金雄华,等.一种高效结合IgG的重组蛋白A及其工程菌的构建方法:中国,102373225A[P].2012-03-14.
