外加电场刺激对菲降解菌的影响
2014-05-04侯怡铃
宋 波,侯怡铃,丁 祥
(西华师范大学 生命科学学院,南充 637002)
多环芳烃(polycyclic aromatic hydrocarbons,PAHs)是一类在环境中广泛分布的有机污染物,其性质稳定、残留时间长,是最早被发现和研究的化学致癌物[1],已被多个国家列为优先控制污染物。PAHs在环境中普遍存在,具有致诱变性,而且结构稳定,难以降解等特点。目前,治理PAHs污染的方法主要以生物修复为技术。以微生物代谢作用为主的生物修复技术具有成本低、效果好、无二次污染等优点,是目前PAHs污染土壤修复最具有潜力的修复手段之一[2-3]。但是采用传统的微生物降解手段耗时较长,借助外加电场等技术加速菲的降解显得尤为重要[4-5]。
对微生物细胞施加外加电场如弱电流在液相或泥浆体系中激发电极反应能刺激微生物的生长和代谢作用[6],已成功应用于酵母菌的发酵[7]、生物脱氮[8]以及铁细菌[9]电化学培养等过程。微生物电解技术是电化学与生物工程交叉领域的一个重要课题,近年来受到研究者日益增长的关注。目前该技术已在工业微生物培养和环境微生物电刺激修复[7-8]两方面显示出良好的前景,为未来利用外加电场强化于微生物反应的生物化工及环境化工过程提供了一个新的趋势。鉴于此,笔者以从石油污染土壤分离得到的细菌Enterobacter dissolvens为实验对象,以菲为唯一C源,由于菲在水中的溶解度较低,通过添加吐温80促溶,使菲在水中的溶解度有明显的提高[10]。综合考察在外加电场下,利用直流电(DC)和交流电(IC)条件下,该细菌在生长、活性以及菲的降解率等方面的影响,旨在为利用微生物修复土壤环境中多环芳烃污染提供理论与实践依据。
1 材料与方法
1.1 菌种来源
所用的菌种筛选自天津大港油田油污染水中,并以菲为唯一C源进行驯化。经16s rDNA测序后鉴定该菌为Enterobacter dissolvens属革兰氏阴性肠杆菌。
1.2 培养基
采用无机盐类(g/L):MgSO40.25、FeSO4·7H2O 0.01、CaCl20.032、K2HPO40.8、KH2PO40.2、NH4NO30.8;由于菲难溶,故添加吐温80作为增溶剂,质量浓度分别为3.2和1 000 mg/L。
1.3 预培养条件
参考Luo等[11]报道电刺激多采用对数期的细菌作为研究对象,首先对细菌溶液进行预培养,以保持细菌液具有较高的活性。预培养条件:首先从-80℃低温冰箱中保存的甘油管中取出0.1 mL种子菌液,接种至盛有50 mL经过滤灭菌含培养基的三角瓶中,30℃恒温摇床(150 r/min)中培养约10 h,此时所得的细菌的生长处于对数生长期初期,菌体浓度(OD600)在0.2至0.3之间。
1.4 分析方法
1.4.1 细菌浓度测定
测量600 nm波长处的吸光度值(OD600)。
1.4.2 细胞脱氢酶活测定
采用2,3,5-三苯基氯化四氮唑(TTC)显色法测定细胞脱氢酶活[12]。
1.4.3 氧化还原电位测定
采用 Pt4865-50-S7,氧化还原电极(Mettler Toledo公司)测定氧化还原电位(ORP)。
1.4.4 菲的测定
由于菲不溶于水,采用正己烷将溶液中的菲萃出。萃取出液相时,1 mL样品溶液中加入1mL正己烷,剧烈振荡1 min后离心,取上层有机相。采用Shimadu LC-10AT(Shimadu公司)高压液相色谱配合C18反相柱测定有机相中菲的浓度。检测方法为紫外法(UV),检测波长为254 nm,流动相为甲醇-水溶液(两者体积比为 90∶10),流速 180 mL/min。采用外标法测定菲的浓度。
1.4.5 吐温80的分析
采用硫氢酸铵钴显色法测定吐温80[13]。
1.5 电解刺激实验装置及方法
参照文献[14]的方法进行电刺激实验。
2 结果与讨论
2.1 外加电场对菲降解菌生长及代谢的影响
脱氢酶是细胞胞内呼吸链上一组重要酶系的统称,其活性高低表明了细胞从葡萄糖底物上获取质子和电子以供应细胞代谢活动的能力,也常用于表征微生物细胞的总体代谢活力,而且能直接表示生物细胞对其基质降解能力的强弱。为考察直流电和交流电对细菌E.dissolvens生长及活性的电解刺激效果,在实验中采用测定细菌脱氢酶的方法来反映细菌的活性[15]。为研究外加电场对E.dissolvens在生长和底物代谢两方面的影响,在10 mA电流条件下采用铂电极分别对预培养菌液进行了直流电和交流电刺激,同时监测实验过程中细胞脱氢酶活(DHA)、菲和吐温80的降解速率以及生长曲线三方面的变化,结果如图1和图2所示。
由图1可知:随着加电时间的延长,细菌脱氢酶活性逐渐增强,菌液中细胞的生长浓度也逐渐增加。与参比值相比,可以明显看出加电后细菌的生长和脱氢酶活得到显著提升。由图2可知:加电后吐温80和菲的浓度也有着显著的变化。与参比值相比,2种C源的消耗均有所加快,尤其是在直流电条件下,吐温80的降解速率较参比增长了1倍,在降解后的8 h,DC刺激下的残余菲的量为2.25,而对照组的残余菲的量为2.68。很明显在DC刺激下菲的降解速率是对照组的1.6倍。根据在无菌培养基中进行电解的实验结果,采用相同条件下的10 mA电流不会导致培养基中菲发生明显的电化学降解(数据未显示)。因此,综合考虑细胞菌浓和脱氢酶活同时增长的实验现象,加电菌液中菲的生物降解速率得到加快。此结果与笔者在以葡萄糖为唯一底物的培养基体系中的电解实验相似。这表明电解刺激方法的确可以强化细胞对底物的代谢,而在“表面活性剂-多环芳烃”的生物修复体系中具有应用潜力。
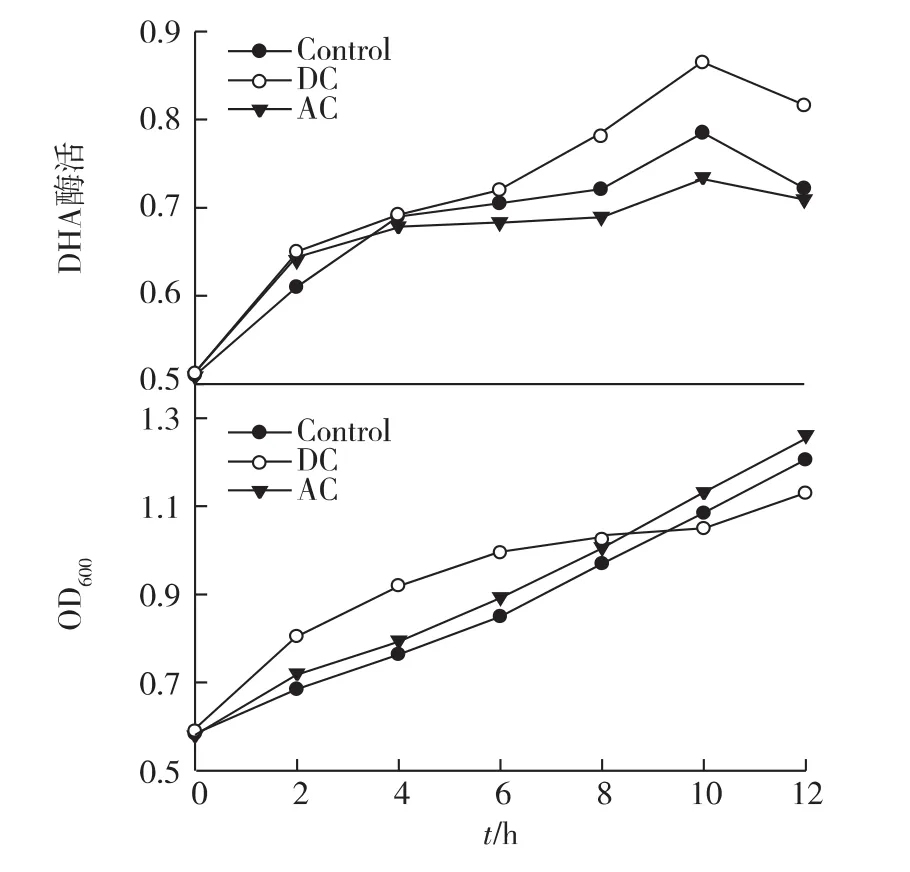
图1 外加电场对菲降解菌生长及脱氢酶活性的影响Fig.1 Effects of external electric field on dehydrogenase activity and cell growth of E.dissolvens
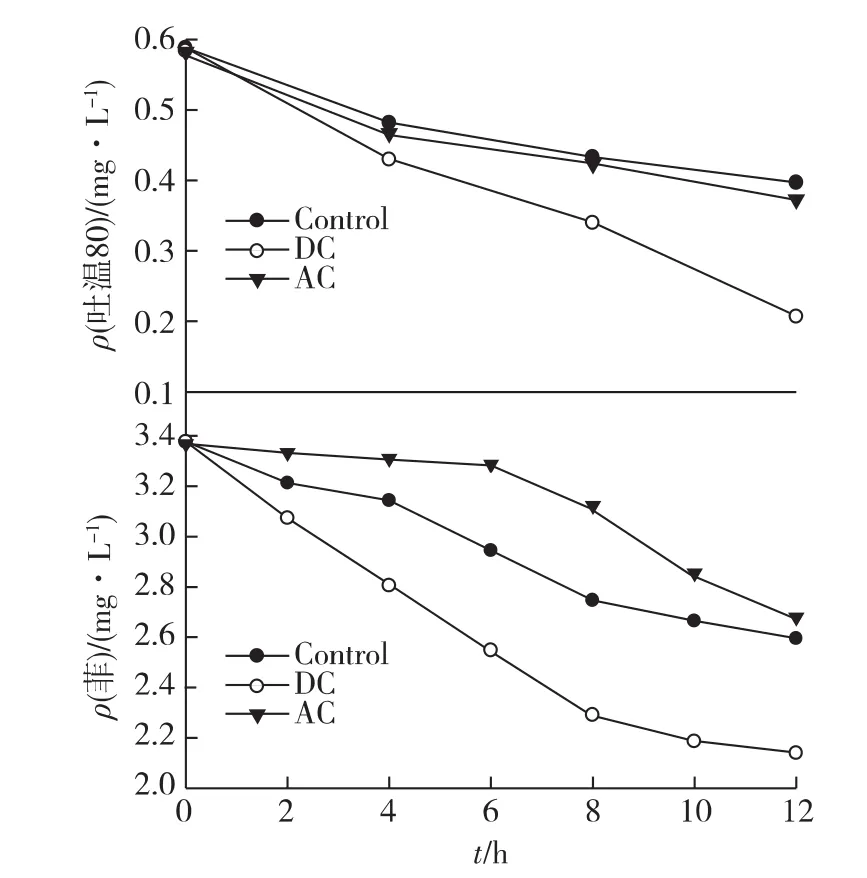
图2 外加电场对菲降解菌及吐温80的影响ig.2 Effects of external electric field on the phenanthrene and Tween 80 in E.dissolvens broth
2.2 外加电场对培养液理化性质的影响
为了考察加电电场(ORV)对细胞菌液理化性质的影响,因此测定了细菌溶液的氧化还原电位(ORP)值和pH,结果见图3。

图3 外加电场对细胞溶液的氧化还原电位和pH的影响Fig.3 Effects of the external electric field on ORP and pH in the E.dissolvens culture broth
由图3可知:菌液的理化性质随着外加电场的施加,溶液的氧化还原电位急剧下降,尤其是直流电在加电的1 h就达到-580 mV,交流电刺激后为-230 mV,而参比值仅为100 mV,并在整个培养周期内显著低于参照菌液。由图3可以看出:溶液的pH随着细胞的生长代谢逐渐下降,原因可能是在细胞生长的后期菌液出现一定程度的酸化现象。而加电后溶液的pH略低于参比值,并且在整个加电过程中pH的变化很小。这一结果与佘鹏等[14]、许晓路等[15]对以葡萄糖为唯一 C 源的培养物体系的电解刺激作用结果相似,加电后细胞的脱氢酶活、底物降解及细胞的生长显著提高。在菌液物化性质上,加电后菌液的氧化还原电位明显下降。这极有可能是阴极水电解反应所生产的H2导致了溶液氧化还原电位的急剧下降[16]。这正是菌液中长期保持有氧状态的强还原性环境的原因,从而促进了菲降解菌的生长和代谢。
3 结论
研究表明,外加电场对菲的降解有明显的促进作用。低电流刺激下,施加直流电能促进菲降解细菌的生长和代谢,对菲的降解效果明显。交流电的刺激效果没有直流电的刺激效果明显,可能是直流电和交流电电极反应产物的不同所造成的。因此,用微生物电解刺激降解多环芳烃污染是一种绿色可行的环保方法。电刺激技术是一个很复杂的体系,但是这一结果有助于加深对微生物电解刺激技术的认识,为以后的应用提供广阔的前景。
[1] 何丽娟,李正华,洪青,等.一株菲降解菌的特性及相关降解基因的克隆[J].应用与环境生物学报,2009,15(5):682-685.
[2] 杨秀虹,汤婉环,李适宇.一株菲降解菌的生长特性及其对荧蒽和芘的降解能力[J].中山大学学报:自然科学版,2012,51(l):107-121.
[3] 刘其友,卢磊,赵东风,等.一株菲降解茵的分离鉴定及其降解条件研究[J].生态环境学报,2010,19(11):2652-2656.
[4] 马建伟,王慧,罗启仕.电动力学作用下土壤中菲的迁移特征及其机理[J].中国环境科学,2007,27(2):241-245.
[5] 马莉,张国庆,曾彩明.化学强化剂在电动修复技术中的应用研究进展[J].化工进展,2008,27(1):38-44.
[6] 宋波,佘鹏,刘铮.微生物电解刺激技术及其在生物化工和环境生物技术中的应用[J].化工进展,2006,25(1):39-42.
[7] Nakanishi K,Tokuda H,Soga T,et al.Effect of electric current on growth and alcohol production by yeast cells[J].J Ferment Bioeng,1998,85(2):250-253.
[8] Beschkov V,Velizarov S,AgathosS N,etal.Bacterial denitrification of waste water stimulated by constant electric field[J].Biochem Eng J,2004,17(2):141-145.
[9] Matsumoto N,Nakasono S,Ohmura N,et al.Extension of logarithmic growth ofThiobacillusferrooxidansby potential controlled electrochemical reduction of Fe(III)[J].Biotechnol Bioeng,1999,64:716-721.
[10] 龙涛,刘翔,杨建刚,等.非离子型表面活性剂吐温80增溶条件下菲的生物降解[J].环境工程学报,2003,4(5):1-4.
[11] Luo Q,Wang H,Zhang X,et al.Effect of direct electric current on the cell surface properties of phenol-degrading bacteria[J].Appl Environ Microbiol,2005,71(1):423-427.
[12] 宋波.溶解肠杆菌的交流电电解刺激过程[J].生物技术通报,2009(3):123-126.
[13] 沈琦,陈继亭,刘大英.凝血因子制品中Tween 80残留量测定方法的研究[J].中国生物制品学杂志,1999(12):111-113.
[14] 佘鹏,宋波,邢新会,等.细菌Enterobacter dissolvens的直流电解刺激过程[J].过程工程学报,2006,6(1):71-76.
[15] 许晓路,申秀英.活性污泥活性参数指标的选评[J].环境科学,1993,14(2):58-62.
[16] Sanetaka S,Shigeru K,Mariko N,et al.Electrolyzed-reduced eater scavenges active oxygen species and protects DNA from oxidative damage[J].Biochem Biophys Res Commun,1997,234(1):269-274.
