湿法磷酸萃取制取高品质磷酸二氢钾工艺研究*
2014-05-04柏任流周骏宏贾双珠
周 静,柏任流,周骏宏,王 珏,罗 骏,贾双珠
(黔南民族师范学院化学与化工系,贵州 都匀 558000)
湿法磷酸萃取制取高品质磷酸二氢钾工艺研究*
周 静,柏任流,周骏宏,王 珏,罗 骏,贾双珠
(黔南民族师范学院化学与化工系,贵州 都匀 558000)
磷酸二氢钾在当前的磷酸盐工业中具有重要的实用价值,其应用涉及到工业、农业、医药以及食品等多个行业。以尽可能低成本的原材料与更简易的工艺流程来生产具备更高品质特性的磷酸二氢钾为时下所需。以湿法磷酸与氯化钾为原料,进行了有机溶剂萃取法制备磷酸二氢钾的工艺研究。研究内容包括:在溶配过程中氯化钾与磷酸物质的量比对氟离子脱除率的影响;氯化钾与磷酸物质的量比、反应时间、反应温度以及萃取相比对萃取率及杂质脱除率的影响;不同洗涤相比对五氧化二磷洗涤率的影响;反萃取以及磷酸二氢钾浓缩结晶的相关工艺。通过实验确定湿法磷酸萃取制取高品质磷酸二氢钾适宜工艺条件:反应温度为60℃,反应时间为30min,氯化钾与磷酸物质的量比为1.0,洗涤相比为12。在此工艺条件下所得磷酸二氢钾产品纯度高达97%,达到磷酸二氢钾农用级优等品标准的要求,同时五氧化二磷回收率可达到96%。
磷酸二氢钾;湿法磷酸;氯化钾;萃取
磷酸二氢钾(KH2PO4)在工业、农业、医药以及食品等行业均有着广泛的应用[1]。尤其是近些年,伴随着以高品质KH2PO4为主要原料的高效复合肥料需求的上升,以及其在医学、化工、食品等方面用量的提高,KH2PO4的常规制备方法已经不能满足现实需求,研究与开发更高效的KH2PO4制备工艺成为非常迫切的事情。
目前KH2PO4的生产方法主要包括中和法、离子交换法、复分解法以及萃取法等。其中萃取法从工艺流程的简化程度、发生条件、污染水平衡量以及生产成本来衡量,均具备了其他几种方法无法比拟的优势,是当前颇具先进性的具有较大发展前途的工业生产技术。然而,关于萃取法生产KH2PO4的工业化报道中几乎仅有三乙胺法这一种方法,其缺点:以热法磷酸为原料,原料价格昂贵;蒸馏回收三乙胺与乙醇会造成大量损失[2]。通过查阅文献资料发现,通常情况下采用萃取法制备KH2PO4其原料均以热法酸或者净化酸以及氯化钾为主。笔者即是在此基础上提出以湿法磷酸与氯化钾为主要原料,采用萃取法制备KH2PO4。新工艺的创新之处在于,采用了新型萃取剂,并利用低质量浓度的湿法磷酸(P2O5质量分数为20%)与氯化钾为原料,开发出了一条生产工业级磷酸二氢钾,同时可生产优质农用磷酸二氢钾,并副产氮、磷复混肥的新工艺。与以往工艺相比,该工艺还具备了操作简便、成本低、产品质量好以及无三废污染等特点。
1 实验材料与方法
1.1 实验仪器与试剂
仪器:DF-101S型集热式恒温加热磁力搅拌器。
试剂与原料:主萃取剂与辅助萃取剂均采用质量分数不低于99%的工业级产品,稀释剂采用分析纯,氨水质量分数为25%~28%,氯化钾采用质量分数大于99.8%的粉末状分析纯产品;湿法磷酸购自广州市纳城化工有限公司,其主要组分及含量(质量分数):P2O5,21.62%;Fe3+,0.24%;Mg2+,0.79%;Al3+,0.28%;SO42-,1.01%;F-,1.75%。
1.2 萃取原理
首先进行最佳萃取剂筛选,继而对通常作为萃取剂的几种醇类、脂类以及胺类溶剂进行试验考察,最终确定有机萃取体系为按质量比为5∶4∶1配制的主萃取剂、辅助萃取剂与稀释剂的混合物。经试验验证,该萃取体系不仅与水的互溶度极小、化学稳定性好、毒性不高,而且对盐酸具有较高的萃取选择性,同时还很容易实现反萃取再生利用,这可以在很大程度上节约成本[3]。用“E”表示该混合萃取剂,其萃取过程中的主要化学反应如下:

基于萃取过程中萃取剂对HCl具有较好的选择性,故主要对HCl进行萃取。萃取过程中主要为HCl与萃取剂发生反应继而转变为有机相。但是,在这个过程中无法避免有较少的H3PO4分子也会与萃取剂发生反应转变为有机相,其反应如下:

在完成以上萃取过程后,可以利用诸如氨水这样的碱性物质对生成的有机相进行反萃取,继而可再次将萃取剂再生还原。在反萃取过程中氨水与有机相物质发生反应,继而生成氯化铵与磷酸二氢胺再次进入到水相,再生后的萃取剂经过水洗便可循环利用[4]。
1.3 工艺流程
采用湿法磷酸萃取法制备磷酸二氢钾,其工艺流程包括溶配、萃取、洗涤、反萃取几个主要步骤,其工艺流程示意图见图1。

图1 湿法磷酸萃取制备磷酸二氢钾工艺流程示意图
2 结果
2.1 溶配过程及效果
在溶配过程中,氯化钾不仅作为钾元素的原料供体,同时也发挥着脱氟沉淀剂的作用,将大部分的氟化物除去。实验过程中分别加入不同量的氯化钾,在溶配时给予充分的搅拌,反应到一定程度后以真空泵抽滤,用电极法对滤液进行分析,考察氯化钾加入量(氯化钾与磷酸物质的量比)对氟离子脱除率的影响,实验结果见图2。
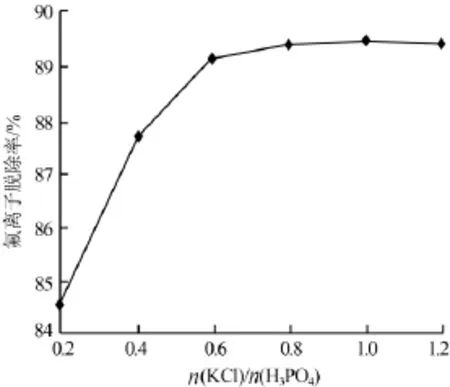
图2 氯化钾与磷酸物质的量比对氟离子脱除率的影响
由图2可以看出,F-脱除率随着氯化钾加入量的增加而不断升高。当n(KCl)/n(H3PO4)处于0.2~0.6时,F-脱除率随着氯化钾用量的增加而明显上升;当n(KCl)/n(H3PO4)超过0.6以后,F-脱除率增加幅度变缓;当n(KCl)/n(H3PO4)等于1.0时,F-脱除率达到最高为89.5%,脱氟后溶液含氟质量分数为0.1%。
2.2 n(KCl)/n(H3PO4)、反应时间对萃取率和杂质脱除率的影响
通过实验发现,当n(KCl)/n(H3PO4)=1.0时,其中有少部分的KCl与氟硅酸发生反应将湿法磷酸中的氟脱除。从反应平衡的角度出发,适当减小n(KCl)/n(H3PO4)对HCl的萃取有促进作用,然而在萃取过程中不可避免会发生少量的磷酸分子与萃取剂发生反应转化为有机相,故在磷酸过量较多的情况下磷酸的损失会有所增加。实验考察了n(KCl)/ n(H3PO4)对磷酸、盐酸萃取率以及对氟离子、硫酸根、铁离子脱除率的影响,结果见图3。固定条件:有机萃取剂与原料液的相比(体积比)为3∶1、萃取温度为62℃、搅拌速度为300 r/min、萃取反应时间为30min。实验还考察了萃取时间对磷酸、盐酸萃取率以及对氟离子、硫酸根、铁离子脱除率的影响,结果见图4。固定条件:有机萃取剂与原料液的相比(体积比)为3∶1、n(KCl)/n(H3PO4)等于1.0、萃取温度为62℃、搅拌速度为300 r/min。
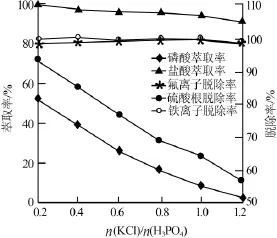
图3 n(KCl)/n(H3PO4)对萃取率及杂质脱除率的影响
由图3可以看出,H3PO4、HCl萃取率以及SO42-脱除率均随着n(KCl)/n(H3PO4)的增加而降低,比较而言HCl萃取率的下降速度相对缓慢;Fe3+、F-脱除率均随着n(KCl)/n(H3PO4)的增加基本保持不变,两者比较F-的脱除率相对有极少量增加。基于萃取反应是在n(KCl)/n(H3PO4)=1.0条件下进行,而HCl萃取率又在n(KCl)/n(H3PO4)=1.2时下降速度比前面快,故将n(KCl)/n(H3PO4)确定为1.0~1.2。由图4可以看出,H3PO4、HCl萃取率以及Fe3+、F-、SO42-的脱除率均随着反应时间的延长而逐渐增加。其中H3PO4、HCl萃取平衡时间分别为40min和30min,F-、SO42-等脱除稳定时间均为30min,Fe3+脱除平衡时间为20min。参考以上相关时间点参数,在保证HCl高萃取率与杂质高脱除率以及H3PO4低萃取率的情况下,并综合考虑能耗与效率等多方面的因素,选定最佳萃取时间为30min。

图4 反应时间对萃取率及杂质脱除率的影响
2.3 反应温度、萃取相比对萃取率和杂质脱除率的影响
通常情况下萃取温度对反应速率与有机相的黏度会造成影响。萃取反应时温度越低有机相的黏度越大,尤其是完成萃取后的有机相在常温条件下其黏度非常高,这些情况均会妨碍相的分离。同时,在温度足够低的情况下有机相的溶解度也会随之降低,即使搅拌也几乎不能将两相聚集分层,继而造成乳化甚至可能出现第三相,操作比较困难[5]。而在温度较高的情况下其耗能又会增加。基于上述分析,在溶剂萃取的全程均应保持适宜的温度。实验考察了反应温度对磷酸、盐酸萃取率以及对氟离子、硫酸根、铁离子脱除率的影响,结果见图5。固定条件:有机萃取剂与原料液的相比(体积比)为3∶1、n(KCl)/ n(H3PO4)=1.0、搅拌速度为300 r/min、萃取时间为30min。另外,在液液萃取中萃取相比即是指有机相与水相的体积比,而萃取是指某些物质从水相向有机相转移的过程,直到在两相中达到平衡。当水相定量时萃取相剂量的增加可将该平衡向萃取方向推动,进而提高萃取效率。但事实上在萃取相剂量不断增加的情况下,越到后面其平衡的转移困难度越大,故过分增大相比并无多大现实意义,甚至反而会显著增加设备的负荷并造成原材料的浪费。继而考察了萃取相比对磷酸、盐酸萃取率以及对氟离子、硫酸根、铁离子脱除率的影响,结果见图6。固定条件:萃取温度为60℃、n(KCl)/n(H3PO4)=1.0、搅拌速度为300 r/min、萃取时间为30min。

图5 反应温度对萃取率及杂质脱除率的影响

图6 萃取相比对萃取率及杂质脱除率的影响
由图5可以看出,H3PO4、HCl萃取率以及Fe3+、F-等杂质的脱除率受温度的影响均较小,其中H3PO4、HCl萃取率以及F-脱除率随着温度的升高均会略微增加,而当温度升高到60℃以后又略有下降;SO42-脱除率受温度的影响较大,在60℃之前随温度的升高其表现为比较明显的升高趋势,60℃之后略有下降;Fe3+脱除率几乎不随温度的变化而改变。基于此,在综合衡量有机相黏度特性、操作耗能以及之后磷酸二氢钾结晶有一定温度需求的情况下,将60℃作为最佳萃取温度。由图6可以看出,H3PO4、HCl萃取率以及Fe3+、F-、SO42-等杂质的脱除率均随萃取相比的增加而升高,且均在萃取相比达到3.0时开始趋于稳定。其中,在萃取相比为1.0~3.0时,HCl萃取率以及SO42-脱除率均随相比的增加表现出较快的升高速度,而在萃取相比为1.0~2.0时,H3PO4萃取率几乎保持不变,直至相比增加到3.0,相关反应均达到较理想的稳定状态。故将3.0确立为最佳萃取相比。2.4萃取后有机相的洗涤完成萃取后,在有机相中溶入少量H3PO4,故在一定程度上造成P2O5的损失,因此在完成萃取后对有机相实施必要的洗涤操作,通过将H3PO4溶于水相来提高P2O5的收率。选择KCl溶液作为洗涤液,洗涤温度为62℃,搅拌速度为300 r/min,洗涤时间为20min。根据萃取试验中有机相P2O5的量来确定KCl的量,在此基础上过量1.1倍。用蒸馏水分别配制出不同浓度的KCl溶液,继而进行相比为3、6、9、12、15、20等几种条件下的洗涤操作,不同相比对P2O5洗涤率的影响见图7。

图7 不同洗涤相比对P2O5洗涤率的影响
由图7可以看出,当洗涤相比为12时P2O5洗涤率达到最大值,之后随着洗涤相比的增加P2O5洗涤率反而表现出逐渐降低的趋势,故将12确定为最佳洗涤相比。
2.5 反萃取
反萃取为萃取的逆反应过程,其操作的主要目的就是要实现有机相的回收再利用。萃取HCl后的有机相用诸如氨水、碳酸氢铵等实施碱中和法回收萃取剂。经实验观察,将氨水作为反萃取剂可以获得较高的反萃取效率[6]。将反萃取温度定为62℃。经反萃取操作后,可更容易地进行分相,有机相进行水洗操作后可返回到萃取段循环使用,水相冷却结晶,过滤干燥得到合格的氯化铵副产品。
2.6 浓缩结晶
磷酸二氢钾的溶解度随温度的升高有较为显著的增加,故采用冷却结晶的方法比较适宜。将萃取、过滤所获得的溶液在一定真空度与温度条件下浓缩处理,然后通过一定程度的降温,便可制得高品质大颗粒磷酸二氢钾晶体[7]。在最佳工艺条件下,经循环上述实验操作,最终得到的产品纯度高达97%,同时P2O5回收率可以达到96%,效果令人满意。
3 结论
本研究所确定的工艺不需要将湿法磷酸进行预净化处理,具体的萃取工艺条件:萃取温度为60℃,萃取时间为30min,氯化钾与磷酸物质的量比为1.0,洗涤相比为12。在此工艺条件下所得到的磷酸二氢钾产品纯度高达97%,达到磷酸二氢钾农用级优等品标准的要求,同时P2O5的回收率可达到96%[8]。萃取操作仅涉及到一级萃取,故不需要大型设备。总之,湿法磷酸萃取制取磷酸二氢钾的工艺兼具了流程短、成本低、操作简单等多方面优点,值得在磷化工行业推广应用[9]。
[1]李春丽,张志强,关云山,等.磷酸氢钙制备磷酸二氢钾的工艺研究Ⅰ[J].无机盐工业,2011,43(7):48-50.
[2]王盼,李军,罗建洪.磷酸氢钙生产磷酸二氢钾的工艺研究[J].无机盐工业,2011,43(2):50-52.
[2]罗建洪,李军,王英豪.磷酸二氢钾的生产技术[J].磷肥与复肥,2012,27(2):4-6,28.
[4]向群,龚勇.萃取法制备磷酸二氢钾[J].广东化工,2011,38(11):218-219,221.
[5]雷武.以湿法磷酸生产磷酸二氢钾[J].无机盐工业,2004,36(2):44-45.
[6]陈路萍,樊继宽.湿法磷酸生产磷酸二氢钾新工艺[J].淮海工学院学报,2001,10(2):39-41.
[7]张莉.液液离子交换法制备磷酸二氢钾过程的研究[D].上海:华东理工大学,2012.
[8]张志强,都明元,杨英桂.钙水制备磷酸二氢钾过程中母液的净化研究[J].化学世界,2012,53(10):577-579,583.
[9]樊春升,钟耀荣,王和平,等.湿法磷酸萃取法制取精细磷酸盐的研究[J].磷肥与复肥,2004,19(2):15-17.
联系方式:qnsytaoer@163.com
Preparation of high-quality potassium dihydrogen phosphate from wet-process phosphoric acid by extractionm ethod
Zhou Jing,BaiRenliu,Zhou Junhong,Wang Jue,Luo Jun,Jia Shuangzhu(DepartmentofChemistry and Chemical Engineering,Qiannan NormalCollege forNationalities,Duyun 558000,China)
Potassium dihydrogen phosphate hasan importantpracticalvalue in the currentphosphate industry,and itwasalso applied inmany industries,such as industry,agriculture,pharmacy,and foodstuff.To produce higher-quality potassium dihydrogen phosphatewith lower costof raw materials and simpler process is today′s need.Potassium dihydrogen phosphate was prepared by organic solventextraction processwith wet-process phosphoric acid and potassium chloride as rawmaterials.The study contents included:the influence ofamount-of-substance ratio of potassium chloride to phosphoric acid on removal rate of F-during the solution preparation;the influence-of-amountof substance ratio of potassium chloride to phosphoric acid,reaction time,reaction temperature,and extraction phase ratio on extraction rate and impurities removaleffect;the influence of differentwashing phase ratios on washing rate of the high-quality P2O5;relevant back-extracted and potassium dihydrogen phosphate concentrated crystallization processes etc..Optimum conditions for preparing high-quality potassium dihydrogen phosphatewereobtained as follows∶reaction temperatureof60℃,reaction timeof30min,amount-of-substance ratioofpotassium chloride to phosphoric acid of1.0,andwashingphase ratioof12.Under those conditions the productpuritywas97%and the recovery rateof P2O5reached 96%,whichmet the firstgrate requirementofagriculturalstandard.
potassium dihydrogen phosphate;wet-processphosphoric acid;potassium chloride;extraction
TQ126.35
A
1006-4990(2014)09-0021-05
贵州省教育厅高校优秀科技创新人才项目黔教合KY字[2013]155。
2014-03-23
周静(1974—),女,副教授,研究方向为磷化工绿色化学。
