低温联合腺苷预处理对脊髓缺血-再灌注的保护作用
2014-05-04曾燕
曾 燕
(邵阳医学高等专科学校附属医院药剂科,湖南 邵阳 422000)
外科胸腹部大血管手术后,由于缺血-再灌注引起的脊髓损伤仍存在较高风险[1-2]。如何预防和治疗围手术期的脊髓缺血-再灌注损伤已成为研究的重要课题。目前,低温已广泛应用于外科大血管手术中中枢神经组织的保护[3-4],也是简单、有效的神经保护措施。腺苷是腺嘌呤核苷酸的代谢产物,普遍分布在细胞内外。Koichi等[5]研究发现,腺苷可通过促进神经元突起生长和神经再生而对脊髓损伤起保护作用。但低温联合腺苷治疗脊髓损伤的报道极少,其具体的作用机制也尚不清楚。本研究通过建立大鼠脊髓缺血-再灌注模型,用低温联合腺苷的处理方法,观察其是否对脊髓缺血-再灌注损伤有保护作用,以及可能的作用机制。
1 材料与方法
1.1 材料
动物及分组:选择成年健康雄性SD大鼠27只,SPF级,体重(200±20)g,由湖南省中医药大学动物实验中心提供,动物合格证号为湘医动字D20-013号,室温18~20℃,湿度65% ~70%,均自由饮水进食。随机分为3组,各9只。低温处理组(A组),腹主动脉阻断90 min,术中全身低温18℃维持;常温腺苷手术组(B组),夹闭前 10 min尾静脉注射腺苷,剂量为 0.06 mL/100 g,质量浓度为5 g/L,腹主动脉阻断 90 min;腺苷 +低温18℃处理组(C组),分离腹主动脉,夹闭前10 min尾静脉注射腺苷,剂量为0.06 mL /100 g,质量浓度为 5 g/L,至 18 ℃ 维持,腹主动脉阻断90 min。
主要材料:抗兔 Caspase-12、葡萄糖调节蛋白78(GRP-78)抗体(Abcam公司),免疫组化试剂盒;TUNEL试剂盒。
1.2 试验方法
大鼠脊髓缺血-再灌注模型建立:腹腔注射(每100 g体重0.3 mL)10%水合氯醛麻醉大鼠成功后,仰卧位固定于试验台上,腹部备皮消毒切开,于左肾动脉分叉下钝性分离并显露出近端1 cm腹主动脉,左右髂总动脉分叉上钝性分离并显露远端1 cm腹主动脉,尾静脉注射(每 100 g体重0.1 mL)肝素(浓度为500 U/mL)5 min后,用小号无创动脉夹夹闭腹主动脉近端及远端,夹闭90 min后松开动脉夹行再灌注,缝合切口。
温度监测:用数字式电子肛温计监测大鼠肛温。手术过程中以普通100 W灯泡照射保温,使肛温维持在37℃左右。低温处理组分离腹主动脉后用自制冰盒降温将大鼠肛温降至18℃,阻断90 min内维持18℃,松夹后用普通100 W灯泡照射复温至37℃左右。
脊髓组织取材:预定时间点,一部分大鼠在麻醉下开胸暴露心脏,剪开左心室插入灌注针头至升主动脉,用止血钳固定,剪开右心房,快速灌注生理盐水(室温)100~150 mL,待血液冲洗干净后(肝脏变白),即灌注 4%多聚甲醛(4℃)500 mL。背部备皮,将皮肤剪开,用咬骨钳将棘突咬掉,暴露脊髓,取出腰骶段脊髓,行石蜡包埋,常规HE染色。
运动功能评分:由2名不了解分组情况的观察者评估和记录评分,每例均测试3次,取其平均值,分别于再灌注后6,24,48 h评估动物后肢运动状况。参照改良Tarlov标准对神经功能进行评分,0级为后肢无活动,不能负重;1级为后肢可见活动,但不能负重;2级为后肢活动频繁或有力,不能负重;3级为后肢可支持体重,能走1~2步;4级为可行走,仅有轻度障碍;5级为行走功能正常。
免疫组织化学显色:石蜡切片3%H2O2室温90 s,正常动物血清封闭 20 min,1∶200兔抗鼠 Caspase-12孵育过夜,4℃;生物素标记的羊抗兔IgG,37℃,2 h;链霉素-亲和素-过氧化物酶复合物(SABC 复合物),37℃,1 h;每次换液前均用 0.01 mol/L PBS冲洗5 min×3次,DAB加硫酸镍显色,常规脱水,封片。阳性细胞为紫蓝色,光镜下观察,计录阳性细胞的数量;并用图像分析系统(成都金盘多媒体图像处理系统)测量阳性细胞的平均光密度值。
TUNEL染色:石蜡切片蛋白酶K消化60 min,3%H2O2-甲醇液50 μL 阻断内源型过氧化物酶,室温 10 min;0.1%TritonX -100冰浴 5 min;TUNEL 反应液 50 μL,37 ℃消化 60 min; POD 50 μL;每次换液前均用PBS冲洗5 min×3次;DAB加硫酸镍显色,脱水,封片。凋亡神经细胞核呈深浅不一的紫黑色颗粒状。
1.3 统计学处理
2 结果
2.1 HE 染色
经常规HE染色后,各组均可见凋亡细胞,尤以常温手术对照组为甚,凋亡细胞核浓缩碎裂,染色加深,大小不一致,或呈现大小不等的圆形小体,并被细胞膜包绕,即凋亡小体,有或无胞质浓缩。A组神经元肿胀,胞浆淡染,局部充血水肿,尼氏体淡染,排列紊乱;B组、C组神经元改变较A组轻;C组神经元有一定程度损伤,但较B组明显减轻,充血和水肿也减轻,尼氏体排列较规则。
2.2 行为学评分结果
分别对各组大鼠再灌注6,12,24 h的后肢运动功能进行评分。与A组相比,B组、C组各时间点后肢功能评分降低幅度减少(P<0.01);相对于 B组,C组各时间点术后评分明显增高(P < 0.01)。见表 1。
2.3 TUNEL 染色结果
各组均出现神经元和神经胶质细胞调亡,细胞核呈深兰色,神经元呈圆形或三角形,主要分布于前角和中央管周围,部分细胞可见核固缩,深染,位于细胞一侧;神经胶质细胞的凋亡分布广泛,但主要位于邻近灰质的白质部分。再灌注后,B组、C组凋亡细胞少于A组,且B组凋亡细胞数多于C组。
表1 3组 Tarlov评分结果(,分,n=9)
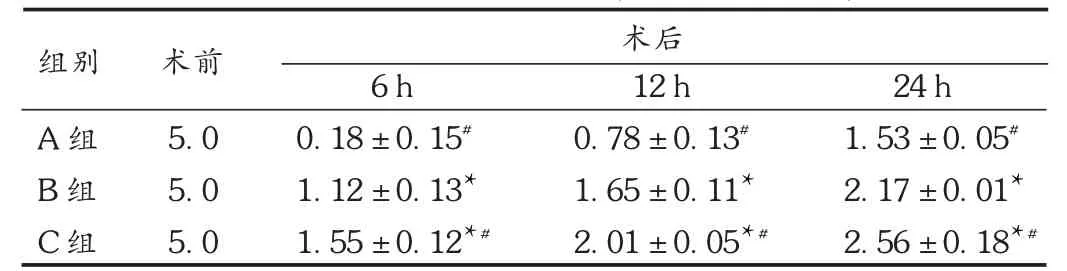
表1 3组 Tarlov评分结果(,分,n=9)
注:与A组同时点比较, P<0.01;与B组同时点比较,#P<0.01。
组别A组B组C组术前5.0 5.0 5.0术后6 h 0.18 ± 0.15#1.12 ± 0.13 1.55 ±0.12 #12 h 0.78 ± 0.13#1.65 ± 0.11 2.01 ±0.05 #24 h 1.53 ± 0.05#2.17 ± 0.01 2.56 ±0.18 #
2.4 免疫组织化学
在光镜下观察,阴性对照未见细胞染色。各组在脊髓缺血再灌注后均有神经元 Caspase-12和GRP-78表达,A组脊髓Caspase-12阳性表达明显增多,着色更深;B组阳性细胞表达减少,C组仅有少量阳性神经元表达差异有统计学意义(P<0.05);A组脊髓GRP-78阳性表达较B组、C组少,着色浅;C组阳性表达高于 B组差异有统计学意义(P<0.05)。见表2。
表2 大鼠脊髓缺血-再灌注后免疫组织化学变化结果(,n=9)

表2 大鼠脊髓缺血-再灌注后免疫组织化学变化结果(,n=9)
注:与 A 组比较, P <0.05;与 B 组比较,#P <0.05。
项目平均光密度值积分光密度值组别A组B组C组A组B组C组Caspase-12 0.42 ± 0.10#0.31 ± 0.12 0.14 ±0.08 #238.11 ± 113.26#176.35 ± 25.27 86.65 ±43.56 #GRP-78 0.15 ± 0.01#0.46 ± 0.13 0.61 ±0.32 #98.65 ± 25.12#252.18 ± 33.14 425.64 ±85.32 #
3 讨论
脊髓缺血损伤形式有2种,即瞬时的损伤和延迟的损伤,前者常常是由于急性的缺血损伤所造成的神经细胞坏死,后者则多是由于细胞凋亡所引起[6]。GRP-78是细胞为了适应未折叠蛋白反应(UPR)所产生的一类应激蛋白,属于HSP70基因家族,其生理功能是协助蛋白质的正确折叠和装配。Caspase-12是caspase家族中第1个被发现与内质网应激相关的蛋白,是介导内质网应激引起的细胞凋亡的关键因子。目前已有研究报道,内质网应激通过诱导神经细胞的凋亡而参与脑和脊髓缺血-再灌注损伤[7]。腺苷是中枢神经系统内突触传递和神经元活动的重要抑制性调节因子之一,体外腺苷发挥作用可通过受体、转运进入细胞2种形式。研究发现,早期应用腺苷受体激动剂能改善脊髓缺血-再灌注损伤[8]。近年来有文献报道,低温能减少Caspase-12蛋白在缺血梗死区域的编码表达[9]。且药物与低温联合应用可能会比单独用药效果更好[10-11]。以上现象提示,低温可能加强了药物的保护效果或者拓宽了药物的治疗范围[12]。
本试验HE染色结果显示,B组、C组大鼠脊髓缺血再-灌注损伤后的局部缺损区域,缺血坏死等改变比A组轻,且C组改变比B组轻,细胞残留数目增多,形态大致正常;行为学评分结果显示,各组时间点,B组、C组高于A组,且 B组低于 C组;TUNEL染色结果显示,再灌注后,B组、C组凋亡细胞少于A组,且B组凋亡细胞数多于C组,提示低温联合腺苷对脊髓神经细胞缺血-再灌注损伤有保护作用,且比单独应用低温或腺苷更有效。
本试验免疫组化结果显示,各组在脊髓缺血-再灌注后均有神经元 Caspase-12和 GRP-78表达,A组脊髓 Caspase-12阳性表达明显增多,着色更深;B组阳性细胞表达减少,C组仅有少量阳性神经元表达;A组脊髓 GRP-78阳性表达较 B组、C组少,着色浅;C组阳性表达高于B组。说明在脊髓缺血-再灌注中低温联合腺苷保护作用的机制可能是通过降低Caspase-12和上调GRP-78的表达来减少脊髓神经组织的损伤。
综上所述,本试验证实了低温联合腺苷对于脊髓缺血-再灌注损伤有保护作用,并且低温可能加强了腺苷的保护效果,其可能是通过抑制内质网应激反应而实现对脊髓神经组织的保护。进一步证实了低温结合药物是一种更有效的治疗方法,为治疗脊髓缺血-再灌注损伤提供了新的治疗途径,但其具体的分子作用机制及临床应用仍有待进一步研究。
参考文献:
[1]Estrera AL,Miller CC,Huynh TT,et al.Preoperative and operative predictors of delayed neurologic deficit following repair of thoracoabdominal aortic aneurysm[J].J Thorac Cardiovasc Surg,2003,126:1 288 - 1 294.
[2]Conrad MF,Crawford RS,Davison JK,et al.Thoracoabdominal aneurysm repair:a20 - yearperspective[J].AnnThorac Surg,2007,83:S865 - S861.
[3]程 强,冉 毅,霍建宏,等.神经节苷脂联合亚低温治疗重型颅脑损伤 60 例[J].中国药业,2013,22(15):103-104.
[4]耿 煜,刘利群.亚低温治疗急性重型颅脑损伤40例[J].中国药业,2009,18(11):50 -51.
[5]Koichi T, Yoshikatsu S, Hiroaki K, et al.Protection from postischemic spinal cord injury by perfusion cooling of the epidural space during most or all of a descending thoracic or thoracoabdominal aneurysm repair[J].Gen Thorac Cardiovasc Surg,2010,58:228 - 234.
[6]Papakostas JC,Matsagas MI,Toumpoulis IK,et al.Evolution of spinal cord injury in a porcine model of prolonged aortic occlusion[J].J Surg Res,2006,133:159 - 166.
[7]Taketomo M,Kazumasa O,Bagus H,et al.Sodium 4 - phenylbutyrate protects against spinal cord ischemia by inhibition of endoplasmic reticulum stress[J].J Vasc Surg,2010,52:1 580 - 1 586.
[8]T.Brett R,Curtis GT,David OO,et al.Early adenosine receptor activation ameliorates spinal cord reperfusion injury[J].J Cardiovasc Med(Hagerstown),2008,9(4):363 - 367.
[9]Florian B,Vintilescu R,Balseanu AT,et al.Long- term hypothermia reduces infarct volume in aged rats after focal ischemia.Neurosci[J].Lett,2008,438:180 - 185.
[10]Coimbra C,Drake M,Boris- Moller F,et al.Long- lasting neuroprotective effect of postischemic hypothermia and treatment with an anti-inflammatory/antipyretic drug:evidence for chronic encephalopathic processes following ischemia[J].Stroke,1996,27:1 578 - 1 585.
[11]Nito C,Kamiya T,Ueda M,et al.Mild hypothermia enhances the neuroprotective effects of FK506 and expands its therapeutic window following transient focal ischemia in rats[J].Brain Res,2004,1 008:179 - 185.
[12]Ross SD,Kern JA,Gangemi JJ,et al.Hypothermic retrograde venous perfusion with adenosine cools the spinal cord and reduces the risk of paraplegia after thoracic aortic clamping[J].J Thorac Cardiovasc Surg,2000,119(3):588-595.
