三甲氧基二苯乙烯对小鼠巨噬细胞产肿瘤坏死因子-及细胞核因子- B活性的作用研究
2014-05-02曾清华高洁生
曾清华 ,饶 慧 ,高洁生
(1.湖南省人民医院肾内风湿免疫科,湖南 长沙 410006; 2.中南大学湘雅二医院风湿免疫科,湖南 长沙 410000)
3,5,4’-三甲氧基二苯乙烯(3,5,4'-trimethoxystilbene,BTM)是以白藜芦醇为原料人工合成的一种新型甲基化衍生物。白藜芦醇是一种具有多种生物学活性的非黄酮类多酚化合物,具有抗炎、抗氧化、抗肿瘤、免疫调节、防治心血管疾病及抗衰老等作用。近年来其抗炎作用越来越多地受到重视,然而由于分子中有3个酚羟基,白藜芦醇很不稳定,极易被氧化,而且血中半衰期短,生物利用度有限,因此限制了其临床使用效果[1]。BTM的稳定性和生物活性较白藜芦醇均大大增强[2],但目前对BTM的研究都主要集中在抗肿瘤方面,关于其对炎症细胞产生炎症因子的影响,国内外文献报道极少。本试验拟以小鼠巨噬细胞作为BTM作用的靶点,观察BTM对小鼠巨噬细胞经脂多糖(LPS)诱导后产生肿瘤坏死因子 -α(TNF-α)及细胞核因子-κB(NF-κB)活性的影响,探讨其抗炎作用。现报道如下。
1 仪器、材料与方法
1.1 仪器与材料
超净工作台(Thermo FormaMSC),培养箱(Thermo Forma3111),倒置显微镜(Nikon TMS-F),光学显微镜(Olympus BX50),酶联免疫检测仪(Labsystems Dragon Wellscan MK2)等。RAW 264.7 小鼠巨噬细胞,L929小鼠成纤维细胞。RPMI-1640培养基、胎牛血清、0.25%胰酶(均购于美国 Gibco公司);结晶紫、放线菌素 D、LPS(均购于美国 Sigma公司);二甲基亚砜(DMSO),十二烷基磺酸纳(SDS)(均购于美国 Amresco公司);兔抗鼠 NF-κB多克隆抗体、即用型SABC试剂盒、DAB显色试剂盒(均购于武汉博士德公司);白藜芦醇、BTM由中南大学化工学院合成提供。
1.1 试验方法
1.2.1 对巨噬细胞 RAW 264.7的处理
调整 RAW 246.7密度为 3×105/mL,接种于 24孔板,每孔1 mL,同时放入无菌盖玻片,培养24 h后磷酸盐缓冲液(PBS)清洗 2 遍,加入浓度分别为 5,10,20,40,80 μmol/L 的 BTM 和白藜芦醇 1 mL/孔培养 30 min,再加入 10μg/mL 的 LPS 1 mL/孔培养6 h,收集细胞上清液,检测 TNF-α的活性,以细胞爬片检测巨噬细胞中NF-κB的表达。以加白藜芦醇的细胞作为药物对照组,以不加药物仅加LPS的细胞作为阴性对照组(LPS组),以不加药物亦不加LPS的细胞作为正常对照组。
1.2.2 L929细胞结晶紫染色法检测TNF-α的活性
调整L929细胞密度为3×105/mL,接种于96孔板,每孔加入100μL,再加入2μg/mL的放线菌素D每孔100μL及各组培养上清液每孔100μL,以RPMI-1640为对照组,24 h后弃去上清液,加入0.5%的结晶紫200μL染色10min,用流水洗去结晶紫,常温干燥,加10%SDS100μL,置于37℃,30min,混匀后在 490 nm波长处测吸光度(OD)值。用细胞毒百分率表示上清液所含TNF-α的活性,抑制百分率表示药物对小鼠巨噬细胞产生TNF-α的抑制程度。细胞毒百分率(%)=(1-上清液 OD值/对照 OD值)×100%,抑制百分率(%)=(1-药物上清液细胞毒百分率/阴性对照上清液细胞毒百分率)×100%。
1.2.3 BTM和白藜芦醇对L929细胞的毒性检测
如上方法,在长满L929细胞的96孔板内加入不同浓度的BTM和白藜芦醇,检测药物本身对L929细胞生长的影响。
1.2.4 免疫细胞化学法检测NF-κB的活性
按试剂盒说明书进行操作,阴性对照以PBS代替一抗,阴性对照片仅为背景着色,巨噬细胞内无棕黄色染色。NF-κB免疫化学染色结果判定:细胞爬片中巨噬细胞胞核呈棕黑色染色或(和)胞核附近的胞浆呈棕黄色染色为阳性细胞。阳性细胞率计算:每张细胞爬片在光镜下计数5个400倍视野,根据视野中阳性细胞数占细胞总数比例计算阳性率。阳性细胞率(%)=阳性细胞数/细胞总数×100%。
1.3 统计学处理
2 结果
2.1 BTM和白藜芦醇对L929细胞的毒性检测
由表1可见,不同浓度BTM和白藜芦醇组 OD值与RPMI-1640组相比,差异均无统计学意义,各浓度组药物本身对L929细胞生长无影响,巨噬细胞培养上清液可直接用于测定TNF-α的活性而不需透析。

表1 药物和L929细胞共同培养后的 OD值
2.2 L929细胞结晶紫染色法检测TNF- 的活性
由表2可见,随着药物浓度的增大,细胞上清液中细胞毒百分率逐渐下降,药物的抑制百分率逐渐升高,且BTM的作用强于白藜芦醇,各组间比较差异均有统计学意义(P<0.05)。
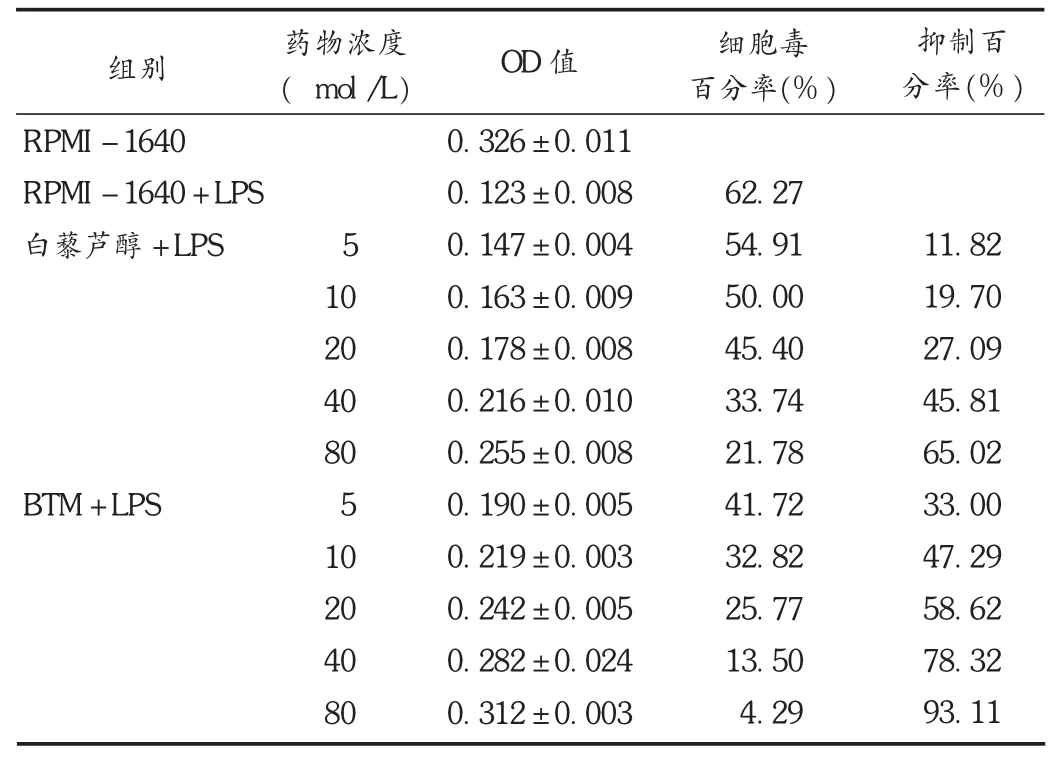
表2 上清液和L929细胞共同培养后的结果
2.3 免疫细胞化学法检测NF- B的活性
由表3可见,巨噬细胞经白藜芦醇和BTM处理后各药物浓度组 NF-κB的阳性细胞率与 LPS组比较,差异有统计学意义(P<0.01),且 BTM的作用强于白藜芦醇。
2.4 药物浓度、TNF- 活性及NF- B活性之间的相关性分析
白藜芦醇的浓度与巨噬细胞培养上清液中TNF-α的细胞毒百分率及巨噬细胞爬片中NF-κB的阳性细胞率呈负相关,相关系数分别为 -0.962 和 -0.964,P 值均为 0.002;BTM 的浓度与巨噬细胞培养上清液中TNF-α的细胞毒百分率及巨噬细胞爬片中NF-κB的阳性细胞率亦呈负相关,相关系数分别为-0.876 和 -0.881,P 值分别为 0.022 和 0.020;巨噬细胞培养上清液中TNF-α的细胞毒百分率和巨噬细胞爬片中NF-κB的细胞阳性率成正相关,相关系数为0.997,P值为0.000。

表3 巨噬细胞爬片中NF- B的表达结果
3 讨论
巨噬细胞是一种重要的炎性细胞,可产生TNF-α、白细胞介素-1(IL-1)、人粒细胞-巨噬细胞集落刺激因子(GM-CSF)等多种前炎性因子。TNF-α作为主要的炎性细胞因子,在局部炎性反应和组织损伤中均居于重要地位,NF-κB介导许多来自巨噬细胞的炎性介质的表达,是TNF-α等基因活化的重要转化因子。白藜芦醇是一种具有多种生物学活性的非黄酮类多酚化合物,广泛存在于食用和药用植物中,是植物为抵抗外来侵害时产生的一种植物抗毒素,目前白藜芦醇对炎性反应的影响在LPS诱导的巨噬细胞中研究较多。本研究结果显示,巨噬细胞经LPS刺激后被激活,产生大量的TNF-α且NF-κB被显著活化,而将巨噬细胞与白藜芦醇共同培养后,LPS刺激的TNF-α的产生和NF-κB的活化都受到不同程度的抑制,显示白藜芦醇可以通过抑制NF-κB的活化从而抑制TNF-α的产生,且呈浓度依赖性,随着药物浓度的增高抑制作用逐渐增强。
BTM 是到目前为止发现的活性最强的白藜芦醇的甲基化衍生物,为白色无定形粉末,可溶于乙醇、甲醇、DMSO,不溶于水。目前对BTM的研究主要集中在抗肿瘤方面。与白藜芦醇相比,BTM不仅大大提高了生物利用度,而且在保留白藜芦醇生物药理特性的基础上,抑制肿瘤细胞的有丝分裂使细胞周期停滞及抑制微管蛋白聚合的作用都显著增强,是白藜芦醇的100倍[3]。Chabert等[4]利用自己合成的BTM,研究其对多种不同癌细胞株的影响,包括人直肠腺癌细胞(Caco-2)、SW-480(人结肠腺癌细胞)、SW-620、SW-480(转移癌细胞)、KB(人头颈部癌细胞)、TK-6(人淋巴瘤细胞)等,亦得到与本研究类似的结果,且发现BTM本身对细胞并没有直接的细胞毒作用。Matsuda等[5]研究认为,BTM苯环上的甲氧基对于药物的活性很重要,尤其是3位上的甲氧基,证实了BTM具有抗变应性活性,可显著抑制抗原诱导的RBL-2H3细胞TNF-α和白细胞介素-4(IL-4)的释放。Simoni等[6]用顺式BTM作用于人前髓细胞性白血病细胞(HL-60),发现BTM可影响整个细胞分裂周期,包括G0/G1期、S期及G2/M期,减少各个时期的细胞数,使凋亡细胞的比例增加。Seiler等[7]研究顺式BTM对SW-620的作用发现,其会导致细胞多倍体化,引起MMP-7及tPA等一些蛋白水解酶分泌的增加,但细胞的侵袭力下降,且侵袭力与药物浓度成负相关。BTM还具有非常强的抗血管生成作用,其抑制内皮细胞增殖、生长、胶原质侵入和形态形成等活性是白黎芦醇的30~100倍,并具有很强的血管靶向性,可显著引起内皮细胞中的微管分解和微管蛋白解聚[8]。Pan等[9]最近研究显示,BTM抑制人类肿瘤细胞生长的潜力强于白藜芦醇,可通过调控活性氧类(ROS)来调节线粒体的功能并诱导细胞凋亡,且 ROS在凋亡的早期即已产生,要早于细胞色素 C的释放、caspase的激活及DNA链的断裂;此外,他们还利用携带COLO-205肿瘤的重症联合免疫缺陷(SCID)小鼠进行了体内试验,给小鼠腹腔注射质量浓度为50 mg/kg的BTM可见显著的治疗效果,观察到接受治疗的肿瘤部位出现了DNA链的断裂和caspase的激活,表明有细胞凋亡产生,另外还有细胞分裂周期抑制因子p21蛋白表达的增加和增殖细胞核抗原(PCNA)蛋白表达的减少。但关于BTM对炎症细胞产生炎性因子的影响,国内外相关文献报道极少。Deng等[10]的研究提示,BTM可能具有比白藜芦醇更强的抗炎能力。本研究中,通过观察BTM对炎性巨噬细胞的影响发现,BTM和白藜芦醇一样,亦可抑制LPS诱导的TNF-α的产生和NF-κB的活化,并呈浓度依赖性,随着药物浓度的增高抑制作用逐渐增强。因此推断,BTM亦可通过抑制NF-κB的活性来减少TNF-α的产生,而且BTM的抑制作用比白藜芦醇更强。
参考文献:
[1]汪冬庚.大鼠一次性灌服白藜芦醇血浓度测定方法研究[J].中国临床药理学与治疗学,2004,9(6):646-649.
[2]陈国良,耿春梅,刘湘水.白藜芦醇衍生物及类似物的研究进展[J].药学进展,2006,30(4):145-150.
[3]Schneider Y,Chabert P,Stutzmson J,et al.Resveratrol analog (Z) -3,5,4'-trimethoxystilbene is a potent anti-mitotic drug inhibiting tubulin polymerization[J].Int JCancer,2003,107(2):189-196.
[4]Chabert P,Fougerousse A,Brouillard R.Anti-mitotic properties of resveratrol analog (Z) -3,5,4’ -trimethoxystilbene[J].BioFactors,2006,27:37-46.
[5]Matsuda H,Tewtrakul S,Morikawa T,et al.Anti-allergic activity of stilbenes from Korean rhubarb(RheumundulatumL.):structure requirements for inhibition of antigen-induced degranulation and their effects on the release of TNF-alpha and IL-4 in RBL-2H3 cells[J].Bioorg Med Chem,2004,12(18):4 871-4 876.
[6]Simoni D,Roberti M,Invidiata FP,et al.Stilbene-based anticancer agents:resveratrol analogues active toward HL60 leukemic cells with a non-specific phase mechanism[J].Bioorg Med ChemLett,2006,16(12):3 245-3 248.
[7]Seiler N,Schneider Y,Gosse F,et al.Polyploidisation ofmetastatic colon carcinoma cells by microtubule and tubulin interacting drugs:Effect on protelytic activity and invasiveness[J].International Journal of Oncology,2004,25:1 039-1 048.
[8]BelleriM,RibattiD,Nicoli S,etal.Antiangiogenic and vascular-targeting activity of themicrotubule-destabilizing trans-resveratrol derivative3,5,4'-trimethoxystilbene[J].MalPharmacol,2005,67(5):1 451-1 459.
[9]Pan MH,Gao JH,LaiCS,etal.Antitumoractivity of3,5,4'-trimethoxystilbene in COLO 205 cells and xenografts in SCID mice[J].Mol Carcinog,2008,47(3):184-196.
[10]Deng YH,Alex D,Huang HQ,etal.Inhibition of TNF- -mediated endothelial cell-monocyte celladhesion and adhesionmolecules expression by the resveratrol derivative,trans-3,5,4'-trimethoxystilbene[J].Phytother Res,2011,25(3):451-457.
