缬沙坦胶囊制备工艺和质量控制研究
2014-05-02危媚
危 媚
(福建生物工程职业技术学院,福建 福州 350002)
缬沙坦作为血管紧张素Ⅱ受体拮抗剂,为新型抗高血压药,对原发性高血压[1]、高血压病[2]及慢性心力衰竭[3]等效果良好,临床应用越来越多。为了让该药更好地服务于与临床,使广大患者获得价廉物美的药品,特进行了缬沙坦胶囊的研发。因缬沙坦胶囊的研发属于已有国家标准药物的注册研究,现按照国家有关技术要求进行研究。
1 仪器与试药
RCZ-6c3型溶出度测定仪(上海黄海药检仪器有限公司);UV-2450型紫外可见分光光度计(岛津公司);GL-25型干法制粒机(开创机械制造有限公司);Agilengt1200型高效液相色谱仪(安捷伦公司);JA2203N型电子天平(上海民桥精密科学仪器有限公司);AL204型电子天平(梅特勒一托利多仪器有限公司)。
缬沙坦原料(药用原料,上海信谊药厂,批号为001115);缬沙坦对照品(中国食品药品检定研究院,批号为100225);缬沙坦胶囊(参比制剂,北京诺华制药有限公司,规格为每粒80 mg);聚乙烯吡咯烷酮(批号为991125),交联聚维酮(批号为03900212134),均为上海昌为医药辅料技术有限公司产品;微晶纤维素(批号为100322),十二烷基硫酸钠(批号为990812),硬脂酸镁(批号为100112),均为安徽山河药用辅料有限公司产品;磷酸二氢钾(批号为99016718);氢氧化钠(批号为99019762);三水合乙酸钠(批号为99018214);乙酸(批号为99000216),均为分析纯,国药集团化学试剂有限公司产品;盐酸(分析纯,开封东大化工有限公司试剂厂,批号为20100106)。
2 方法与结果
2.1 处方前研究
制剂规格确定:缬沙坦国外已上市剂型有胶囊剂,缬沙坦胶囊上市的制剂规格有每粒40,80,160 mg 3种。本研究中确定缬沙坦的研究剂型为胶囊剂,故选择临床最常用的规格即每粒80 mg作为制剂规格。
原料理化特性:缬沙坦原料为白色粉末,质地疏松,流动性不足;筛网粒径,可通过120目筛网;在乙醇中极易溶解,甲醇中易溶,乙酸乙酯中略溶,水中几乎不溶;分子式为C24H29N5O3,相对分子质量为435.52,结构式见图 1。
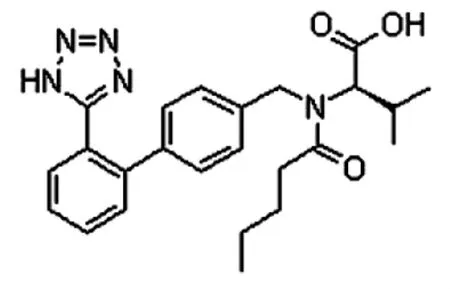
图1 缬沙坦的化学结构式
参比制剂选择[4]:缬沙坦胶囊最初由瑞士诺华(Novartis)公司开发,首先在德国上市;1996年12月获得美国食品药物管理局(FDA)批准,1997年在美国上市,英文名称为 Valsartan Capsules,商品名为DIOVAN®;于1998年在中国获得注册,通用名为缬沙坦胶囊,商品名为代文®。因此将瑞士诺华公司上市,商品名为代文、规格为每粒80mg的缬沙坦胶囊作为参比制剂。
囊壳型号选择:参比制剂的囊壳为2#囊壳,故本研究所用胶囊的囊壳型号为2#囊壳。
2.2 处方研究
处方分析:该处方为瑞士诺华公司上市的缬沙坦胶囊的处方,依据充足。处方中缬沙坦为活性成分,微晶纤维素为填充剂,聚乙烯吡咯烷酮为粘合剂,十二烷基硫酸钠为表面活性剂,交联聚乙烯吡咯烷酮为崩解剂,硬脂酸镁为润滑剂。处方具有合理性。故将该处方作为本研究的胶囊剂的暂定处方,待与样品制备工艺研究结合,对其合理性作进一步验证。
2.3 制备工艺研究
2.3.1 原辅料直混粉末填充工艺
按暂定处方,将原料依次与微晶纤维素、聚乙烯吡咯烷酮、交联聚乙烯吡咯烷酮、十二烷基硫酸钠、硬脂酸镁混合,然后将混合物料过30筛网2次,得混合均匀的胶囊填充前物料。对胶囊填充前物料流动性进行考察,并将所得物料再通过2#胶囊板填充于2#胶囊壳中。结果混合物料流动性指标休止角为54°,20粒胶囊填充量均值为100.5mg。可见,原辅料混合后粉末直接填充工艺不能满足缬沙坦胶囊的制备要求,一是流动性差,二是装量不符合要求。
2.3.2 原辅料制粒混合填充工艺
湿法制粒工艺:按一般湿法制粒工艺制备胶囊,处方量的原料及内加辅料微晶纤维素、聚乙烯吡咯烷酮混合均匀;然后加入含十二烷基硫酸钠水溶液润湿剂适量,搅拌混合制软材;过筛24目筛网制得湿颗粒;在60℃的鼓风烘箱干燥,干燥时间约2 h;过24目筛整粒,得干颗粒;称取外加辅料交联聚乙烯吡咯烷酮、硬脂酸镁,依次加入于干颗粒中,混匀,得胶囊填充前混合物即胶囊内容物;确定填充量,选用2#空心胶囊壳,填充胶囊;得缬沙坦胶囊。工艺考察结果见表1。可见,所得缬沙坦胶囊流动性好,装量符合要求,溶出度与参比制剂基本一致,但有关物质比参比制剂总量大、数量也多。按照国家有关制剂研究技术要求,本研究的缬沙坦胶囊的杂质个数不得多于参比制剂。因此,湿法制粒只能部分满足缬沙坦胶囊的制备要求,仍为不适合制备工艺。

表1 湿法和干法制粒工艺考察结果
干法制粒工艺:按一般干法制粒工艺制备胶囊,处方量的原料及内加辅料微晶纤维素、聚乙烯吡咯烷酮混合均匀;通过干法制粒机,将上述原辅料混合物制成颗粒,然后将外加辅料交联聚乙烯吡咯烷酮、十二烷基硫酸钠、硬脂酸镁,依次加入于颗粒中,混匀,得胶囊填充前混合物即胶囊内容物;确定填充量,选用2#空心胶囊壳,填充胶囊;得缬沙坦胶囊。工艺考察结果见表1。可见,所得缬沙坦胶囊的流动性较好,装量符合要求,溶出度与参比制剂基本一致,且有关物质与参比制剂也基本一致,说明干法制粒工艺满足国家有关制剂研究的技术要求。故选用干法制粒混合填充胶囊。
2.4 质量控制研究
按确定处方和工艺制备3批中试样品,并与参比制剂进行制剂有关特性对比考察。结果见表2、表3及图1。可见,3批中试样品的各项指标与参比制剂基本一致,有关物质接近,在4种介质中的溶出趋势具有良好的相似性。
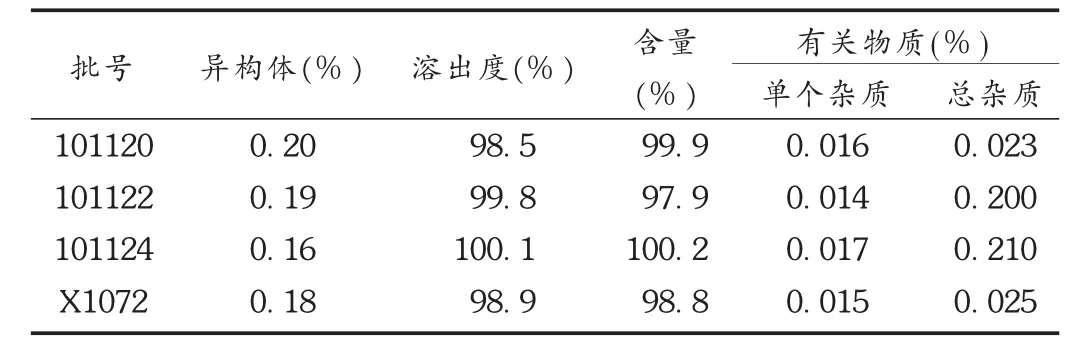
表2 3批中试样品质量考察结果

表3 在不同介质、不同时间取样点样品溶出度测定结果
3 讨论
缬沙坦为一良好的高血压治疗药物,开发研究缬沙坦胶囊,可为国内广大患者提供一种同质价廉的药物。伴随人口老龄化和人口数量的增长,各国政府的医疗费用支出呈逐年上升趋势,带来了一定的经济压力,使得其积极鼓励仿制药进入政府支付范畴,同时大力支持促进仿制药产业的健康、良性化发展[6]。
胶囊剂外观美观、易吞服,可掩盖药物的不良嗅味,并可提高药物稳定性。但胶囊制备并不简便,特别像缬沙坦这类流动性差、受热不稳定的药物,胶囊剂制备不能仅考察其装量和溶出度[7],有关物质的增加需特别加以关注。
本研究中对缬沙坦胶囊的制剂特性进行了对比研究[8],以确保研发的缬沙坦胶囊质量与参比制剂具有一致性,满足生产及临床用药的质量要求。
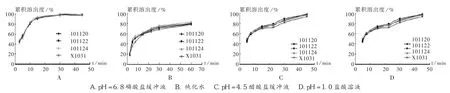
图1 不同介质中样品的溶出度曲线图
参考文献:
[1]田 芳.国产缬沙坦治疗原发性高血压[J].临床医学,2008,28(8):65-67.
[2]邱德龙,段艳锋,赵俊红.缬沙坦胶囊治疗高血压病的疗效观察[J].国际医药卫生导报,2009,15(1):63-65.
[3]张涤非,刘英慧.缬沙坦胶囊治疗慢性心力衰竭的疗效研究[J].中外医疗,2010,25:111.
[4]谢沐风.对参比制剂的确立和品质的客观解读[J].中国医药工业杂志,2014,45(5):495-498.
[5]S·M·甘特尔,R·F·瓦格纳.药物组合物[P].中国:CN 1221256C,2001-06-20.
[6]刘 勇.仿制药的发展[J].黑龙江科技信息,2013,35:22.
[7]王 巍.缬沙坦胶囊处方工艺筛选及溶出度评价[J].生命科学与医药卫生,2013(3 下):75-76.
[8]于大海,苏佳妍.浅谈已有国家标准的化学药品研发的质量控制和技术要求[J],中国药事,2008,22(3):209-212.
