山楂叶总黄酮过饱和自乳化处方中不同脂链长度油相沉淀抑制能力研究
2014-05-01张焕滨欧丽红崔升淼
张焕滨,欧丽红,崔升淼
(广东药学院中药学院,广东 广州 510006)
自乳化给药系统(SEDDS)能显著提高水难溶性药物的溶解度,促进药物的吸收速度和程度,提高药物的生物利用度,还可以减少药物在高浓度水溶液下使用的细胞毒性。但是,由于处方的表面活性剂含量较高,长期服用会产生包括胃肠道刺激、肠膜渗透性变化、细胞毒性等毒副反应,致使其临床应用受到一定限制。过饱和SEDDS可以在传统SEDDS的基础上,进一步增强口服吸收,减少表面活性剂的用量[1]。但口服进入体内后,由于胃肠道溶出环境的改变以及肠道的脂解作用,自乳化体系的过饱和状态可能被打破,致使药物结晶析出,使得溶解状态的药物浓度降低,进而影响药物的吸收。因此,抑制分散过程中过饱和自乳化体系的药物沉淀具有重要意义。目前国内相关的研究多见于添加沉淀抑制剂,如羟丙基甲基纤维素(HPMC)[2],聚乙烯吡咯烷酮(PVP)等[3],较少研究关注自乳化辅料本身的沉淀抑制能力。因此,本实验以山楂叶总黄酮为模型药物,考察过饱和自乳化处方中油相的脂链长度与沉淀抑制能力关系,并对其可能机制进行了研究。
1 材料
1.1 仪器 ME204E电子天平(Mettler Toledo);粒径分析仪(Zetasiter Nano ZS90,英国马尔文公司);紫外分光光度计(UV-2450,日本岛津公司);ZRS-8G智能溶出试验仪(天津天大天发科技有限公司);TDL80-2B台式离心机(上海安亭科学仪器厂);85-2A数显恒温磁力搅拌器、HH数显恒温水浴锅(江苏金坛市金城国胜实验仪器厂);超声波清洗仪(上海生析超声仪器有限公司)。
1.2 药品与试剂 山楂叶总黄酮(山西金甲药业有限公司);芦丁对照品(中国药品生物制品检定所,批号:100080-200707);Labrafil M 1944、Labrafac CC、Capryol 90、Transcutol P、Labrasol、Masin35-1(法国Gattefosse公司);PEG-400(广东光华化学有限公司);正辛酸、油酸、75.0%油酸乙酯(上海鸿海化工有限公司);硝酸铝(天津市津沽工商实业公司);吐温80、亚硝酸钠(天津大茂化学试剂厂);盐酸(广州化学试剂厂);磷酸二氢钾(天津市红岩化学试剂厂);氯化钠、乙醇(天津市百世化工有限公司)。
2 方法与结果
2.1 不同链长油相的过饱和自乳化处方的制备
2.1.1 自乳化处方的筛选和优化 根据前期研究[4],以溶解度、相容性、初步稳定性试验及伪三元相图法筛选处方的油相、表面活性剂和助表面活性剂,并通过星点设计-效应面法对山楂叶总黄酮自乳化处方进行了优化,最终确定处方的组成为吐温80-Transcutol P-油酸乙酯=47∶40∶13。以该山楂叶总黄酮自乳化处方为基础,固定处方的表面活性剂和助表面活性剂及其比例,将处方油相替换为具有一定结构相似性的长链和中链油相,进行下一步考察。
2.1.2 不同脂链长度油相的选择 为了评价山楂叶总黄酮过饱和SEDDS在水性介质分散过程中油相脂链长度与沉淀抑制能力的关系,实验选择了具有一定结构相似性的长链油相和中链油相,见表1,其中Labrafil M 1944、Castor oil和Labrafac CC具有相似的甘油三酯结构;而油酸乙酯和Capryol 90是由相应链长的脂肪酸分别与乙醇和丙二醇组成的脂肪酸酯;正辛酸为饱和的中链脂肪酸。
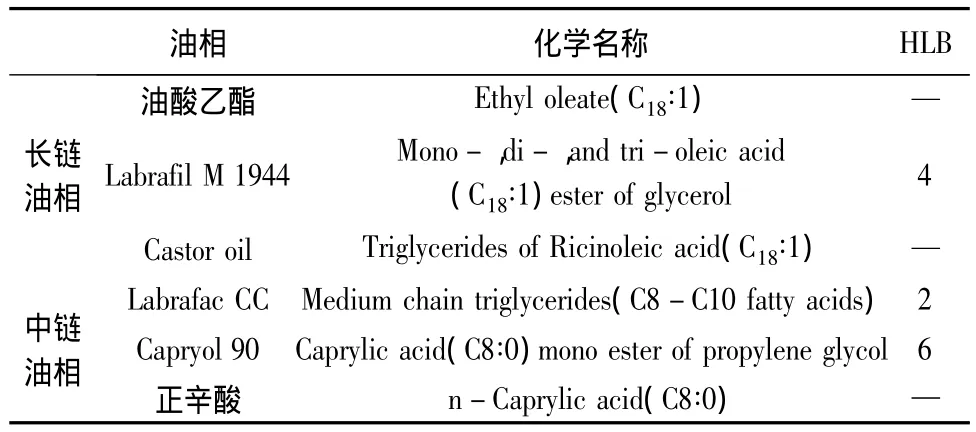
表1 实验选择的中链和长链油相
2.1.3 山楂叶总黄酮过饱和SEDDS的制备 以上述优化处方为基础(吐温80-Transcutol P-油酸乙酯=47∶40∶13),固定处方的比例以及表面活性剂和助表面活性剂的种类,分别将油相替换为等量的油酸乙酯、Labrafil M 1944、Castor oil、Labrafac CC、Capryol 90和正辛酸,制备空白自乳化液各10g,置于小烧杯中充分混匀后,加入过量的山楂叶总黄酮,涡旋分散均匀,37℃水浴平衡48 h,3000 rpm离心10min,取上清液,即得。
2.2 过饱和自乳化处方的沉淀抑制能力评价
2.2.1 载药前后的粒径分布 取不同链长油相的山楂叶总黄酮过饱和SEDDS和空白SEDDS各约1mL,分别加入100mL的纯水、人工胃液(pH 1.2盐酸溶液)、人工肠液(pH 6.8磷酸盐缓冲溶液),磁力搅拌使其乳化完全,取适量乳化液,采用纳米激光粒度仪测定平均粒径和PDI,实验结果见表2。

表2 处方过饱和载药前后的粒径测定结果(n=3)
结果显示:与中链油相相比,长链油相自乳化体系的粒径更小、分布更为集中,且粒径受过饱和载药和溶出介质的影响不明显(P>0.05)。而中链油相自乳化体系的粒径较大、分布较广;除正辛酸自乳化体系外,其余中链油相的自乳化处方过饱和载药后粒径明显增大,且粒径大小受不同溶出介质的影响明显(P<0.05)。实验表明,与中链油相相比,长链油相更有助于山楂叶总黄酮自乳化体系形成粒径小、分布集中的乳液,且形成的自乳化体系更加稳定,粒径受过饱和载药和溶出环境的影响小。
2.2.2 体外溶出 照《中国药典》2010年版(一部)附录Ⅹ C第二法[5],将1.0g不同链长油相的山楂叶总黄酮过饱和自乳化液分别加入到500mL的溶出介质中(纯水、pH 1.2盐酸溶液、pH 6.8磷酸盐缓冲溶液),转速100 rpm,温度为37℃,并分别于5、10、15、20、30、45、60、90min 时取样 5mL,0.45μm水系膜过滤,取滤液4mL,于25mL容量瓶中,分别用各自溶出介质稀释至刻度,紫外-可见光分光光度法测定总黄酮的溶出量,绘制溶出曲线,结果见图1。
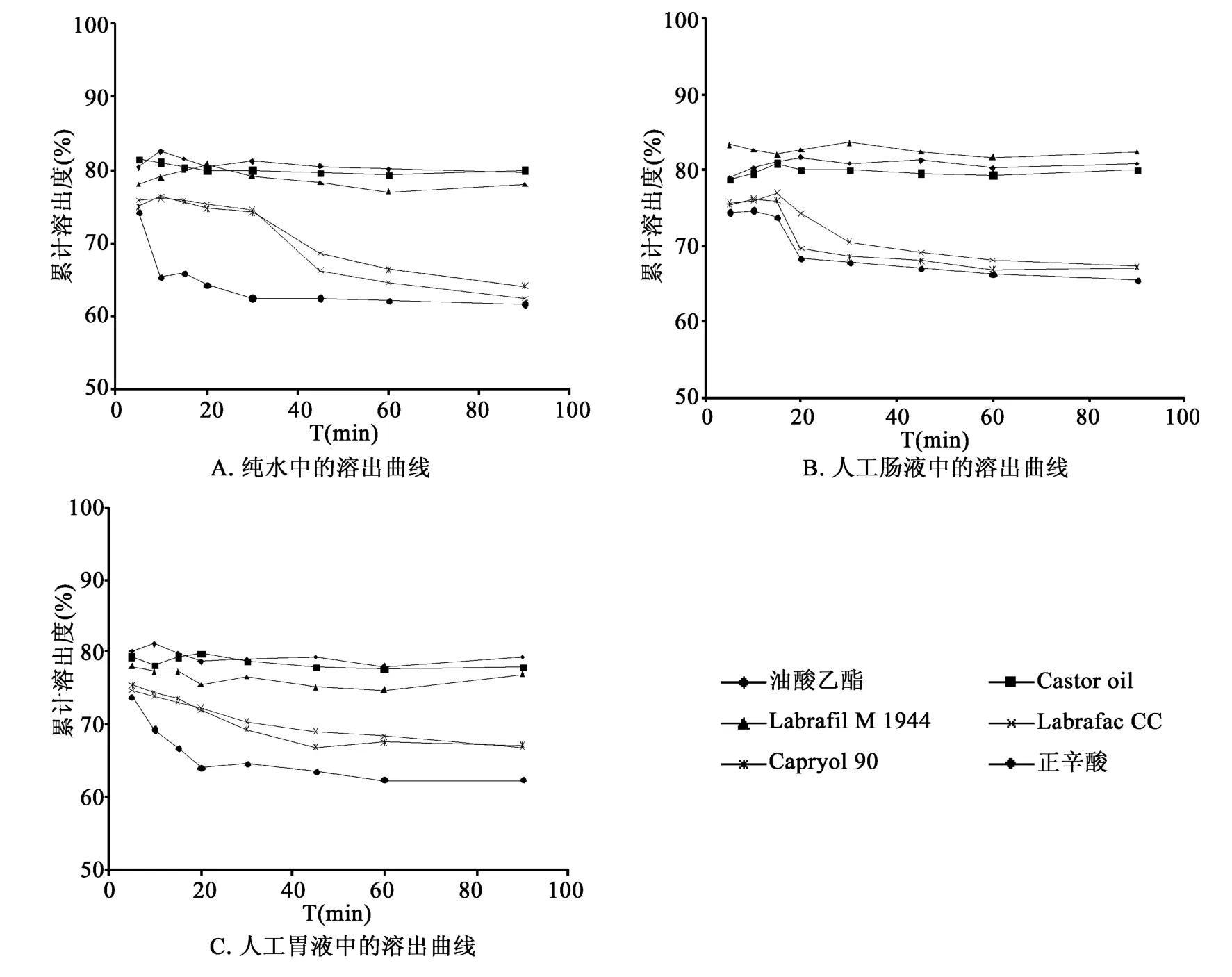
图1 不同油相的过饱和自乳化处方的体外溶出曲线
结果显示:具有相似甘油三酯结构的长链油相Labrafil M 1944、Castor oil与中链油相 Labrafac CC相比,长链油相过饱和SEDDS在各溶出介质中,体外溶出90min内药物的溶出度稳定,基本保持在80%左右。而Labrafac CC的自乳化体系在各溶出介质中,溶出度均于30min左右开始出现较明显的下降,在纯水环境中的下降最明显,5min时药物的溶出度为75.9%,而90min时仅为62.4%。
长链油相油酸乙酯和中链油相Capryol 90是相应链长的脂肪酸分别与乙醇和丙二醇组成的脂肪酸酯。与Capryol 90相比,油酸乙酯自乳化体系90min内的药物溶出度均能维持在80%左右;而Capryol 90的溶出度于30min内开始出现明显下降,90min时的药物溶出度较5min均下降了约10%。正辛酸为饱和的中链脂肪酸,在上述各油相中,其在各溶出介质中的沉淀抑制最弱,药物的溶出度均于20min内出现了显著的下降,其中以纯水中的溶出度下降最为明显,5min时药物的溶出度达到82.3%,而10min时药物的溶出度仅为65.3%,下降了约 17.0%。
实验表明,与长链油相相比,中链油相的沉淀抑制能力较弱,在胃肠道模拟溶出介质的分散过程中,其过饱和状态容易被打破,致使药物在较短时间内析出。而长链油相具有较好的沉淀抑制能力,能较好的抑制药物结晶和维持药物过饱和状态,使得更多的药物分配进入水性分散相而有利于药物的吸收。
2.2.3 粒径变化与沉淀关系 分别于上述溶出试验的 0 h 和 0.5 h 取样,0.45μm 水系膜滤过,取续滤液适量,测定平均粒径,结果见图2。

图2 沉淀产生前后的粒径变化
结果显示,各油相的过饱和自乳化体系在溶出试验沉淀产生前后的粒径大小并没有显著性差异(P>0.05),这提示山楂叶总黄酮过饱和自乳化体系在分散的过程中,药物沉淀的产生与乳液粒径的增大并无必然的联系。
3 讨论
自乳化液口服进入人体后会经历胃肠道溶出环境的改变,在此过程中,药物可能结晶沉淀,使得溶解状态的药物减少,从而降低了其促进吸收的作用。良好的过饱和载药处方在不同的胃肠道环境下要有良好的稳定性,以维持自乳化体系的过饱和状态。本研究发现,山楂叶总黄酮过饱和自乳化体系在体外模拟胃肠道环境的分散过程中,油相的脂链长度会影响自乳化体系的沉淀抑制能力。其中,与中链油相相比,长链油相的沉淀抑制能力更强,可以在较长时间内抑制药物的沉淀结晶,维持较高的药物溶出度,使得更多的药物分配进入水性分散相而有利于药物的吸收。另外,有文献报道[6],短链和中链脂肪酸不易形成乳糜微粒,药物经细胞被动扩散通过肠壁并转运至体循环。而长链脂肪酸和甘油单酯可以在小肠上皮细胞被重新酯化为甘油三酯,并形成乳糜微粒,以胞吐形成从肠细胞进入淋巴管,有助于增强吸收和减小首过效应。
目前关于自乳化体系油相的过饱和维持能力的研究较少,其机制还有待研究。综合相关文献报道,笔者推测,油相脂链长度对自乳化体系沉淀抑制能力的影响可能与微乳界面膜的流动性和稳定性有关。与碳链较短的油相相比,碳链较长的油相有利于嵌入表面活性剂的碳链中间,从而有助于增加微乳界面膜的稳定性;另一方面,随着油相碳链长度的增加,分子骨架的活动性和空间延展性能随着增强,这有助于增强界面膜的流动性。通过增强微乳界面膜的流动性和稳定性,使得乳液的结构稳定性增强,进而有助于自乳化体系过饱和状态的稳定。
另外,实验发现,山楂叶总黄酮自乳化体系沉淀产生前后的乳液粒径并没有明显改变,而多数的文献报道乳化体系沉淀的产生伴随着乳液粒径的增大,这表明自乳化体系沉淀的产生与乳液粒径的增大并没有必然的关系。
[1]Bolko K,Zvonar A,Gašperlin M.Mixed lipid phase SMEDDS as an innovative approach to enhance resveratrol solubility[J].Drug Dev Ind Pharm,2014,40(1):102-108.
[2]Gao P,Guyton ME,Huang T,et al.Enhanced oral bioavailability of a poorly water soluble drug PNU-91325 by supersaturatable formulations[J].D Drug Dev Ind Pharm,2004,30(2):221-229.
[3]Chen ZQ,Liu Y,Zhao JH,et al.Improved oral bioavailability of poorly water-soluble indirubin by a supersaturatable self-microemulsifying drug delivery system[J].Int J Nanomedicine,2012,7:1115-1125.
[4]崔升淼,张慧文,张建,等.山楂叶总黄酮自微乳化释药系统的体内外评价[J].中成药,2012,34(7):1250-1254.
[5]国家药典委员会.中华人民共和国药典2010年版(一部)[S].北京:中国医药科技出版社,2010:372.
[6]Gursov RN,Benita S.Self-emulsifying drug delivery systems(SEDDS)for improved oral delivery of lipophiilic drugs[J].Biomed Pharmacother,2004,58(3):173-182.
