广西扶绥地区黄曲霉毒素B1相关性肝细胞癌蛋白质表达谱分析
2014-04-30黄新飞凌永赤齐鲁楠欧超
黄新飞凌永赤齐鲁楠欧超
作者单位:530021 南宁1广西医科大学附属肿瘤医院肝胆外科;543200 扶绥△广西扶绥县人民医院普通外科;2广西肿瘤防治研究所实验研究部
基础研究
广西扶绥地区黄曲霉毒素B1相关性肝细胞癌蛋白质表达谱分析
黄新飞△凌永赤△齐鲁楠1欧超2
作者单位:530021 南宁1广西医科大学附属肿瘤医院肝胆外科;543200 扶绥△广西扶绥县人民医院普通外科;2广西肿瘤防治研究所实验研究部
目的 研究广西扶绥地区黄曲霉毒素B1(aflatoxin B1,AFB1)相关性肝细胞癌(hepatocellular carcinoma,HCC)的差异蛋白质表达谱,筛选与AFB1暴露相关的肝癌分子标志物,并初步探讨AFB1的致肝癌机制。方法 40例HCC组织按照AFB1的暴露情况分为两个亚组:A组为AFB1暴露组(24例),B组为非AFB1暴露组(16例),同时收集10例来自肝血管瘤、肝外伤、肝移植供体等手术切除的正常肝组织作为正常对照。应用iTRAQ结合2DLC-MS/MS技术分析蛋白质表达谱在各组间的差异。结果 按照组间差异参数ratio>2.0(上调)或ratio<0.5(下调)为筛选标准,两个亚组共鉴定出差异蛋白88种(上调的蛋白51种,下调的蛋白37种),其中50种差异蛋白在两个亚组中均有相同变化趋势,其余38种差异蛋白则存在AFB1暴露的病因学特异性。通过GO注释对筛选出的差异蛋白进行分类分析,88种差异蛋白主要定位于细胞质、细胞核及线粒体,以结合功能和催化功能相关蛋白为主,主要参与毒物代谢调节、应激反应及抗凋亡等生物学过程。结论 本研究筛选出多种与AFB1暴露相关性HCC的差异蛋白,为探讨广西扶绥AFB1高暴露地区的HCC发病机制提供了新的线索。
肝肿瘤;黄曲霉毒素B1;蛋白质组学;iTRAQ技术
肝细胞癌(hepatocellular carcinoma,HCC)是严重危害人类生命健康的恶性肿瘤之一,HCC的发生与多种遗传学因素与环境致病因素有关,并存在地域差异性。例如,在日本和欧美国家,70%以上的HCC发生与慢性丙型肝炎病毒(hepatitis C virus,HCV)感染和酒精高摄入有关[1,2];在我国,大约80%以上的HCC与慢性乙型肝炎病毒(hepatitis B virus,HBV)的高感染率密切相关[3]。此外,以黄曲霉毒素B1(aflatoxin B1,AFB1)为代表的环境致癌物高暴露也是我国HCC高发病率的重要因素。广西扶绥地区是肝癌高发区,高温、潮湿的气候易导致黄曲霉菌的生长和产生毒素,因此环境中AFB1的高暴露成为该地区HCC高发的重要因素之一。本研究拟通过iTRAQ/2D LC-MS/MS定量蛋白质组学技术,分析广西扶绥地区AFB1暴露相关性HCC的差异蛋白质表达谱,初步筛选与AFB1暴露相关的肝癌分子标志物。
1 材料与方法
1.1 一般资料
研究对象均为2010年9月至2013年10月收治的广西扶绥地区肝癌患者的肝肿瘤组织,所有患者均经病理诊断证实为HCC。我们将黄曲霉素B1暴露阳性[AFB1(+)]定义为p53-exon7-249密码子突变阳性伴癌组织中AFB1-DNA加合物免疫组化阳性[4~7]。根据检测结果,40例研究对象按照AFB1的暴露情况分为两个亚组:A组为AFB1暴露组(24例),B组为非AFB1暴露组(16例)。同时收集10例来自肝血管瘤、肝外伤、肝移植供体等手术切除的正常肝组织作为蛋白质组学正常对照组。各组样本之间患者的性别、年龄、肿瘤大小、肝内转移及包膜等临床病理学因素差异均无统计学意义(P>0.05)。所有患者术前均未接受放疗、化疗,均履行告知义务并签署知情同意书。
1.2 主要试剂
iTRAQ试剂盒(八标)购自美国Applied Biosystems公司,AFB1免疫组化6A10单克隆抗体由美国哥伦比亚大学Regina M提供,免疫组化S-P试剂盒购自上海长岛生物科技公司。cDNA逆转录试剂盒购于Fermentas公司,PCR反应体系(2×Taq PCR MasterMix)购于北京天根生化有限公司。其余试剂及仪器均由广西肿瘤防治研究所实验研究部提供。
1.3 AFB1-DNA加合物的免疫组化检查
AFB1-DNA加合物染色步骤参照Regina M.Santella等的方法进行。用已知阳性染色切片作为阳性对照。表达强度评估采用Fromowitz等的方法进行,阳性结果为肝细胞核内出现紫黑色点状颗粒。每张切片以东南西北中高倍镜下5个视野计数,按100%计算,染色≥5%判定为阳性。
1.4 组织细胞DNA的制备
严格按照DNA提取试剂盒(TIANamp Genomic DNA Kit)的说明书提取。采用微量核酸蛋白定量仪检测样品DNA的OD值(A260/A280比值)及计算浓度。并进行琼脂糖凝胶电泳检测DNA的质量。
1.5 p53-exon7-249密码子突变的检测
各取2.0 μl的组织DNA为模板,进行PCR扩增包括外显子的基因片段,采用GenBank提供的p53第七外显子的引物P-333和P-313(上游引物为5′-CTTGCCACAGGTCTCCCCAA-3′,下游引物为 5′-AGGGGTCAGCGGCAAGCAGA-3′)扩增包括p53-exon7-249密码子序列在内的DNA片段,将产物交由北京三博远志生物技术有限责任公司协助完成纯化和测序。利用DNAstar软件将样本测得的p53第七外显子的核苷酸序列与GenBank(gbAF136270.1 HOMOTSP1)中人类p53第七外显子的核苷酸序列(110 bp)一一比对,如NT73~NT75位点上存在AGG--AGT/ AGC的突变,则认为p53第249密码子发生突变。
1.6 组织蛋白的提取
将冻存的肝肿瘤组织在研钵里剪碎并称量,根据重量加入20倍体积(即1 mg肝组织加入20 μl裂解液)的裂解液0.1%SDS(w/v)、0.5 mol/L TEAB(triethylammonium bicarbonate),以及1/50裂解液体积的Complete蛋白酶抑制剂和适量的磁珠,采用多功能样品均质器进行振荡。14 000 r/min、4℃离心45 min,吸取上清液,冻存于-80℃备用。
1.7 iTRAQ标记
①蛋白定量:将所有蛋白用Bradford法进行定量,每组样本混合700 μg(7例×100 μg),将混合后的样品再次用Bradford法进行定量,每组各取100 μg。②还原、封闭:每组各加2 μl TCEP还原剂,60℃孵育1 h;再加入1 μl半胱氨酸封闭试剂,室温10 min。③酶解:向各组蛋白溶液加入5 μl胰酶(0.5 g/L)[1∶40=胰酶∶蛋白(w/w)],37℃孵育过夜(16 h)。④标记:将2支标记试剂经50 μl异丙醇稀释后与相应样品混合(标记试剂118、119分别对应实验组A组和B组,121对应正常对照组),室温放置2 h,各管中加入50 μl去离子水终止反应,混合两组样品,真空离心蒸干。
1.8 强阳离子交换色谱(SCX)分离和质谱分析
将标记后的混合样本溶于SCX缓冲液进行梯度洗脱,再通过装有反相分离柱ZORBAX 300SB-C18 enrichment column的反相液相色谱RPLC进行分离,洗脱出的多肽通过在线连接的QSTAR XL MS/MS质谱仪进行串联质谱分析,MS扫描范围为m/z 350~1 800 u。
1.9 质谱数据分析
采用Protein Pilot Software 3.0(Applied Biosystems)软件对肽段的MS/MS数据进行蛋白质数据库搜索鉴定。鉴定的原始结果经the Pro GroupTM Algorithm(Applied Biosystems)处理后导出。鉴定蛋白所采用的置信度在95%以上,即Protein Pilot软件中Unused ProtScore≥1.3,并且至少有1个肽段与库中的肽段95%以上匹配。组间表达差异大于50%即>2倍或<0.5倍被认为该蛋白质表达存在差异。采用根据Gene Ontology开发的软件Gofact工具对差异蛋白的亚细胞定位、分子功能和生物过程进行分类。
2 结果
2.1 p53-exon7-249密码子突变检测结果
p53-exon7-249的突变多见于第三个核苷酸,突变形式常见为“G-T”或“G-C”两种颠换形式(见图1A-B)。
2.2 AFB1-DNA加合物检测结果
显微镜下观察,AFB1-DNA加合物阳性着色均定位在细胞核内,在良好、清晰的细胞结构背景下,细胞核内出现紫黑色点状颗粒围绕核膜分布者为AFB1-DNA加合物暴露阳性信号,肝细胞核内未出现紫黑色点状颗粒则为阴性信号(见图2A-B)。

图1 A p53基因第249密码子突变(AGG>AGT)

图1 B p53基因第249密码子突变(AGG>AGC)
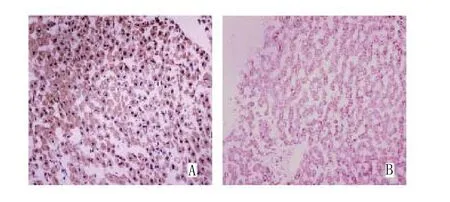
图2 免疫组化及特殊染色法检测HCC组织中AFB1-DNA加合物蛋白的表达(IHG×400)
2.3 质谱鉴定结果
通过iTRAQ结合2DLC-MS/MS进行分析,以正常非瘤肝组织为对照进行相对定量,在两个亚组的组蛋白样品中共同鉴定出蛋白质367种,其中248种有定量信息。按照组间差异参数ratio>2.0(上调)或ratio<0.5(下调)为标准筛选,两个亚组共鉴定出88种差异蛋白(包括51种表达上调的蛋白和37种表达下调的蛋白)。其中50种差异蛋白在两个亚组中均有相同变化趋势,其余38种差异蛋白则存在AFB1暴露的病因学特异性(见表1、表2)。
2.4 GO分类
通过GO注释对筛选出来的差异蛋白进行分类分析,如图3所示。结果发现,鉴定出88种差异蛋白主要定位于细胞质、细胞核以及线粒体(图3-A),以结合功能和催化功能相关蛋白为主(图3-B),主要参与了毒物 代谢调节、应激反应及抗凋亡等生物学过程(图3-C)。

表1 质谱鉴定上调的差异蛋白(51种,ratio>2.0)

(续表)

表2 质谱鉴定下调的差异蛋白(37种,ratio<0.5)

(续表)

图3 差异蛋白生物学功能的GO分类
3 讨论
广西扶绥地区为我国肝癌高发区,其中以AFB1为代表的环境致癌物高暴露是导致该地区肝癌高发的重要因素之一。肝癌的发生、发展是一个多因素共同作用的结果,本研究中我们通过iTRAQ/2D LC-MS/ MS定量蛋白质组学技术研究广西扶绥地区AFB1相关性HCC的差异蛋白质表达谱,共鉴定出88种差异表达蛋白。并采用生物信息学方法分析88种差异蛋白主要参与了毒物代谢调节、应激反应及抗凋亡等生物学过程,提示HCC的发生、发展是一个多基因、多途径参与的复杂过程,同时也表明HCC的发生是一种特异性的全身疾病,而非单纯肝细胞异常增殖性疾病。鉴定出的88种差异蛋白中有50种在两个HCC亚组中均有相同变化趋势,提示它们可能是HCC发生、发展的共性蛋白,而其余38种则可能存在AFB1暴露的病因学特异性。
AFB1为间接致癌物,在体内代谢活化所形成的环氧化物一部分可经机体Ⅱ相代谢酶尤其是谷胱甘肽-S-转移酶(glutathione S-transferases,GSTs)解毒。GSTs是一个多功能的超家族酶类,主要功能是催化多种致癌物的亲电子类物质与谷胱甘肽(GSH)的巯基轭合反应,增加其疏水性以达到解毒的目的。迄今为止,人类细胞质中的GSTs共发现Alpha、Mu、Pi、Theta、Zeta、Sigma和Omega 7种亚型[8],其中GST Alpha亚型是人肝脏里主要的表达形式。本实验结果中AFB1暴露组较非AFB1暴露组GSTA1和GSTO1呈下调趋势,表明在AFB1相关性HCC中GSTs解毒酶基因的表达水平下调,从而使肝细胞对化学致癌物AFB1的解毒能力下降。然而,是什么因素导致了GSTs的失调?Zhou等[9]研究发现HBV-DNA阳性患者癌旁正常肝组织GST的活性明显低于HBV-DNA阴性患者。Jaitovitch-Groisman等[10]发现表达HBx的HepG2细胞株分泌GST的能力减弱,尤其是GST Alpha亚型中的GSTA1,并且对AFB1的致癌效应更敏感,表明在HBV与AFB1协同致癌过程中可能与HBV的表达产物HBx引起GST下调,从而增强AFB1的致癌效应有关。结合我国大约80%以上的HCC与HBV的高感染率密切相关,提示HBV感染能促使GSTs基因表达下调或影响其蛋白活性等,通过影响化学致癌物如AFB1在体内的生物转化,进而增加了AFB1的致肝癌效应。
Peroxiredoxins(Prdxs)家族是一类广泛存在于原核生物和真核生物中的具有过氧化氢酶活性的抗氧化蛋白。研究表明,以AFB1单独诱发树鼩形成的肝癌,发现实验第89~150周肝癌组与实验第45周癌前组相比,Prdx1蛋白表达上调[11]。而惟一的1-Cys Prdx就是Prdx6,它的功能与细胞增殖、分化和凋亡相关。在肝脏中过表达Prdx6与保护细胞免受氧化应激损伤有关,提示其抗氧化功能主要通过还原过氧化的磷脂促进对损伤细胞膜的修复来实现[12,13]。Yoo等[14]研究显示Prdx6蛋白在Huh-7细胞的表达随着药物四羟黄酮浓度的增加而增加。本实验中我们发现,Prdx1在两个亚组中的表达均明显上调,而Prdx6在非AFB1暴露HCC中表达下调,说明Prdx1可能抑制肝癌细胞内大量活性氧诱导的细胞凋亡,促进了肿瘤细胞存活,而Prdx6则阻碍正常肝细胞因活性氧导致DNA等损伤,起到肿瘤抑制作用。最近的两个研究也报道了AFB1暴露的生物标志物与氧化应激的关系[3,15]。由此推测,AFB1长期暴露自身诱导的氧化应激会促进DNA的损伤和突变,进而改变了AFB1的代谢过程以及生物标志物的水平。
α烯醇酶(alpha-enolase,ENO1)作为糖酵解通路的关键酶,在生物界中普遍存在,其表达随细胞病理生理、代谢、发育状况的不同而改变[16]。葡萄糖-6-磷酸异构酶(glucose-6-phosphate isomerase,GPI)存在于各种细胞质内,也是糖酵解的重要酶类,主要功能是催化 6-磷酸葡萄糖和6-磷酸果糖之间的转化。Takashima等[17]通过蛋白质组学分析HCV相关性HCC患者的癌组织发现,ENO1的表达明显上调与肿瘤大小及静脉侵犯呈正相关。Hamaguchi等[18]将有静脉侵犯的HCC组与无静脉侵犯的HCC组相比,发现在14种糖酵解相关基因中有8种能被低氧诱导因子-1α(hypoxia-induible factor-1α,HIF-1α)转录激活而上调表达,其中就包括GPI、ENO1。有研究报道[19],在树鼩感染HBV的基础上喂食AFB1诱发其形成肝癌,发现肝癌组与实验第45周即癌前组相比,α烯醇酶的表达上调。Matoba等[20]的近期研究显示,抑癌基因p53突变可改变肿瘤细胞糖酵解和有氧呼吸平衡。本实验结果发现,GPI、ENO1的表达均在AFB1暴露组中明显上调,提示AFB1暴露下糖酵解代谢更活跃,有利于肿瘤细胞增殖,这可能与AFB1的代谢引起p53基因的第249密码子突变有关。
AKR1B10是细胞质内NADPH依赖的可溶性单体氧化还原酶,属于醛酮还原酶超家族中AKR1B亚家族中的一员。有研究证实烟草特异性的致癌物NNK是AKRlBl0的底物,AKR1B10在NNK相关性非小细胞肺癌中的表达明显增高[21]。在我们前期相关研究也发现,HBV/AFB1双暴露可能通过导致细胞染色体7q33.1畸变或通过氧化应激致AKR1B10基因(C299S)突变等引起AKR1B10高表达参与HBV/AFB1协同致肝癌过程[22~24]。本研究结果与我们前期的研究一致,因此推测AKR1B10的过表达可能参与了AFB1的致癌过程,并有望成为潜在的、有诊疗价值的AFB1相关性HCC分子生物学标志物之一。
本研究筛选出多种与AFB1暴露相关性HCC的差异蛋白,为广西扶绥AFB1高暴露地区HCC发病机制的研究提供了新的线索。但本研究仅为初步研究,且样本量相对较少,我们将在后续的研究中扩大样本量对其差异蛋白进一步验证。
[1] Ahmad J,Eng FJ,Branch AD.HCV and HCC:clinical update and a review of HCC-associated viral mutations in the core gene[J].Semin Liver Dis,2011 Nov,31(4):347-355.
[2] European Association of the Study of the Liver.2011 European Association of the Study of the Liver hepatitis C virus clinical practice guidelines[J].Liver Int,2012,32(Suppl 1):2-8.
[3] Liu ZM,Li LQ,Peng MH,et al.Hepatitis B virus infection contributes to oxidative stress in a population exposed to aflatoxin B1 and high-risk for hepatocellular carcinoma[J].Cancer Lett,2008,263(2):212-222.
[4] Kirk GD,Camus-Randon AM,Mendy M,et al.Ser-249 p53 mutations in plasma DNA of patients with hepatocellular carcinoma from The Gambia[J].J Natl Cancer Inst,2000,92(2):148-153.
[5] Katiyar S,Dash BC,Thakur V,et al.p53 tumor suppressor gene mutations in hepatocellular carcinoma patients in India[J].Cancer,2000,88(7):1565-1573.
[6] Su Q,Schroder CH,Otto G,et al.Overexpression of p53 protein is not directly related to hepatitis Bx protein expression and is associated with neoplastic progression in hepatocellular carcinomas rather than hepatic preneoplasia[J].Mutat Res,2000,462(2-3):365-380.
[7] Staib F,Hussain SP,Hofseth LJ,et al.TP53 and liver carcinogenesis[J]. Hum Mutat,2003,21(3):201-216.
[8] Board PG,Coggan M,Chelvanayagam G,et al.Identification,characterization,and crystal structure of the Omega class glutathione transferases[J].J Biol Chem,2000,275(32):24798-24806.
[9] Zhou T,Evans AA,London WT,et al.Glutathione S-transferase expression in hepatitis B virus-associated human hepatocellular carcinogenesis[J].Cancer Res,1997,57(13):2749-2753.
[10] Jaitovitch-Groisman I,Fotouhi-Ardakani N,Schecter RL,et al. Modulation of glutathione S-transferase alpha by hepatitis B virus and the chemopreventive drug oltipraz[J].J Biol Chem,2000,275(43):33395-33403.
[11] 秦雪,代智,崔杰峰,等,黄曲霉毒素B1诱发树鼩肝癌过程中的差异表达蛋白质分析及意义[J].中华检验医学杂志,2006,29(6):538-542.
[12] Manevich Y,Sweitzer T,Pak JH,et al.1-Cys peroxiredoxin overexpression protects cells against phospholipid peroxidation-mediated membrane damage[J].Proc Natl Acad Sci USA,2002,99(18):11599-11604.
[13] Manevich Y,Fisher AB.Peroxiredoxin 6,a 1-Cys peroxiredoxin,functions in antioxidant defense and lung phospholipid metabolism[J]. Free Radic Biol Med,2005,38(11):1422-1432.
[14] Yoo DR,Jang YH,Jeon YK,et al.Proteomic identification of anticancer proteins in luteolin-treated human hepatoma Huh-7 cells[J]. Cancer Lett,2009,282(1):48-54.
[15] Wu HC,Wang Q,Wang LW,et al.Urinary 8-oxodeoxyguanosine,aflatoxin B1exposure and hepatitis B virus infection and hepatocellular carcinoma in Taiwan[J].Carcinogenesis,2007,28(5):995-999.
[16]McAlister L,Holland M.Targeted deletion of a yeast enolase structural gene.Identification and isolation of yeast enolase isozymes[J]. J Biol Chem,1982,257(12):7181-7188.
[17] Takashima M,Kuramitsu Y,Yokoyama Y,et al.Overexpression of alpha enolase in hepatitis C virus-related hepatocellular carcinoma:association with tumor progression as determined by proteomic analysis[J].Proteomics,2005,5(6):1686-1692.
[18] Hamaguchi T,Iizuka N,Tsunedomi R,et al.Glycolysis module activated by hypoxia-inducible factor 1alpha is related to the aggressive phenotype of hepatocellular carcinoma[J].Int J Oncol,2008,33(4):725-731.
[19]陈晓燕,谢丽,李山,等.黄曲霉毒素B1与乙肝病毒协同诱发树鼩肝癌形成过程中的差异表达蛋白[J].广东医学,2010,31(16):2066-2069.
[20] Matoba S,Kang JG,Patino WD,et al.p53 regulates mitochondrial respiration[J].Science,2006,312(5780):1650-1653.
[21]Fukumoto S,Yamauchi N,Moriguchi H,et al.Overexpression of the aldo-keto reductase family protein AKR1B10 is highly correlated with smokers'non-small cell lung carcinomas[J].Clin Cancer Res,2005,11(5):1776-1785.
[22] Qi LN,Li LQ,Chen YY,et al.Genome-wide and differentialproteomic analysis of hepatitis B virus and aflatoxin B1related hepatocellular carcinoma in Guangxi,China[J].PLoS One,2013,8(12):e83465.
[23]齐鲁楠,白涛,朱海,等.广西地区乙肝病毒/黄曲霉毒素B1相关的肝细胞癌蛋白质表达谱分析[J].中华肝胆外科杂志,2013,19(11):821-826.
[24]齐鲁楠,陈圆圆,陈祖舜,等.广西地区乙肝病毒/黄曲霉毒素B1双暴露相关性肝细胞性肝癌微阵列比较基因组学的研究[J].中国癌症防治杂志,2013,5(3):201-210.
[2014-03-20收稿][2014-05-16修回][编辑 游雪梅]
Proteomic analysis of aflatoxin B1-related hepatocellular carcinoma in the FuSui area of Guangxi,China
HUANG Xin-fei△,LING Yong-chi△,QI Lu-nan1,OU Chao2(1Department of Hepatobiliary Surgery,Affiliated Tumor Hospital of Guangxi Medical University,Nanning 530021,P.R.China;△Department of General Surgery,The People Hospital of Guangxi FuSui,FuSui 543200,P.R.China;2Department of Research,Guangxi Cancer Institute,Nanning 530021,P.R.China)
QI Lu-nan.E-mail:wangzhennuo@aliyun.com
Objective To establish specific molecular marker profiles of aflatoxin B1(AFB1)-related hepatocellular carcinoma(HCC)by comparing protein expression profiles between AFB1-related and non-AFB1-related HCC in the FuSui area of Guangxi. Method A total of 24 patients with AFB1-related HCC and 16 patients with non-AFB1-related HCC group were analyzed by isobaric tagging reagent(iTRAQ)quantitative proteomics together with 2DLC-MS/MS in order to identify differences in protein expression levels. In parallel,normal liver tissue from 10 patients who were liver donors,who had hepatic hemangioma or who had undergone liver resection was analyzed as a control.Results A total of 88 unique proteins were identified that were≥2-fold overexpressed(51 proteins)or≤0.5-fold underexpressed(37 proteins)in AFB1-related HCC tissue relative to control tissue.Of the 88 proteins,50 were expressed at similar levels in AFB1-related HCC and non-AFB1-related HCC tissue,while 38 were associated with pathological features.Based on gene ontology analysis,most of the 88 proteins are predicted to play roles as binding proteins and catalysts.Most are located in the cytoplasm,nucleus or mitochondria,and most are involved in detoxification,drug metabolism and anti-apoptotic pathways.ConclusionsThis study has identified several differentially expressed proteins associated with AFB1-related HCC in the FuSui area of Guangxi,which may provide clues to understanding AFB1-related hepatocarcinogenesis in this part of the world.
Liver neoplasm;Aflatoxin B1;Roteomics;iTRAQ
R735.7
A
1674-5671(2014)03-09
10.3969/j.issn.1674-5671.2014.03.04
广西自然科学基金资助项目(2013GXNSFBA019196)
齐鲁楠。E-mail:wangzhennuo@aliyun.com
