半抗原DNP修饰自体肿瘤疫苗治疗晚期恶性黑色素瘤的临床研究
2014-04-30陈殿君李晓松赵辉付艳胡佳祁楠石秀丽杜楠
陈殿君 李晓松 赵辉 付艳 胡佳 祁楠 石秀丽 杜楠
作者单位:100048 北京 解放军总医院第一附属医院肿瘤二科
临床研究
半抗原DNP修饰自体肿瘤疫苗治疗晚期恶性黑色素瘤的临床研究
陈殿君 李晓松 赵辉 付艳 胡佳 祁楠 石秀丽 杜楠
作者单位:100048 北京 解放军总医院第一附属医院肿瘤二科
目的 探讨半抗原二硝基氟苯(dinitrophenyl,DNP)修饰自体肿瘤疫苗在晚期恶性黑色素瘤治疗中的作用。方法 84例Ⅲ期或Ⅳ期可切除恶性黑色素瘤患者随机分为半抗原DNP修饰瘤苗组和半抗原DNP未修饰瘤苗组,每组42例,分别采用半抗原DNP修饰的自体肿瘤疫苗和半抗原DNP未修饰的自体瘤苗联合化疗进行治疗,采用流式细胞技术检测两组患者外周血CD4+CD25+调节性T细胞(regulatory T cell,Treg)数量及淋巴细胞亚群的变化,观察迟发型超敏反应(delayed type hypersensitivity,DTH)及随访生存情况。结果 治疗后半抗原DNP修饰瘤苗组患者CD4+-IFN-γPE、CD8+-IFN-γPE淋巴细胞亚群较治疗前及半抗原DNP未修饰瘤苗组明显升高(P均<0.05),而CD4+CD25+Treg数量减少(P<0.05),半抗原DNP未修饰瘤苗组治疗前后无明显变化(P>0.05);半抗原DNP修饰瘤苗组患者较半抗原DNP未修饰瘤苗组DTH明显增强,硬结明显增大,两组DTH达到阳性结果(≥5 mm)的百分比分别为94.6%和45.0%(P<0.05)。半抗原DNP修饰瘤苗组患者1年、2年和3年生存率分别为95.0%、73.0%和65.5%,总生存率(overall survival,OS)为79.3%,无疾病生存率(disease free survival,DFS)为81.1%;半抗原DNP未修饰瘤苗组患者1年、2年和3年生存率分别为90.1%、59.0%和43.5%,OS为64.2%,DFS为74.0%,两组患者生存时间差异有统计学意义(P<0.05)。结论 半抗原DNP修饰的自体瘤苗可增强恶性黑色素瘤患者特异性细胞介导的免疫反应,抑制机体免疫耐受,从而延长患者生存时间。
恶性黑色素瘤;二硝基氟苯;半抗原;肿瘤疫苗;免疫治疗
恶性黑色素瘤(简称恶黑)是一种高度恶性、易转移、预后差、对化疗、放疗均不敏感的恶性肿瘤,但却是免疫原性较高的肿瘤,因此近年来肿瘤疫苗及免疫因子治疗恶黑得到了广泛应用[1]。二硝基氟苯(dinitrophenyl,DNP)修饰自体肿瘤疫苗是治疗晚期恶黑的一种新方法。DNP为经典半抗原,可诱发机体产生迟发型超敏反应(delayed type hypersensitivity,DTH)。DTH是一种过敏原诱发的T细胞介导的免疫反应,这些过敏原实际上起到半抗原的作用,从而可用于免疫治疗。而在免疫治疗过程中,调节性T细胞(regulatory T cell,Treg)在免疫抑制反应中扮演着主要角色。Treg细胞可通过抑制CD4+CD25-T细胞和活化的CD8+CTL细胞等效应性T细胞的增殖[2,3],抑制树突状细胞(dendritic cell,DC)的成熟和抗原递呈能力,以及参与多种细胞因子的相互作用来抑制机体抗肿瘤的免疫反应,从而促进了肿瘤细胞的生长和侵袭。而沉默黑色素瘤细胞中Foxp3(forkhead/winged helix transcription factor)称叉状头/翅膀状螺旋转录因子,可使Treg对CD4+CD25-T淋巴细胞增殖抑制的能力减弱,同时减弱抑制性细胞因子的分泌[4],使肿瘤生长减慢。本文回顾性分析84例应用半抗原DNP修饰自体肿瘤疫苗治疗晚期恶黑患者的临床资料,检测外周血液中效应性T细胞及Treg细胞的变化,观察患者免疫功能及临床疗效。
1 材料与方法
1.1 临床资料
2009年2月至2012年3月84例曾在我院治疗的Ⅲ期(Ⅲb期或Ⅲc期)或Ⅳ期可切除的恶黑患者中排除不可切除及资料不完整者。84例随机分为半抗原DNP修饰瘤苗组和半抗原DNP未修饰瘤苗组,每组42例。两组患者的性别、年龄、临床分期及原发灶部位等差异均无统计学意义(P均>0.05)。见表1。入组患者均符合以下条件:⑴病理诊断为恶黑,且免疫组化HMB45(+~++++)、S100(+~++++);⑵肝肾功能及血常规基本正常;⑶Karnofsky评分≥60分;⑷预期生存期>3个月;⑸在每次化疗后7~10 d给予疫苗皮内注射;⑹参照WHO标准客观评价疗效;⑺所有受试者均签署知情同意书,并报医院伦理委员会批准,依从性好,便于随诊。
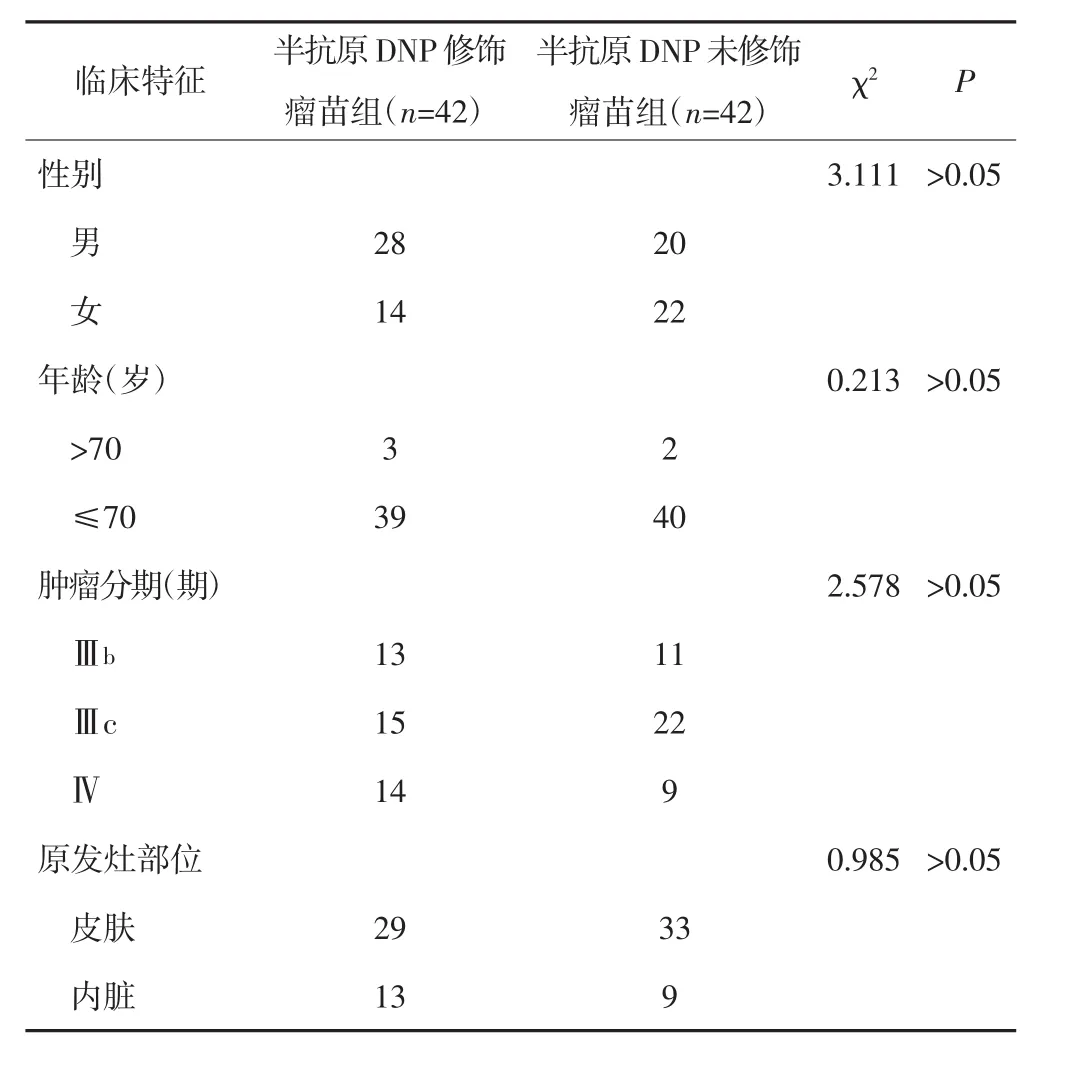
表1 半抗原DNP修饰瘤苗组和半抗原DNP未修饰瘤苗组患者临床特征的比较(n)
1.2 材料
二硝基氟苯购自国药集团化学试剂有限公司,CD8-FITC、CD4-FITC、IFN-PE单克隆抗体和异硫氰酸荧光素(FITC)均购自美国R&D公司,RPMI1640培养液、胶原酶和DNA酶均为Sigma产品,达卡巴嗪及顺铂为南京制药厂生产,卡莫司汀为天津金耀氨基酸有限公司,他莫昔芬为宁波天衡制药有限公司,注射用重组人白细胞介素-2(IL-2)购于辽宁卫星制药厂,干扰素α-2b(IFNα-2b)购自爱先灵宝雅制药有限公司,FACS/Calibur流式细胞仪为美国Becton-Dickinson公司生产,光学显微镜为日本Olympus公司,WD-9405B型水平摇床为北京市六一仪器厂产品。
1.3 方法
1.3.1 肿瘤疫苗的制备[5]手术切除的恶黑组织标本用于自体疫苗的制备。将标本放入生理盐水中,洗涤3次,无菌层流间内将肿块切碎<1 mm3后,放入含有胶原酶和DNA酶的混合液中,37℃下消化2~4 h,以2 000 r/min离心20 min,收集肿瘤细胞,以Hank′s液洗涤3次,锥虫蓝拒染实验,使活细胞达80%以上。为了确保黑色素瘤细胞后代,采用免疫染色方法,分别用兔抗-S100多克隆抗体,A-103和HMB-45单克隆抗体评估S-100、MART-1和gp100的表达,需要至少一种抗体阳性染色>50%。分别应用抗-HLAI类和抗-HLAII类单克隆抗体W6/32和CR3/43确定肿瘤细胞主要组织相容性复合物(major histocompatibility complex,MHC)的表达。将筛选后的细胞加入冻存剂,-80℃低温冰箱冷冻或液氮冻存备用。取冻存的细胞,37℃快速复苏,以含10%人AB血型血清的RPMI1640培养液洗涤2次,悬浮于生理盐水中,每次取细胞(1~5)×106个/ml加入6孔板中,再加0.2%DNP溶液100 μl,培养24 h,然后经60Co照射30 Gy,以灭活细胞,备用。
1.3.2 化学治疗 达卡巴嗪(DTIC)200 mg/m2,d1~ d4;顺铂(PDD)30 mg/m2,d1~d3;卡莫司汀(BCNU)125 mg/m2,d1~d2;他莫昔芬20 mg/m2,d1-d7。21 d重复1次为1个周期,最多行6个周期治疗。生物治疗以IL-2和IFNα-2b为主:IL-2 200万~400万单位,静滴;IFNα-2b 300万~600万单位,皮下注射,以上两药隔日交替应用,6~8周为1个疗程。每个化疗周期结束后2~4d静脉或局部给予DC(2~5)×106个细胞,同时取1 ml瘤苗,加入卡介苗0.1 ml(50 TU/ml),在上臂三角肌处3个邻近点皮内注射,共注射6~8次。
1.3.3 细胞分离及检测 分别于半抗原DNP修饰的及半抗原DNP未修饰的肿瘤疫苗治疗前2 d和每次瘤苗治疗后1周(共6次),采集患者外周静脉血液(抗凝),离心分离单个核细胞,分离外周血淋巴细胞,对外周血淋巴细胞分别行CD4-FITC、CD8-FITC、IFN-γPE单抗标记,进行荧光激活细胞分选术(flurescence activated cell sorting,FACS)检测;取患者外周血加肝素抗凝,加入CD4-PE和CD25-FITC单克隆抗体,室温避光30 min,裂解,PBS冲洗,离心5 min(1 500 r/min),弃去上清液;每份标本加入1%多聚甲醛500 μl,用流式细胞仪检测CD4+CD25+Treg数量的变化。
1.3.4 DTH反应的测定 为评估自体肿瘤细胞抗原的特异性DTH,分别于半抗原DNP修饰或半抗原DNP未修饰的肿瘤疫苗治疗前2 d及每次瘤苗治疗后1周(共6次),在患者上肢三角肌处皮内注射瘤苗,观察48 h后,通过触诊确定每个反应硬块的边界[6],用食指腹面触摸边界大小,每个边缘用钢笔标记,每次阳性结果之间距离用二色钢笔检测,直径≥5 mm判定为阳性反应,直径≥15 mm为强阳性。评估对自体肿瘤细胞抗原的特异性DTH,以PPD(50 TU/m1)作为非特异性对照,测量注射后红斑及硬结大小(mm)。
1.4 随访
通过门诊就诊及电话或随访信函的方式进行随访。实施半抗原DNP修饰肿瘤疫苗治疗的患者,每3~6个月对浅表淋巴结行B超、胸腹部CT扫描或PET检查,了解肿瘤有无转移或复发。截至2013年3月,除3例患者失访外,余81例患者均随访3年以上,中位随访时间为40个月,失访率为3.6%。
1.5 统计学处理
采用SPSS 16.0软件进行统计学分析。采用Kaplan-Meier法计算生存率,两组计量资料的比较用t检验,计数资料的比较用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 瘤苗治疗前后恶黑患者外周血液CD8+和CD4+细胞的变化
84例Ⅲ期或Ⅳ期恶黑患者化疗后联合半抗原瘤苗治疗,在治疗前后,对外周血淋巴细胞分别用CD8-FITC、CD4-FITC、IFN-γPE单抗标记,并用流式细胞术检测。结果显示治疗后半抗原DNP修饰瘤苗组患者CD4+-IFN-γPE、CD8+-IFN-γPE均较治疗前及半抗原DNP未修饰瘤苗组明显升高,差异均有统计学意义(P均<0.05);而半抗原DNP未修饰瘤苗组患者治疗前后两者变化不显著,差异无统计学意义(P>0.05)。见表2。再次验证了经半抗原DNP修饰瘤苗治疗后,可激发机体特异性细胞介导的免疫反应,与之前临床研究结果相同[7]。
表2 恶黑患者瘤苗治疗前后外周血液CD4+-IFN-γPECD8+-IFN-γPE淋巴细胞亚群的变化(±s,%)

表2 恶黑患者瘤苗治疗前后外周血液CD4+-IFN-γPECD8+-IFN-γPE淋巴细胞亚群的变化(±s,%)
分别与半抗原DNP未修饰瘤苗组比较,*P均<0.05。
组别 治疗前 治疗后 t P半抗原DNP修饰瘤苖组CD4+-IFN-γPE5.01±0.76 9.42±1.94*19.399 <0.05 CD8+-IFN-γPE3.88±1.51 10.22±2.93*17.628 <0.05半抗原DNP未修饰瘤苖组CD4+-IFN-γPE5.12±1.11 5.54±1.36 2.193 >0.05 CD8+-IFN-γPE3.61±1.23 5.43±0.89 10.987 >0.05
2.2 流式细胞术检测恶黑患者治疗前后外周血液CD4+CD25+Treg数量的变化
取84例中晚期恶黑患者治疗前后外周血液,通过流式细胞术检测CD4+CD25+Treg数量的变化。结果显示半抗原DNP修饰瘤苗组患者治疗后CD4+CD25+Treg数量较治疗前明显减少,差异有统计学意义(P<0.05);而半抗原DNP未修饰瘤苗组患者治疗前后变化不显著,差异无统计学意义(P>0.05)。见表3。
2.3 恶黑患者瘤苗治疗前后DTH反应的评估
84例Ⅲ期或Ⅳ期恶黑患者接种瘤苗治疗前后,半抗原DNP修饰瘤苗组和半抗原DNP未修饰瘤苗组患者均可发生DTH反应,但半抗原DNP修饰瘤苗组患者治疗后硬结较半抗原DNP未修饰瘤苗组明显增大,两组达到阳性结果(≥5 mm)的百分比分别为94.6%和45.0%(P<0.05)。与以前研究结果[7]相似,提示半抗原DNP修饰瘤苗明显提高机体对特异性肿瘤原性反应。见表4。
2.4 疗效随访
在整个治疗过程中,所有患者毒副反应温和,耐受性良好,对生活质量影响较小,无严重毒性反应发生。随访3年,32例患者生存时间超过36个月(目前仍健在),其中半抗原DNP修饰瘤苗组22例患者生存时间超过30个月,其中仅4例DTH阳性;半抗原DNP未修饰瘤苗组10例患者生存时间超过30个月,8例DTH阳性,其中1例因肺转移、2例因肝转移和2例因脑转移而死亡。半抗原DNP修饰瘤苗组患者1年、2年、3年生存率分别为95.0%、73.0%和65.5%,总生存率(overall survival rete,OS)为79.3%,无疾病生存率(disease free survival,DFS)为81.1%;半抗原DNP未修饰瘤苗组患者1年、2年、3年生存率分别为90.1%、59.0%和43.5%,OS为64.2%,DFS为74.0%,两组患者生存时间差异有统计学意义(P<0.05)。见图1、图2。
表3 恶黑患者瘤苗治疗前后外周血液CD4+CD25+Treg数量的变化(±s,%)
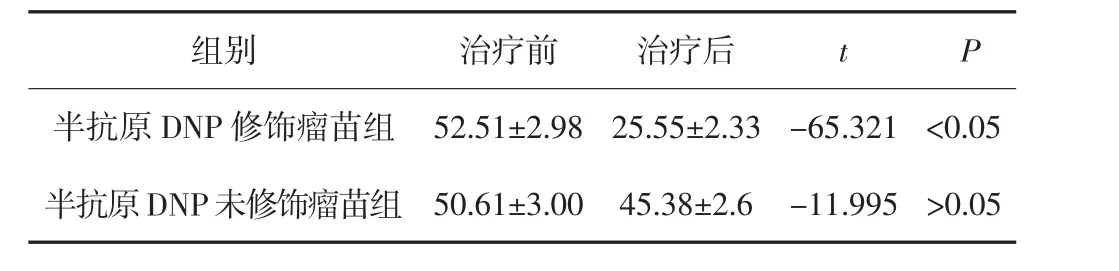
表3 恶黑患者瘤苗治疗前后外周血液CD4+CD25+Treg数量的变化(±s,%)
组别 治疗前 治疗后 t P半抗原DNP修饰瘤苗组 52.51±2.98 25.55±2.33 -65.321 <0.05半抗原DNP未修饰瘤苗组 50.61±3.00 45.38±2.6 -11.995 >0.05
表4 恶黑患者瘤苗治疗前后DTH反应的比较(±s)

表4 恶黑患者瘤苗治疗前后DTH反应的比较(±s)
与半抗原DNP未修饰瘤苗组比较,χ2=9.224,*P<0.05。
硬结直径(mm)组别 硬结阳性率(%)治疗前 治疗后半抗原DNP修饰瘤苗组 6.5±0.8 22.1±2.4 94.6*半抗原DNP未修饰瘤苗组 5.0±1.2 10.4±1.9 45.0
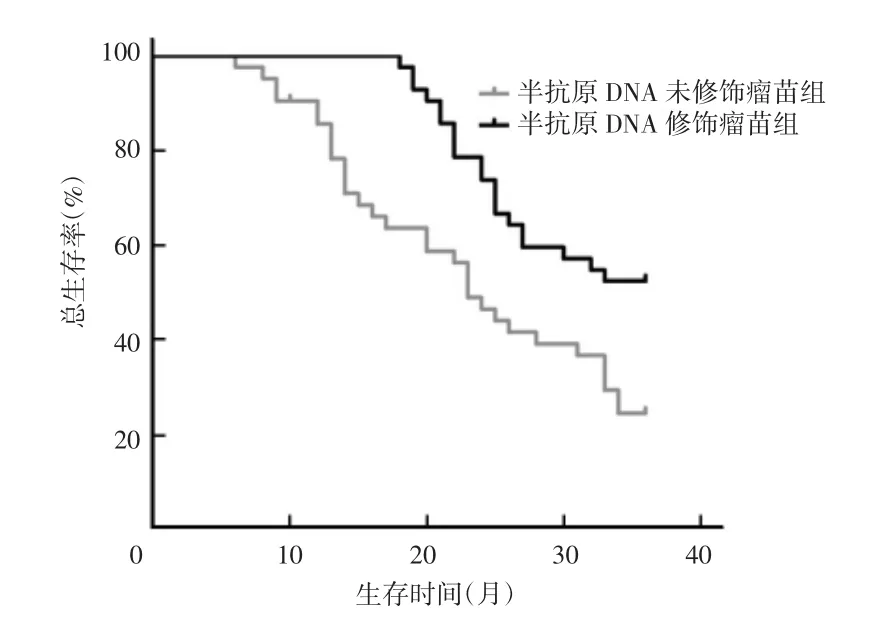
图1 84例恶黑患者总生存率的曲线

图2 84例恶黑患者无疾病生存率的曲线
3 讨论
恶性黑色素瘤为高度恶性肿瘤,病死率较高,Ⅲ期及Ⅳ期恶黑患者预后极差。有淋巴结转移的患者(Ⅲ期)2年总生存率为29%~38%,中位无疾病生存期为12个月,有远处转移者生存期更短。进展期患者中位生存期仅2~8个月,5年生存率不足5%[8]。目前对该肿瘤系统性化疗的认识并不一致,有报道结合白细胞介素-2、干扰素和化疗制剂可以产生高达64%的反应率,然而转移性恶黑的系统性治疗结果仍然令人失望,目前的化疗方案不能明显提高中位生存期,对于大多数单一药物的临床反应率低于15%。在前瞻性随机试验中没有证据表明其他化学药物治疗更优于达卡巴嗪。因此需要改变治疗策略来提高转移性恶黑患者的预后。
DTH是一种过敏原诱发的T细胞介导的免疫反应,这些过敏原实际上起到半抗原的作用。DNP等是最早用于研究接触性DTH的经典的半抗原,其具有原发性、刺激性及较强抗原性。在正常皮肤上易被吸收,对于正常人群与在细胞免疫正常情况下,都可诱发皮肤迟发型变态反应。故可以测定人体的细胞免疫力,同时多次诱发此种变态反应,可增强人体的细胞免疫力。Manne等[9]研究发现DNP半抗原与MHC附着的多肽(抗原)相结合对于形成免疫原性是非常重要的步骤。由于肿瘤抗原分子表达许多分子,DNP修饰的细胞将产生大量半抗原诱发的蛋白,经过APC(包括DC)加工,与MHCⅠ类和Ⅱ类分子形成复合物,在细胞表面产生巨大的沟槽,大大增加了与T细胞反应的结合位点。因此,半抗原系统能够有效地诱发肿瘤特异性免疫反应。2007年Terheyden等[10]用二硝基氯苯(dinitrochlorobenzene,DNCB)致接触性皮炎联合化疗药物DTIC治疗转移性黑色素瘤,结果显示Ⅲ期患者(n=39)的客观反应率为62%,而Ⅳ期患者(n=33)的客观反应率仅为9%,有趣的是,无论处于疾病的哪个阶段,一半以上的患者保持疾病无进展超过1年,提示DNCB联合DTIC对于不适合手术或肢体分离灌注的区域转移的恶性黑色素瘤患者有效。Ridolfi等[11]应用DCs疫苗诱发DTH对27例Ⅳ期恶黑患者进行研究,DTH阳性患者(19例)的中位生存期为22.9个月,DTH阴性患者的中位生存期为4.8个月,总中位生存期为16个月,该结果显示DTH阳性率与提高生存期呈高度相关性。有研究认为[12],皮肤DTH可以作为该免疫疗法的观察指标。
本研究通过分析84例曾在我院治疗的Ⅲ期(Ⅲb期或Ⅲc期)或Ⅳ期可切除恶黑患者临床资料,探讨半抗原DNP修饰自体肿瘤疫苗在晚期恶性黑色素瘤治疗中的作用。治疗后分析发现,半抗原DNP修饰瘤苗组患者CD4+-IFN-γPE、CD8+-IFN-γPE淋巴细胞亚群较治疗前及未修饰瘤苗组明显升高(P<0.05),且DTH反应强度与CD8+-IFN-γPE双阳性细胞比例的升高呈现一致性[13]。半抗原DNP修饰瘤苗组患者外周血液中CD4+CD25+Treg数量较治疗前及未修饰瘤苗组有所减少(P<0.05)。Treg是目前公认的调节人体免疫耐受的细胞,在免疫抑制反应中扮演着主要角色,对维持机体免疫耐受和免疫应答稳态具有非常重要的意义。虽然目前对上述结果的机制尚未明确,但可能与患者免疫力增强而免疫耐受作用相对减弱有关。半抗原DNP修饰瘤苗组患者的OS及DFS明显优于半抗原DNP未修饰瘤苗组。其结果与我科先前的研究[7]相似,再次证明DNP修饰的自体肿瘤疫苗对增强宿主特异性迟发型变态反应、活化抗原提呈细胞、增强CTL活性,从而引起强大的免疫反应抑制免疫耐受的形成有重要作用。因此,恶黑患者经半抗原DNP修饰的身体肿瘤疫苗治疗可使特异性细胞免疫功能增强,可能在杀灭残留癌细胞、阻抑肿瘤复发和提高远期疗效有一定作用,有望成为治疗恶黑患者的重要手段。
[1] 杜楠,李留树,肖文华,等.恶性黑色素瘤生物化疗的临床研究初探[J].解放军医学杂志,2007,32(3):253-255.
[2] Wolf AM,Wolf D,Steurer M,et al.Increase of regulatory T cell in the peripheral blood of cancer patients[J].Clin Cancer Res,2003,9(2):606-612.
[3] Read S,Malmstrøm V,Powrie F.Cytotoxic T lymphocyte-associated antigen 4 plays an essential role in the function of CD25(+)CD4(+)regulatory cells that control intestinal inflammation[J].J Exp Med,2000,192(2):295-302.
[4] 陈殿君,李晓松,赵晖,等.慢病毒介导RNA抑制黑素瘤细胞Foxp3蛋白表达[J].细胞与分子免疫学杂志,2012,28(4):337-339.
[5] 杜楠,李留树,肖文华,等.半抗原修饰的黑素瘤细胞激活树突状细胞诱导特异性T细胞反应[J].中国肿瘤生物治疗杂志,2006,13(3):221-223.
[6] Berd D.M-Vax:an autologous,hapten-modified vaccine for human cancer[J].Expert Ret Vaccines,2004,3(5):521-527.
[7] 杜楠,王希良,宋林萍,等.半抗原DNP修饰自体肿瘤疫苗治疗恶性黑素瘤[J].中国肿瘤生物治疗杂志,2007,14(5):487-489.
[8] Toker A,Yoeli-Lerner M.Akt Signaling and cancer:surviving but not moving on[J].Cancer Res,2006,66(8):3963-3966.
[9] Manne J,Mastrangelo MJ,Sato T,et al.TCR rearrangement in lymphocytes infiltrating melanoma metastases after administration of autologous dinitrophen-ylmodified vaccine[J].J Immunol,2002,169(6):3407-3412.
[10]Terheyden P,Kortüm AK,Schulze HJ,et al.Chemoimmunotherapy for cutaneous melanoma with dacarbazine and epifocal contact sensitizers:results of a nationwide survey of the German Dermatologic Cooperative Oncology Group[J].J Cancer Res Clin Oncol,2007,133(7):437-444.
[11]Ridolfi L,Petrini M,Fiammenghi L,et al.Dendritic cell-based vaccine in advanced melanoma:update of clinical outcome[J].Melanoma Res,2011,21(6):524-529
[12]Quilien V,Lesimple T,Toujas L.Vaccinal cell therapy in melanoma[J]. Bull Cancer,2003,90(8-9):722-733.
[13]Kumamoto T,Huang EK,Pack HJ,et al.Induction of tumor-specific protective immunity by in situ langerhans cell vaccine[J].Nat Biotechnol,2002,20(1):64-69.
[2014-04-23收稿][2014-08-02修回][编辑 阮萃才]
Clinical study of dinitrophenyl-modified autologous tumor vaccine to treat advanced malignant melanoma
CHEN Dian-jun,LI Xiao-song,ZHAO Hui,FU Yan,HU Jia,QI Nan,SHI Xiu-li,DU Nan(The Second Department of Oncology,The First Affiliated Hospital of Chinese PLA General Hospital,Beijing 100048,P.R.China)
DU Nan.E-mail:dunan05@aliyun.com
Objective To investigate the efficacy of autologous tumor vaccine modified to carry the dinitrophenyl hapten to treat advanced malignant melanoma.Methods Clinical data were retrospectively analyzed for 84 patients who underwent resection for stageⅢb,Ⅲc or IV malignant melanomas.Patients were divided into two groups depending on whether or not their biochemotherapy was supplemented with dinitrophenyl-modified autologous tumor vaccine.The two groups were compared in terms of the following parameters:relative numbers of CD4+CD25+regulatory T cells and lymphocyte subsets in peripheral blood,which were determined using flow cytometry;observed strength of delayed type hypersensitivity(DTH);and clinical outcomes such as overall survival(OS)and disease-free survival(DFS).Results The subpopulations of CD4+-IFN-γPEand CD8+-IFN-γPElymphocytes were significantly larger in the vaccinated patients than in the biochemotherapy-only patients(P<0.05),while the relative proportions of CD4+CD25+regulatory Tcells were significantly smaller(P<0.05).DTH-positive response(defined as spot size≥5 mm)occurred in 94.6%of vaccinated patients but in only 45%of biochemotherapy-only patients(P<0.05).The 1-,2-and 3-year survival rate were 95.0%,73.0 and 65.5%in the vaccinated group,respectively,90.1%,59.0%and 43.5%in the biochemotherapy-only group,respectively.OS and DFS in the vaccinated group were 79.3%and 81.1%,compared to 64.2%and 81.1%in the biochemotherapy-only group.The difference in OS between the two groups was significant(P<0.05).Conclusion Administering autologous tumor vaccine modified with the dinitrophenyl hapten may increase the overall survival of patients with specific cell-mediated melanoma,and it appears to do so by enhancing their immune response and inhibiting immune tolerance.
Melanoma;Dinitrophenyl;Hapten;Tumor vaccine;Immunotherapy
R739.5
A
1674-5671(2014)03-06
10.3969/j.issn.1674-5671.2014.03.06
国家自然科学基金资助青年项目(NO.81000994);首都临床特色应用研究课题(Z131107002213040)
杜楠。E-mail:dunan05@aliyun.com
