经皮经肝肝内门体分流术的手术方法与临床应用
2014-04-30李名安姜在波单鸿周斌张有用王皓帆黄明声钱结胜关守海
李名安 姜在波 单鸿 周斌 张有用 王皓帆 黄明声 钱结胜 关守海
·综合介入·
经皮经肝肝内门体分流术的手术方法与临床应用
李名安 姜在波 单鸿 周斌 张有用 王皓帆 黄明声 钱结胜 关守海
目的 介绍经皮经肝肝内门体分流术(PTIPS)的手术方法及围术期情况。方法2009年11月—2013年3月,76例门静脉高压患者接受经门静脉右支PTIPS,临床表现为消化道出血69例(其中23例合并不同程度腹腔积液),单纯性顽固性腹腔积液7例。术前肝功能Child-Pugh A级23例,B级35例,C级18例。上腹部CT/MRI显示34例肝脏重度萎缩,肝裂明显增宽;25例伴门静脉血栓/癌栓形成合并门静脉海绵样变性。经皮成功穿刺门静脉右下分支后,沿同一穿刺道经门静脉“逆行”穿刺肝静脉或肝段下腔静脉,建立肝内门体分流道。结果76例患者PTIPS成功率100%。门静脉压差由术前(32.35±2.89)mmHg降至术后(18.42±1.32)mmHg(P<0.001)。2例患者发生腹腔出血,栓塞相应肝动脉后治愈。1例肝功能C级患者术后5天因肝衰竭死亡,余75例患者术后1个月内门脉高压症状消失。结论PTIPS是传统经颈静脉肝内门体分流术(TIPS)的补充,是一种安全、有效的治疗方法,手术成功率高,大大拓展了介入性门体分流术的应用范围。
高血压,门静脉;经皮经肝;门体分流术;放射学,介入性
经颈静脉肝内门体分流术(transjugular intrahepatic portosystemic shunt, TIPS)已成为门静脉高压性食管胃底静脉曲张破裂出血及顽固性腹腔积液的主要治疗方法之一,广泛应用于临床[1-6]。其对消化道出血控制率为89%~100%,腹腔积液缓解率亦超过80%[7-11]。然而,术中穿刺出血是传统TIPS最常见、最严重的并发症,尤其对于合并严重肝硬化、肝萎缩、凝血功能障碍的患者,穿刺出血的风险更大。另外,对于门静脉血栓闭塞、门静脉海绵样变性的患者,因技术难度高及手术风险大,曾被认为是传统TIPS的禁忌证[12]。为了解决这一临床难题,近年来,我们通过改变穿刺入路,利用细针经门静脉“逆行”穿刺肝静脉或肝段下腔静脉,完成肝内门体分流术,即经皮经肝肝内门体分流术(percutaneous transhepatic intrahepatic portosystemic shunt,PTIPS),已取得技术上的成功并应用于临床[13]。现将经门静脉右支行PTIPS的技术方案及临床应用情况总结如下。
对象与方法
1.临床资料:2009年11月~2013年3月,中山大学附属第三医院介入血管科共76例不同类型门静脉高压患者接受经门静脉右支穿刺入路PTIPS。男性63例,女性13例,年龄26~74岁,中位年龄47岁。临床表现为食管胃底静脉曲张出血69例(其中23例合并不同程度腹腔积液),单纯性顽固性腹腔积液7例。术前原发疾病包括:失代偿期肝硬化64例(其中15例为脾切除术后),原发性肝癌6例,巴德-基亚里综合征3例,腹部手术后2例,肝移植术后1例。术前上腹部CT/MRI显示34例患者肝脏重度萎缩,肝裂明显增宽,门静脉分叉部位于肝实质外;25例伴有门静脉系统血栓/癌栓形成及不同程度门静脉海绵样变性。患者术前肝功能Child-Pugh A级23例,B级35例,C级18例,部分凝血酶原时间(PT)为(17.25±0.37)s。
2.术前准备:所有患者术前常规行上腹部CT/ MRI增强扫描并进行多平面重建,了解肝脏形态、肝内外门静脉、肠系膜上静脉及脾静脉情况、门静脉、肝静脉及下腔静脉之间空间解剖关系,以确定最佳穿刺路线及分流道建立途径。术前向患者及其家属告知手术风险,并签署手术知情同意书,肌内注射哌替啶75~100 mg镇痛,并静脉滴注广谱抗生素预防感染。
3.技术思路:在肝内门静脉和肝静脉为交叉走行,通过技术手段把两条静脉联通即为门体分流。相比经颈静脉途径穿刺门静脉,经皮经肝穿刺门静脉难度小、成功率高,通过门静脉穿刺肝静脉或下腔静脉路径短,容易操控。基于此技术思路,我们在学习了国内外改良TIPS技术后,设计了PTIPS手术方案。
4.手术过程:手术在透视引导下完成,具体操作过程如下。①采用22G Chiba针穿刺门静脉右下分支(第5或6段分支),置入鞘管、导管并行门静脉造影。②穿刺右侧颈内静脉,置入长鞘至肝右、肝中静脉或肝段下腔静脉,造影并留置定位。③以直径20G、改良的Chiba针做为PTIPS穿刺针,导丝引导下沿鞘管送入门脉右支,根据肝静脉(或肝段下腔静脉)定位鞘管的位置,调整穿刺针角度,从肝内门静脉“逆行”向上穿刺肝静脉或肝段下腔静脉,成功后经穿刺针引入0.018 inch导丝至上腔静脉并交换为0.035 inch超滑导丝,以捉捕器将导丝经颈静脉鞘管引出体外。④以直径6 mm球囊扩张肝实质分流道后,将长鞘推送至门静脉右支管腔内,在导丝、导管的配合下,使其进入肠系膜上静脉建立工作通道。⑤引入0.035 inch、260 cm超硬导丝为工作导丝,沿工作导丝以8 mm球囊进一步扩张分流道,随后在分流道内置入直径为8~10 mm自膨胀式支架。支架植入后推注3000 U肝素。⑥对于食道胃底静脉曲张明显的患者,以NBCA胶和(或)弹簧圈给予栓塞。为预防穿刺道出血,采用NBCA胶或弹簧圈进行栓塞。对于门静脉狭窄闭塞的患者,先以6 mm直径球囊扩张再进行后续操作(图1-8)。
5.围术期处理:术后每隔1~2天复查红细胞计数(RBC)、血红蛋白量(Hb)、凝血功能、D-二聚体、肝功能、肾功能、血氨水平直至出院。为预防支架内血栓形成,术后给予抗凝治疗,在排除出血的情况下,术后第二天始给予抗凝治疗,前3天给予低分子肝素(速碧林,4000 U/12 h)皮下注射,后改为长期服用华法林,药物剂量根据凝血功能结果调整,控制PT为正常值的1.5倍左右,PT-INR值2.0左右,服药时间至少半年。对于脾切除术后合并血小板升高的患者,同时口服阿司匹林(0.1 g/d)抑制血小板聚集。
结果
1.手术结果:76例患者PTIPS均获得成功,技术成功率100%。肝内分流道建立于肝段下腔静脉与门静脉右支之间19例,肝右静脉与门静脉右支之间23例,肝中静脉与门静脉右支之间34例。患者门静脉压差由术前(32.35±2.89)mmHg降至术后(18.42±1.32)mmHg(P<0.001)。
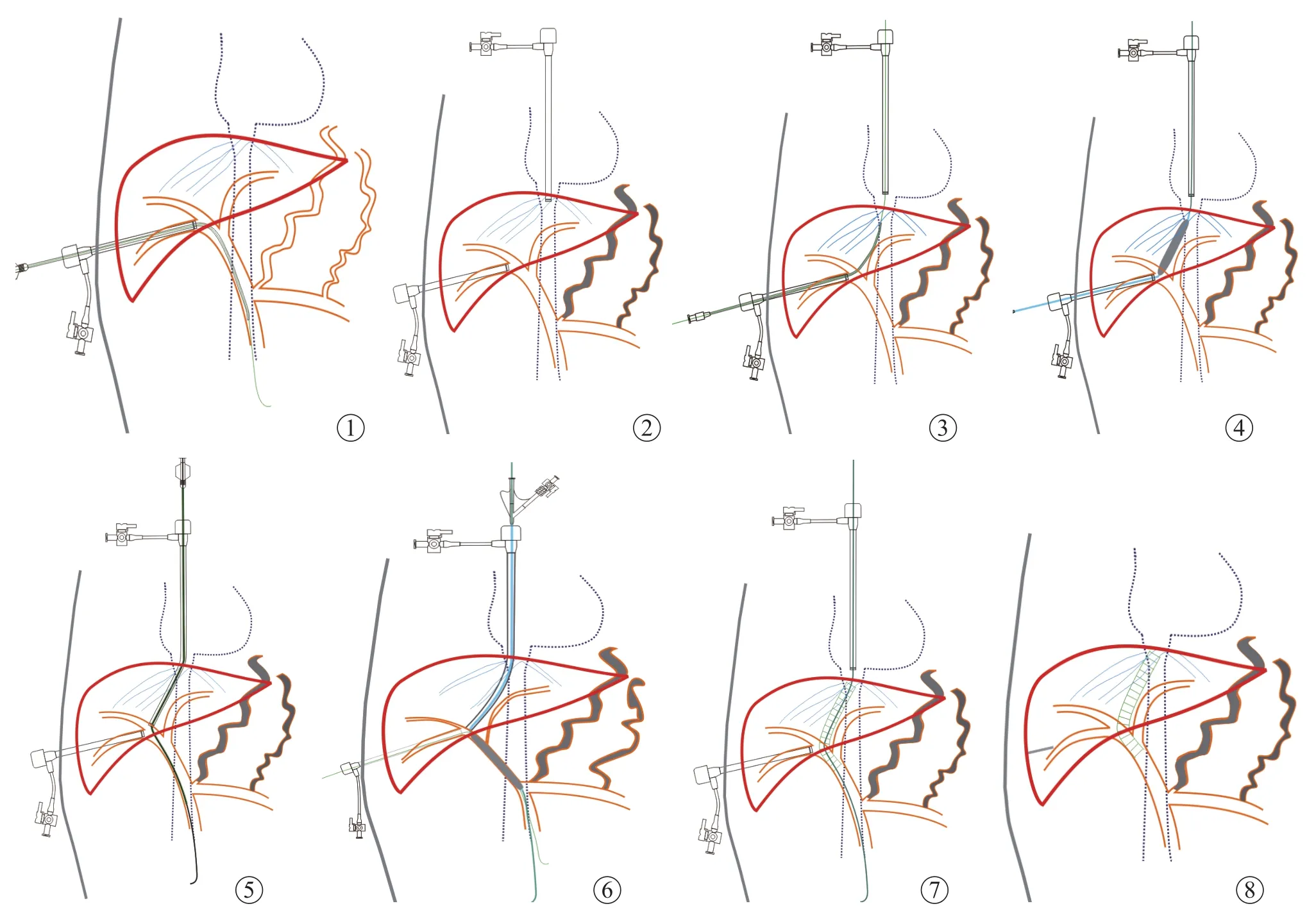
图1~8 门静脉通畅患者PTIPS手术步骤示意图 图1为经皮经肝穿刺门静脉右下分支,置入鞘管及导管,行门静脉造影。图2为穿刺右侧颈内静脉,置入长鞘于肝静脉(或肝段下腔静脉),造影并留置定位,对于食管胃底静脉曲张慢性的患者给予栓塞。图3为以20G改良PTIPS穿刺针经门静脉穿刺肝静脉(或肝段下腔静脉),引入导丝并经颈内静脉拉出体外。图4为球囊扩张肝实质段分流道。图5为调整导丝、导管经门静脉进入肠系膜上静脉,并将长鞘引入门静脉。图6为球囊扩张门体分流道。图7为分流道内植入自膨式金属支架。图8为NBCA胶栓塞肝实质穿刺道,完成手术
76例患者中,2例术后出现低血容量性休克,其中1例胸腔及腹腔引流出血性液体,对2例可疑出血患者行肝动脉栓塞,输血、药物止血后治愈。1例肝功能C级患者术后5天因肝衰竭死亡。
2.随访:术后第1周、第1个月、第3个月,以后每隔3~6个月进行1次上腹部影像检查,可以超声、CT同时或间隔进行,了解分流道通畅情况。必要时给予上消化道内镜检查,了解术后食管胃底静脉曲张情况。当患者再发门脉高压症状时,及时进行影像及内镜检查,如为分流道狭窄或闭塞引起者,再次给予支架植入治疗。除1例死亡外,通过规范、积极的治疗与随访,其余75例患者门脉高压症状在1个月内基本消失,远期疗效仍在进一步随访中。
讨论
传统的TIPS是将Colapinto穿刺套针经右颈内静脉送入选定的肝静脉(多为右肝静脉)后,由肝静脉向门静脉右支穿刺建立分流道。临床中发现不同病因所致的门静脉高压,其肝脏相关血管亦发生不同形态的变化,如肝静脉重度狭窄/闭塞型巴德-基亚里综合征、肝体积严重萎缩后出现门静脉解剖结构的改变、门静脉血栓闭塞伴门静脉海绵样变性、门静脉癌栓等特殊情况,常规TIPS难以甚至无法完成[14-20],致使此类门静脉高压患者的TIPS治疗受到限制。尤其当处理急诊病例时,由于门体分流道无法建立,意味着上消化道出血患者的生命威胁仍然存在。鉴于存在上述棘手问题,我们研究了一种建立肝内分流道的新方法,即PTIPS。
有别于传统TIPS,PTIPS主要技术思路在于穿刺入路的改变,经皮成功穿刺肝内门静脉分支后,经门静脉“逆行”穿刺肝静脉或肝段下腔静脉建立肝内门体分流道。本技术优点在于:①手术风险低。PTIPS采用细针穿刺,首先以22G穿刺针经皮经肝穿刺肝内门静脉分支,再以20G穿刺针经门静脉穿刺肝静脉或下腔静脉,然后逐级扩张穿刺道。由于穿刺针较细,对肝脏及血管的损伤极小,出血的风险极低。本组中大部分患者均伴有凝血功能异常,PT不同程度延长,且34例患者术前CT提示肝体积明显萎缩,肝裂明显增宽,术后仅2例发生腹腔出血,并均为前期的病例,其原因可能与术后过早抗凝有关。后期病例通过调整抗凝方案未再发生穿刺出血并发症。②手术成功率高。本技术关键点为经皮穿刺肝内门静脉分支以及经门静脉穿刺肝静脉或肝段下腔静脉,因手术主要穿刺操作路径较常规TIPS短,手术可控性强。另因穿刺靶血管(肝静脉或肝段下腔静脉)中预留导管定位,大大提高了穿刺成功率。本组76例患者,复杂门脉高压症患者较多,其中25例伴有门静脉血栓/癌栓形成合并海绵样变性,3例为巴德-基亚里综合征(肝静脉闭塞),所有患者均成功完成PTIPS, 获得有效的临床治疗。③适用范围广。本技术肝内分流道建立途径灵活,可根据患者的具体情况将分流道建立于肝静脉与门静脉之间或下腔静脉与门静脉之间。普通门脉高压患者,只要成功经皮穿刺肝内门静脉即预示着手术的成功;传统TIPS难以完成的复杂门脉高压患者,亦可依据本方法的技术思想制定个体化穿刺方案,大大拓宽了介入性门体分流术的适应证。④近期疗效满意。患者的预后与其原发病、肝脏本身储备功能有关,术后积极治疗、定期随访能有效的延长患者的生存期。本组所有患者门脉高压症状均得到有效控制,但仍有1例肝功能C级患者术后进行性肝衰竭,于第5天死亡。因此,虽然PTIPS的适用范围更广,但掌握好适应证对于提高患者的长期疗效仍然非常重要。
总之,PTIPS在临床中的成功应用,拓展了介入性门体分流术的适应证,使部分情况复杂的门静脉高压症患者能够成功接受分流术治疗。PTIPS克服了常规TIPS的技术难度,手术风险小,技术成功率高,掌握好手术适应证,有望广泛应用于临床。
1 Sanjal AJ, Freedman AM, Luketic VA, et al. Transjugular intrahepatic portosys-temic shunts for patients with active variceal hemorrhage unresponsive to sclerotheraphy[J]. Gastroenterology, 1996, 111(1):138–146.
2 Merli M, Salerno F, Riggio O, et al. Transjugular intrahepatic portosystemic shunt versus endoscopic sclerotheraphy for the prevention of variceal bleeding in cirrhosis: a randomized multicenter trial[J]. Hepatology, 1998,27(1):40–45.
3 Rossle M, Ochs A, Gulberg V, et al. A comparison of paracentesis and transjugu-lar intrahepatic portosystemic shunting in patients with ascites[J]. N Engl J Med, 2000,342(23):1701–1707.
4 Salerno F, Merli M, Riggio O, et al. Randomized controlled study of TIPS ver-sus paracentesis plus albumin in cirrhosis with severe ascites[J]. Hepatology, 2004, 40(3):629–635.
5 Riggio O, Ridola L, Angeloni S, et al.Clinical eff i cacy of transjugular intrahepatic portosystemic shunt created with covered stents with different diameters:Results of a randomized controlled trial[J]. J Hepatol, 2010, 53(2):267–272.
6 Rössle M, Grandt D. Early transjugular intrahepatic portosystemic shunt in patients with cirrhosis and variceal bleeding[J]. Hepatology, 2010, 52(5):1847-1850.
7 Banares R, Casado M, Rodriguez-Laiz JM, et al. Urgent transjugular intrahepatic portosystemic shunt for control of acute variceal bleeding. Am J Gastroenterol,1998, 93(1):75–79.
8 Sanyal AJ, Freedman AM, Luketic VA, et al. Transjugular intrahepatic portosys-temic shunts for patients with active variceal hemorrhage unresponsive to sclerotherapy[J]. Gastroenterology, 1996, 111(1):138–146.
9 Gerbes AL, Gulberg V, Waggerhauser T, et al. Transjugular intrahepatic portosystemic shunt (TIPS) for variceal bleeding in portal hypertension. Com-parison of emergency and elective interventions[J]. Dig Dis Sci, 1998, 43(11):2463–2469.
10 姜在波,单鸿,关守海,等. 门静脉癌栓合并门脉高压症的TIPS姑息治疗[J].中华放射性杂志,2002;36(12):1075-1079.
11 Jiang ZB, Shan H, Shen XY, et al. Transjugular intrahepatic portosystemic shunt for palliative treatment of portal hypertension secondary to portal vein tumor thrombosis[J]. World J Gastroenterol, 2004, 10(13):1881-1884.
12 Sarin SK, Sollano JD, Chawla YK, et al. Consensus on extra-hepatic portal vein obstruction[J]. Liver Int, 2006, 26:512–519.
13 邵硕,姜在波,王劲,等. 经皮经肝肝内门体分流术的多层CT影像研究[J]. 中华放射学杂志, 2011, 45(9):854-857.
14 单鸿,关守海,姜在波,等.改良式经颈静脉肝内门腔静脉分流术治疗肝静脉闭塞型Buddi-Chiari 综合征[J].中华放射学杂志,2002, 36(9):787-791.
15 Haskal ZJ, Duszak R Jr, Furth EE. Transjugular intrahepatic transcaval portosystemic shunt: the gun-sight approach[J]. J Vasc Interv Radiol, 1996, 7(1):139-142.
16 Raza SA, Walser E, Hernandez A, et al. Transhepatic puncture of portal and hepatic veins for TIPS using a single-needle pass under sonographic guidance[J]. AJR Am J Roentgenol, 2006, 187(1):W87-91.
17 Hoppe H, Wang SL, Petersen BD. Intravascular US-guided direct intrahepatic portocaval shunt with an expanded polytetraf l uoroethylenecovered stent-graft[J]. Radiology, 2008, 246(1): 306-314.
18 李名安,姜在波,周斌,等. 经皮经肝穿刺肝内门体分流术的临床研究[J]. 中华医学杂志, 2012, 92(41):2913-2917.
19 褚建国,孙晓丽,吕春燕,等.经皮经肝门腔静脉分流术[J].介入放射学杂志,2005, 14(4):367-371.
20 姜在波,李名安,单鸿,等. 经皮经肝穿刺改良式肝内门体分流术的临床应用[J].中华放射学杂志,2011, 45(1):89-91.
Technical protocol and clinical application of percutaneous transhepatic intrahepatic portosystemic shunt
LI Mingan, Jiang Zaibo, Shan Hong, Zhou Bin, Zhang Youyong, Wang Haofan, Huang Mingsheng,Qian Jiesheng, Guan Shouhai.
Department of Interventional Vascular Radiology, the 3rd Af fi liated Hospital of Sun Yat-sen University, Guangzhou 510630, China
Jiang Zaibo,Email: jiangzaibo@aliynn.com
ObjectiveTo introduce the technical protocol and clinical application of percutaneous transhepatic intrahepatic portosystemic shunt (PTIPS).MethodsBetween November 2009 and March 2013, 76 patients with symptomatic portal hypertension underwent PTIPS due to bleeding varices (n=69), refractory ascites (n=7), and bleeding varices combining with refractory ascites (n=23). The severity of liver disease was Child-Pugh A in 23 cases, Child-Pugh B in 35, and Child-Pugh C in 18. The CT or MR image manifested serious hepatatrophy in 34 cases and cavernous transformation of portal vein (CTPV) in 25 cases. Under fl uoroscopic guidance, the portal vein (PV) was punctured . Then, the hepatic vein (HV) or retrohepatic inferior vena cava (RIVC) was punctured PTIPS procedure was completed in the standard transjugular fashion.ResultsThe procedure was technically successful in all patients. And effective portal decompression and free antegrade shunt fl ow were achieved. The mean portal pressure gradient decreased from (32.35±2.89) mmHg to (18.42±1.32) mmHg before and after PTIPS creation respectively, and the difference was signi fi cant statistically (P<0.001). Of the 76 patients, abdominal hemorrhage occurred in 2 cases, which was cured by artery embolization. One patient developed hepatic coma and died after 5 days while the other 75 patients survived and the symptoms of portal hypertension disappeared in one month.ConclusionsPTIPS is both safe and effective in treatment of portal hypertension with exceptionally challenging anatomy. It is an available supplement for transjugular intrahepatic portosystemic shunt. It can extend the application scope of interventional portosystemic shunt.
Hypertension, portal; Percutaneous transhepatic; Portosystemic shunt; Radiology, interventional
2013-06-12)
(本文编辑:黄强)
10.3877/cma.j.issn.2095-5782.2014.03.001
广东省科技计划项目(2011B031800082);广东省科技计划项目(2012B031800085)
510630 广州,中山大学介入放射学研究所,中山大学附属第三医院介入血管科
姜在波, Email: jiangzaibo@aliyun.com
