恶性梗阻性黄疸介入治疗联合灌注化疗疗效评估
2014-04-30牛洪涛翟仁友王剑锋黄强
牛洪涛 翟仁友 王剑锋 黄强
恶性梗阻性黄疸介入治疗联合灌注化疗疗效评估
牛洪涛 翟仁友 王剑锋 黄强
目的 探讨胆道介入减黄治疗联合以吉西他滨为基础药物的灌注化疗(栓塞)治疗恶性梗阻性黄疸的疗效。方法选择60例经皮肝穿刺胆汁引流术和/或经皮肝穿刺胆道支架治疗成功减黄的患者(总胆红素<50 μmol/L),对原发肿瘤行灌注化疗(栓塞)治疗。进行随访直至患者死亡。随访内容包括:患者一般健康情况、实验室检查、影像学检查、支架开通情况、患者生存期,随访资料填入患者病例报告表。并与单纯行介入减黄治疗患者比较生存期、生活质量及支架开通率。结果60例患者行PTBD治疗27例,胆道支架治疗33例。大部分患者均行2~3次灌注化疗(栓塞)术。主要毒性反应包括:①骨髓抑制,②消化道反应,③皮疹,④肝功能受损,大部分为Ⅰ~Ⅱ度。平均生存期(311.03±170.23)天,1个月、3个月,6个月以及12个月生存率分别为100%、93.33%、78.33%和28.33%。化疗灌注组生存率明显优于单纯减黄治疗组(χ2=8.693,P=0.003)。胆道支架平均开通时间为(238.48±171.26)天,1个月、3个月,6个月以及12个月开通率分别为100%、90.91%、57.58%和9.09%。与单纯PTBS减黄治疗比较,二组间支架开通率无明显差异(χ2=0.975,P=0.324)。灌注化疗后患者KPS评分83.05±6.38,与治疗前(64.28±5.51)比较有明显差异(t=12.79,P<0.001)。结论以吉西他滨为基础化疗药物的TACE(TAI)治疗毒副作用较轻,患者对治疗的耐受性和依从性好;能够明显延长MOJ患者的生存期,提高患者的生活质量;在延长胆道支架的开通时间方面未能发现明显作用。
梗阻性黄疸;吉西他滨;介入放射学;生存分析
姑息性减黄治疗(如PTBD和PTBS)能够有效的解除梗阻症状,改善肝肾功能,淤胆问题解除后针对原发肿瘤的治疗成为后续治疗的主体。研究显示化学治疗和放射治疗疗效并不确定,甚至导致肝功能失代偿[1]。经导管动脉灌注(栓塞)术不受肿瘤的位置和大小的限制,对缩小瘤体提高支架远期开通率大有裨益。国内王建华等[2]首先提出了MOJ的双介入治疗,尤其对富血供肿瘤疗效显著,延长了患者的生存期[3]。吉西他滨作为光谱抗肿瘤药物,肿瘤反映率高,毒性温和、副作用可控性好,且适合作为经动脉灌注化疗药物应用。当前国内外以吉西他滨为基础药物的MOJ双介入治疗研究尚空缺,因此本研究的主要目的是选择经介入减黄治疗成功后拟行以吉西他滨为基础药物的TACE(TAI)患者60例,评估近、中、远期疗效;与单纯行介入减黄治疗患者比较,评估两种治疗方法在提高患者生活质量和生存期方面的价值。
对象与方法
1.入选和排除标准:国内九所医科大学18家附属医院参与此前瞻性研究,研究时间自2008年1月至2010年12月,纳入标准:①患者签署《入组知情同意书》同意参加本研究;②病理学或影像学检查及临床明确诊断为恶性梗阻性黄疸;③无严重的合并症如高血压、冠心病和精神病史,无严重过敏史;④心、肾、骨髓等主要器官功能基本正常;⑤未接受化疗、放疗和肿瘤的相关根治性切除手术;⑥能接受经皮经肝胆汁引流、放射治疗、局部动脉灌注治疗;⑦能随访、依从性好;⑧KPS评分≥70分;⑨血清总胆红素浓度明显下降,小于50umol/L;⑩实验室检查指标:WBC≥3.0×109/L,血小板计数≥100×109/L,白蛋白≥20 g/L,PT小于正常上限的1.5倍,Cr小于正常上限的1.5倍。排除标准:①孕妇或哺乳期妇女;②为经影像学检查及临床明确诊断者;③因各种原因不能完成治疗方案者;④合并较为严重的心肝肾骨髓等主要器官功能不全者;⑤入组后3月内失访者;⑥曾行化疗或放射治疗;⑦出现脑转移和活动性感染病变;⑧腹腔积液;⑨肝性脑病。
2一般资料:共60例经PTBD和/或PTBS治疗成功减黄的患者纳入本研究。所有的患者均经历病理学或影像学明确诊断为恶性肿瘤,梗阻原因见表1。男39例,女21例,年龄29~87岁,中位年龄64岁。胆管癌24例,胰头癌21例,肝癌5例,胆囊癌4例,胃癌术后复发3例,壶腹癌3例。
3.治疗方法:全部60例MOJ患者均先行PTBD和/或PTBS治疗,一般在术后2~4周血清总胆红素浓度降至50umol/L,对原发肿瘤行TACE/TAI治疗。将导管分别于腹腔干和肠系膜上动脉造影观察肿瘤血供以及可能的侧枝循环。通常情况下灌注或栓塞动脉的选择根据具体肿瘤和发病部位而定,对于肝门胆管癌、胆囊癌选择肝固有动脉物;对于胰头癌、胆总管癌和壶腹癌选择胃十二指肠动脉;对于肝癌根据肿瘤部位选择肝左或肝右动脉,甚至超选择至肝段动脉;对于胃癌根据肿瘤部位选择胃十二指肠动脉、胃左动脉。化疗方案:以吉西他滨(健择)为基础,剂量1000mg/m2;联合氟脲苷0.5~1.0g,奥沙利铂200mg,表柔比星20~60mg(根据具体肿瘤类型选择不同灌注化疗组合方案)。对于造影过程中发现存在明确肿瘤染色的病灶行碘油(5~15ml)混合表柔比星栓塞治疗。我们每1~2个月对患者行CT随访,行TACE(TAI)1~3次。
4.资料分析:由各分中心通过系统培训的1-2名临床医生负责患者的随访工作,通过电话、门诊或住院对患者进行术后随访。随访时间点为术后1个月、6个月、12个月、18个月、24个月直至患者死亡。随访内容包括:患者一般健康情况(KPS、QOL评分、体重等)实验室检查(血常规、凝血、肝肾功能、肿瘤标志物等)、影像学检查(CT、MR、超声及胆道造影等);支架开通情况。随访资料填入患者CRF表。
生存时间定义为PTBD和(或)PTBS术后至患者死亡时间。支架开通时间是指支架植入术后至支架闭塞需要再次介入治疗的时间;或支架植入术后至患者死亡的时间(若未发生支架闭塞)。临床受益反应评估标准包括:与入组前患者止痛药的使用量减少>50%;疼痛程度减轻>50%;KPS评分上升≥20分;体重比基线水平增加≥7%;并且这些指标至少一项持续4周以上,其他指标无任何持续恶化,则评价为临床受益。
5.统计学分析:使用SPSS17.0软件,连续变量的比较应用Student'st-检验,分类变量应用χ2检验;Kaplan-Meier分析支架开通情况与生存期,P<0.05为差异有统计学意义。
结果
1.治疗前情况:60例MOJ患者男39例、女21例,平均年龄(61.58±10.44)岁(35~77岁)。行PTBD治疗27例,PTBD+PTBS治疗33例。血清总胆红素水平均在术后2~4周降至50 μmol/L。TACE(TAI)术前总胆红素水平(23.96±10.22)μmol/L(14.3~48.8 μmol/ L),其它实验室指标包括WBC (7.03±3.07)×10/9L、血红蛋白(115.41±17.2)g/L、PLT(245.29±75.62)×10/9L、AST(67±57.05)U/L、ALT(57.59±35.52)U/L、ALB(29.99±6.63)g/L、PT(11.77±1.49)s、BUN(4.54±2.93)mmol/L、Cr(66.06±37.09)μmol/L。
2.治疗情况:4例生存期小于3个月患者仅行1次灌注化疗外,其余患者均至少行2~3次灌注化疗,最多者行8次灌注化疗。
毒性反应:吉西他滨为基础治疗MOJ的毒性反应主要表现为:①骨髓抑制:白细胞减少、血红蛋白减少、血小板减少。②消化道反应:恶心呕吐均为0~Ⅱ度。③皮疹:程度较轻,无过敏反应。④肝功能受损。本组患者未出现心脏、泌尿系统或神经系统毒性(表1)。
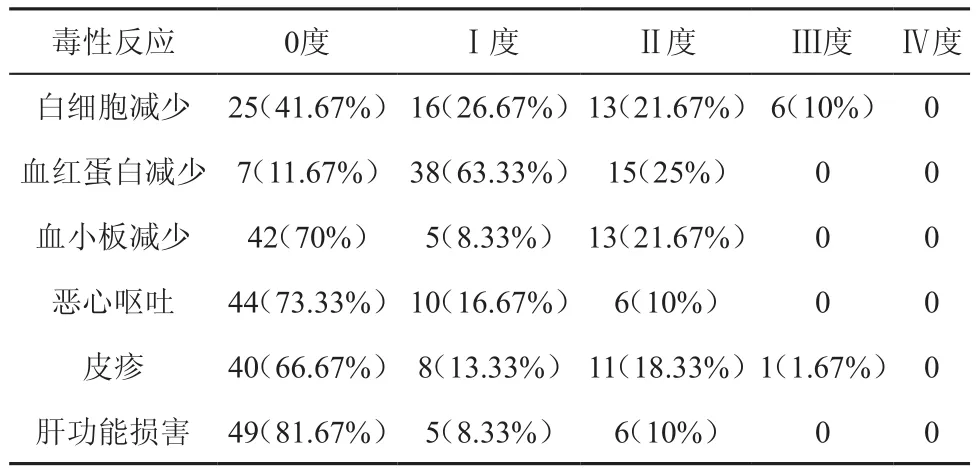
表1 吉西他滨为基础治疗MOJ的毒性作用
灌注化疗期间未发现直接与手术相关的严重并发症发生,无患者于介入治疗术后30天内死亡。2例患者在随访期间仍然存活,平均生存期是311.03±170.23天,1个月、3个月,6个月以及12个月生存率分别为100%、93.33%、78.33%和28.33%。与论文第一部分单纯PTBD或PTBS减黄治疗患者生存期比较,化疗灌注组明显优于单纯减黄治疗组(χ2=8.693,P=0.003)。胆道支架平均开通时间为(238.48±171.26)天,1个月、3个月,6个月以及12个月开通率分别为100%、90.91%、57.58%和9.09%。与论文第一部分单纯PTBS减黄治疗患者胆道支架开通时间比较,二组间未发现明显差异(χ2=0.975,P=0.324)。灌注化疗后患者KPS评分83.05±6.38,与治疗前(64.28±5.51)比较有明显差异(t=12.79,P<0.001)。
讨论
MOJ外科治疗包括根治性切除和姑息性手术。但是胆管癌、胆囊癌及肝癌的手术切除率低于5%[4、5],胰腺癌根治性切除率低于30%[6]。因此对于不可切除MOJ患者姑息性减黄治疗成为常规。PTBD和PTBS已经成为MOJ首选姑息性治疗方法。严律南[7]指出胆道引流能够改善患者的生活质量但不能延长患者的生存期。胆道引流能够减轻黄疸症状改善肝储备功能,因此MOJ患者有机会接受进一步的化疗、放疗、光动力治疗或射频消融治疗[8-9]。放射治疗并不能延长患者生存期,甚至可能导致肝功能失代偿。对于化疗文献研究结果并不一致,一些文献研究显示化学治疗能够延长患者生存期,而其它文献未发现患者从化学治疗中受益。
王建华等首先提出了MOJ的双介入治疗,即胆道引流成功后再行TACE(TAI)术。TACE(TAI)局部效果好,全身反应小,而且对多种消化道实体肿瘤均有明确疗效,是治疗MOJ原发病灶的常用方法。其理论基础在于:①当实体肿瘤生长超过2~3 mm时需要通过新生血管形成来供应营养;②使用导管超选择至肿瘤的供血动脉灌注化疗药物可造成肿瘤局部高的化疗药物浓度,而经静脉全身化疗无法达到此种肿瘤区域高浓度,这对于半衰期较短的化疗药物尤其重要[10];③部分化疗药物在肝脏一过性摄取可以降低药物的身体内浓度,减少化疗药物的毒性反应。早先对于MOJ患者常用的灌注药物是以5-FU为基础的联合化疗,而5-FU主要副作用就是肝胆的毒性作用,可导致大约42%患者转氨酶和胆红素的升高[11]。开发毒性作用更低的化疗药物替代5-FU可以为MOJ患者提供一种新的治疗方案。
吉西他滨是一种嘧啶抗代谢物,结构上类似于阿糖胞苷。在脱氧胞苷激酶的作用下经过细胞内磷酸化过程形成活性的5’-三磷酸盐。吉西他滨的细胞毒作用主要是因为它对DNA复制过程的影响。吉西他滨三磷酸盐整合进DNA导致复制叉进程的减慢;吉西他滨二磷酸盐可以抑制核苷酸还原酶的作用脱氧核苷酸池的衰竭;吉西他滨三磷酸盐直接抑制DNA复制聚合酶[12]。吉西他滨通过胞苷脱氨酶和胞苷酸盐脱氨酶代谢清除,而这两种酶最多见于肝脏[13]。单剂应用时对于实体肿瘤(包括非小细胞肺癌、胰腺癌、胆管癌等)吉西他滨耐受性好,展示出广谱的抗肿瘤活性,肿瘤反映率约21%~53%。鉴于吉西他滨具有高体内清除率和高肝脏摄取率,因此适合作为经动脉灌注化疗药物。
在有效的胆道引流后,经2~4周的时间大部分MOJ患者的血清总胆红素虽不能降至正常水平,但已低于50 μmol/L,肝功能基本恢复,Child-Pugh分级为A或B级,完全可以承受灌注治疗。本研究主要的毒副反应为血液学毒性,白细胞减少、血红蛋白减少以及血小板减少绝大多数为Ⅰ~Ⅱ度,经过适当的对症治疗并不影响治疗过程。消化道反应可给予昂丹司琼止吐药物明显缓解。个别患者出现皮疹及轻度肝功能损害。全组无心、肾功能损害和因灌注化疗出现死亡的病例。经灌注化疗后患者生存期明显延长,Kaplan-Meier分析显示灌注化疗组患者生存期明显长于单纯减黄治疗组(P=0.003),平均生存期达10.2个月。高于王小琳等的7.9个月[14];接近钱晓军等的10.5个月[15],低于Herber等的21.1个月[16]。理论上针对肿瘤的灌注(栓塞)治疗能够抑制肿瘤生长,可以延长支架的开通时间[17]。虽然本研究中灌注化疗组胆道支架开通平均时间为238天,优于第一部分中单纯PTBS组198天,但Kaplan-Meier分析显示两组间支架开通时间并无明显差异。与钱晓军等的研究结果一致。这可能是由于TACE治疗后瘤栓导致胆总管梗阻机率的增高[18]。而外放射治疗可能延长胆道支架的开通时间[19]。
总之,介入减黄成功后针对原发肿瘤的TACE(TAI)能够明显延长MOJ患者的生存期,提高患者的生活质量。但未能发现TACE(TAI)能够延长胆道支架的开通时间,若联合放射治疗可能会延长胆道支架的开通时间。
1 Cherqui D, Tantawi B, Alon R, et al. Intrahepatic cholangiocarcinoma. Results of aggressive surgical management[J]. Arch Surg, 1995,130: 1073-1078.
2 王建华, 王小林, 颜志平,等. 腹部介入放射学[M].上海: 上海医科大学出版社,1998: 113。
3 Herber S, Otto G, Schneider J, et al. Transarterial chemoembolization (TACE) for inoperable intrahepatic cholangiocarcinoma[J]. Cardiovasc Intervent Radiol, 2007, 30:1156-1165.
4 Parker SL, Tong T, Bolden S, et al. Cancer statistics, 1997[J]. CA Cancer J Clin, 1997,47:5-27.
5 Lau W, Leung K, Leung TW, et al. A logical approach to hepato -cellular carcinoma presenting with jaundice[J]. Ann Surg, 1997, 225: 281-285.
6 Gudjonsson B. Editorial: Pancreatic cancer. The need for critical reassessment[J]. J Clin Gastroenterol, 1996, 23:2-6.
7 严律南.恶性梗阻性黄疸的综合治疗[J].中国实用外科杂志,2001,21:473.
8 Suzuki S, Inaba K, Yokoi Y, et al. Photodynamic therapy for malignant biliary obstruction: a case series[J]. Endoscopy, 2004, 36:83-87.
9 张福君,吴沛宏,顾仰葵,等.恶性梗阻性黄疸患者内支架植入术后近距离治疗的临床价值[J].癌症,2004,23:1567-1571.
10 Collins JM. Pharmacologic rationale for regional drug delivery[J]. J Clin Oncol,1984,2:498-504.
11 Skitzki JJ, Chang AE. Hepatic artery chemotherapy for colorectal liver metastases: technical considerations and review of clinical trials[J]. Surg Oncol, 2002,11:123-135.
12 Plunkett W, Huang P, Searcy CE, et al. Gemcitabine: preclinical pharmacology and mechanisms of action[J]. Semin Oncol, 1996, 23: 3-15.
13 Schuller J, Cassidy J, Dumont E, et al. Preferential activation of capecitabine in tumor following oral administration to colorectal cancer patients[J]. Cancer Chemother Pharmacol, 2000,45:291-297.
14 王小林,陈颐,王建华,等. 肝门部肝癌合并梗阻性黄疸的介入治疗[J].中国医学计算机成像杂志,2005,11:412-415.
15 Qian XJ, Zhai RY, Dai DK, et al. Treatment of malignant biliary obstruction by combined percutaneous transhepatic biliary drainage with local tumor treatment[J]. World J Gastroenterol, 2006,12:331-335.
16 Herber S, Otto G, Schneider J, et al. Transarterial chemo- embolization (TACE) for inoperable intrahepatic cholangio-carcinoma. Cardiovasc Intervent Radiol, 2007, 30:1156-1165.
17 Miura Y, Endo I, Togo S,et al. Adjuvant therapies using biliary stenting for malignant biliary obstruction[J].J Hepatobiliary Pancreat Surg, 2001,8:113-117.
18 Qin LX, Tang ZY. Hepatocellular carcinoma with obstructive jaundice: diagnosis, treatment and prognosis[J]. World J Gastroenterol, 2003,9:385-389.
19 丁田贵,尹立杰,高众,等.胆道介入支架联合立体定向放射治疗恶性梗阻性黄疸[J].中华放射医学与防护杂志,2006,26:265-266.
Therapeutic evaluation in malignant obstructive jaundice with PTBD and PTBS combined with intraarterial chemoperfusion and chemoembolization.
Niu Hongtao, Zhai Renyou, Wang Jianfeng, Huang Qiang.
Department of Radiology, The First Hospital of Qinhuangdao, Qinhuangdao 066000, China
Zhai Renyou, Email: ryzhai219@hotmail.com
ObjectiveTo explore the therapeutic effect in malignant obstructive jaundice with PTBD and PTBS combined with gemcitabine-base intraarterial chemoperfusion and chemoembolization.MethodsWe choosed 240 patients with malignant obstructive jaundice who had been successfully drained(TBIL<50umol/L), and performed intraarterial chemoperfusion and chemoembolization. Patients were back in the outpatient clinic for a follow-up visit at 1 month, 3 months, 6 months, 12 months, 18 months and 24 months thereafter. Contents included general health related questions, laboratory results, image examination, drainage catheter, patency of stent and treatment of stent obstruction.Recordswere entered into CRF for subsequent processing and analysis. Compare survival, quality of life and rate of stent patency with non-perfusing chemotherapy group. Results Of the 60 patients 27 were initially treated with PTBD and 33 with PTBS. Most of them received intraarterial chemoperfusion and chemoembolization for 2-3 times. Major toxicities included myelosuppress, digestive reaction, rash and lesion of hepatic function, and most of them belonged to 1 to 2 grade. The mean survival was (311.03±170.23) d. The rate of survival was 100%, 93.33%, 78.33% and 28.33% for 1 month, 3 months, 6 months and 12 months, respectively. The Kaplan-Meier analysis showed survival rate of chemoperfusion group was prior to non-chemoperfusion group (χ2=8.693, P=0.003). The mean stent patency time was (238.48±171.26) d. The rate of patency was 100%, 90.91%, 57.58 and 9.09% for 1month, 3 months, 6 months and 12 months, respectively. Stent patency times between two groups were not different statistically by log-rank test (χ2=0.975, P=0.324). Karnofsky index was 83.05±6.38 after intraarterial chemoperfusion and chemoembolization, and was signif i cantly higher than pretherapy (t=12.79, P<0.001).ConclusionsPatients received gemcitabine-base intraarterial chemoperfusion and chemoembolization had the low toxic effects and high rate of clinical benef i t. It could signif i cantly prolong stent patency time.
Obstructive jaundice; Gemcitabine; Interventional therapy; Survival analysis
2013-07-05)
(本文编辑:翟仁友)
10.3877/cma.j.issn.2095-5782.2014.03.006
国家“十一五”科技支撑计划(2007BAI05B06)
066000 秦皇岛市第一医院放射科(牛洪涛);100020 北京 首都医科大学附属北京朝阳医院放射科(翟仁友、王剑锋、黄强)
翟仁友,Email:ryzhai219@hotmail.com
