肌肉力量的微观起源
2014-04-29柳睿殊刘荣刘书霞张辉耿轶钊纪青
柳睿殊 刘 荣 刘书霞 张 辉 耿轶钊 纪 青

摘 要:人体实现机械运动所需的力量是由肌肉产生的。理解肌肉的力产生机理是目前科学研究的最前沿课题之一。肌肉的最基本单元是肌小节。肌小节是一个设计极为精巧的力学装置,其中负责产生力的是一种叫做肌球蛋白的分子马达。通过介绍肌小节和肌球蛋白的结构和工作原理,可以看到生命如何利用蛋白质分子巧妙地实现了复杂的力学功能。此外,对于肌球蛋白马达研究中有待理解的相关问题也进行了简要介绍
关键词:肌肉;肌小节;肌球蛋白;分子马达
中图分类号:Q71
文献标识码:A
文章编号:1007-7847(2014)05-0453-05
生命的最突出特征是其运动功能。我们身体的运动自如是通过骨骼和肌肉两大系统的相互配合实现的。骨骼起到刚性支撑和杠杆的作用,在骨骼周围分布的肌肉(骨骼肌)通过收缩产生力量。不同的肌群分布在骨骼和关节的不同部位,使得我们的肢体能够收放自如。人类一直在问自己这样一个问题:肌肉的力量到底是怎么产生的?
随着人类的科学知识体系的逐步完善和实验手段,特别是单分子实验手段的大大提高,我们已经搞清了肌肉的微观结构,理解了这种微观结构的工作原理,并把目光逐步集中到肌肉中一种特殊的蛋白质分子上,这就是具有马达功能的肌球蛋白分子。肌球蛋白是一种酶蛋白,能够催化腺苷三磷酸分子(aderlosine triphosphate,ATP)的水解反应,将贮藏在ATP分子中的化学能转换为自身运动所需的机械能。这种将化学能转换为机械能的功能恰恰就是马达的功能。所以肌球蛋白分子被正确地称为分子马达。分子马达是牛命力量的终极起源。我们下面首先介绍肌肉的最基本单元——肌小节的结构和工作原理,然后介绍肌球蛋白的分子结构和它的发力原理。关于肌球蛋白的结构和功能的研究是目前科学研究中的最前沿课题之一。理解肌球蛋白的运作机理需要综合运用自然科学中多个不同学科的深入的理论知识,其中还有许多极富挑战性的问题没有解决。我们将介绍这方面的主要研究成果以及一些还没有理解的重要问题。
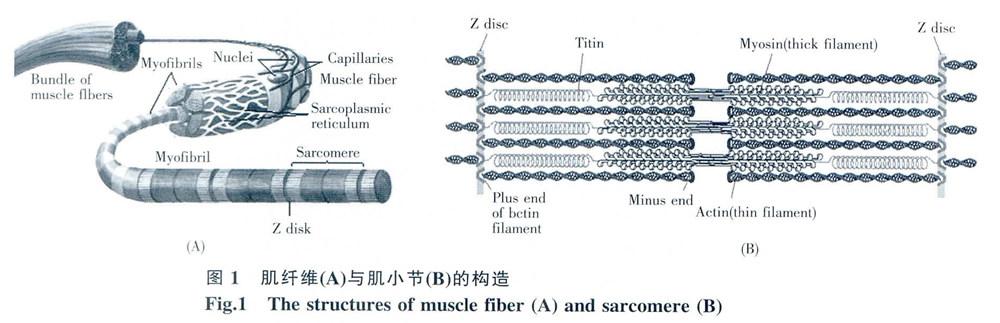
1 肌小节的结构与工作原理
组成骨骼肌的肌纤维是通过细胞融合形成的巨大的多核单细胞,其细胞内部的主要成分是长长的肌原纤维,见图IA,每条肌原纤维由具有伸缩功能的肌小节连接而成。肌小节的结构如图1B所示。肌小节的主要构造单元包括Z盘,细丝,粗丝和肌连蛋白。细丝由肌动蛋白、伴肌动蛋白连接而成,其上还附着有原肌球蛋白和肌钙蛋白。细丝具有极性,其正端与Z盘相连,负端指向肌小节中心。粗丝由肌球蛋白分子聚合而成。肌球蛋白分子有很多种。骨骼肌的肌球蛋白是肌球蛋白一Ⅱ(以下简称为肌球蛋白)。肌球蛋白通常是一种分子二聚体,有两条完全相同的链相互缠绕组成一个大分子。每条链有一个具有马达功能的头部和由α螺旋形成的长长的尾部。由肌球蛋白聚合而成的粗丝通过肌连蛋白与Z盘相连。细丝和粗丝都是多分子聚合体,而肌连蛋白则是一个巨大的单分子,由一种基本结构单元重复连接而成。肌连蛋门是目前所知最大的蛋白单分子,所包含的氨基酸数日可以达到25 000以上。每个肌小节的长度约为2.2 μm。
肌小节的收缩功能是通过粗丝相对于细丝的定向运动实现的。组成粗丝的肌球蛋白的马达头部与细丝的肌动蛋白可以处在结合或分离状态肌球蛋白头部与肌动蛋白的结合只能发生在特定的结合位点。在静息状态下,马达头部与肌动蛋白的结合位点被原肌球蛋白遮挡。当大脑发出了运动的神经信号后,肌肉细胞会通过肌质网释放钙离子。钙离子浓度的升高会诱导肌钙蛋白和原肌动蛋白发生构象变化,使马达头部与肌动蛋白的结合位点暴露出来。于是马达头部可以和肌动蛋白发生相互作用。这种相互作用在ATP水解能量的推动下反复发生。作用过程中马达头部总是向着细丝的正方向运动,或者说是使细丝向着肌小节的中心方向运动,从而使肌小节发生了收缩。
收缩后的肌小节不会自动恢复其原来的长度.其长度的改变需要有其它肌群提供一定的拉伸力。但是当肌小节被过度拉伸后,它却能自动恢复到一定的长度。这个恢复力是南具有弹簧特性的肌连蛋白提供的。肌连蛋白的基本重复单元是一个近似于免疫球蛋白 C2部分的球状结构。当受到较大拉力时,肌连蛋白的基本重复单元会逐个南球状展开为线状。当外力撤掉后,它们又会逐步收缩为球状,从而使肌小节恢复到一定长度。
2 肌球蛋白的结构与功能
2.1 肌球蛋白的结构
肌球蛋白是分子水平的力学装置,它的基本构造材料是20种氨基酸。在蛋白质分子中,不同的氨基酸通过肽键连接起来形成α-螺旋、β-片等多种二级结构。这些二级结构再进一步折叠成近于球状的三级空间结构来行使各种生物学功能。
肌球蛋白是3种沿着线状轨道运动的马达蛋白中的一种。其他两种为驱动蛋白和动力蛋白,二者都以微管为运动轨道。骨骼肌中的肌球蛋白是肌球蛋白超家族中最早被发现的肌球蛋白Ⅱ,主要以二聚体形式存在(见图2A),能够沿着肌动蛋门微丝向其正端移动。肌球蛋白主要分为3个结构域:马达结构域、颈部结构域和尾部结构域。马达结构域能够与肌动蛋白相互作用并行使ATP酶的功能。肌球蛋白通过马达结构域实现了将化学能转换为机械能的关键过程,并在肌动蛋白上实现了一系列重要的构象变化。颈部结构域具有杠杆的作用,负责把马达头部的构象变化放大为较大的位移,从而使肌球蛋白整体实现向着细丝正端的步进。颈部结构域有一个较长的α一螺旋,上面结合着两个较小的轻链蛋白,分别为基础轻链(essential light chain,ELC)和调节轻链(reg-ulatory light chain,RLC)。尾部结构域是由两条长约150 nm的α-螺旋相互缠绕形成的缠绕螺旋结构。多个肌球蛋白通过尾部相互结合起来形成了近于对称分布的粗丝(见图1B),用来;固定和安置马达结构域使其能与肌动蛋白相互作用。
肌球蛋白马达结构域主要由4个亚结构域和1个中心β-片组成,我们分别将它们简称为N、U、L、C区,在图2B中分别用不同的灰度标示。中心β-片由7条β-条带组成,是马达头部比较刚硬的部分。4个亚结构域通过柔性的环肽链相连,可以发生一定的构象变化。整个头部包含约780个氨基酸,尺度在10 nm以内。4个亚结构域上以及它们之间带有重要的功能位点。核苷酸结合位点位于N、U、L区的交界处。没有核苷酸结合时,这个位点处于打开的状态。当ATP结合上去时,该结合位点处于闭合态。在核苷酸结合位点发生的构象变化是整个马达头部各个部分的构象变化的源头。整个肌球蛋白马达头部的结构没计就足要保证有效地将发生在核苷酸结合位点的构象变化放大为头部整体的确定的运动。在U区和L区的同一侧是马达头部与肌动蛋白的结合位点。在二者之间有一个裂隙区。裂隙的打开和关闭对马达头部与肌动蛋白的结合有重要影响。只有当裂隙处在关闭态时马达头部才能与肌动蛋白发生紧密的结合。而要想使马达头部脱离肌动蛋白表面,就必须使裂隙处在打开状态。C区为转换区,由它控制着颈部杠杆的运动。影响C区的运动的是两个螺旋结构,即SHI螺旋和传递螺旋。这两个螺旋一端与C区相接触,另一端靠近核苷酸结合位点.负责把核苷酸结合位点的构象变化转换为C区的构象变化一。
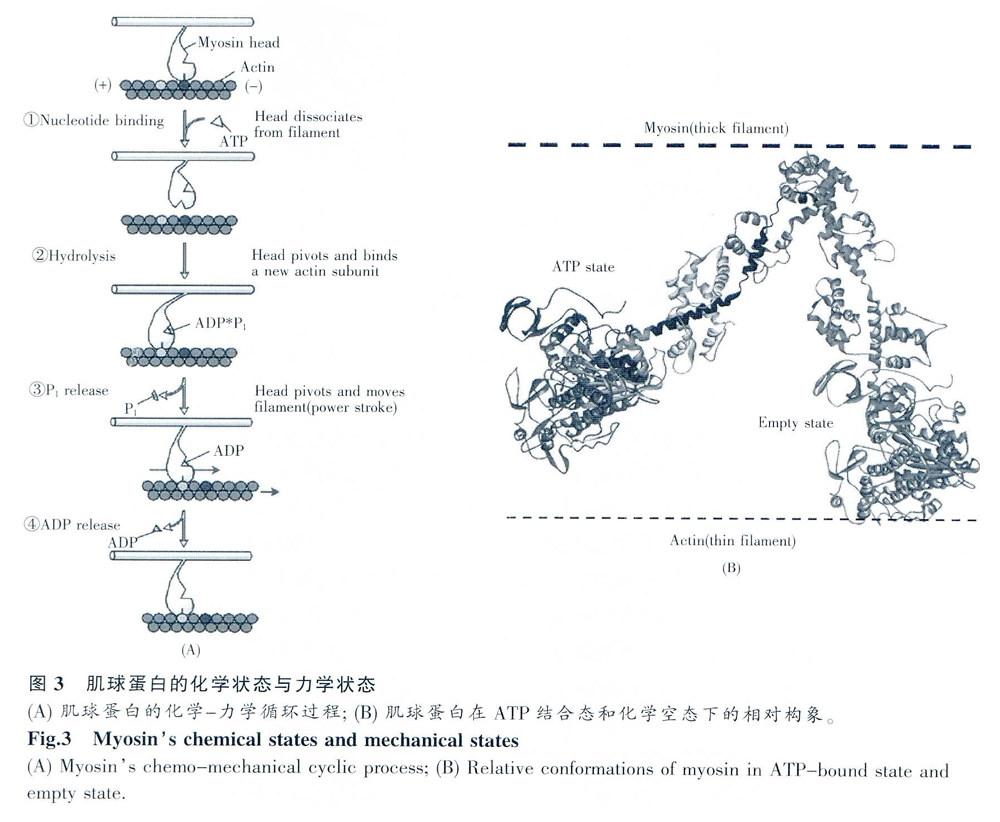
2.2 肌球蛋白的化学一力学循环
与普通的马达一样,肌球蛋白的马达结构域也要经历一个化学一力学循环过程。其化学过程是ATP分子的催化水解过程。这个过程包含以下步骤:1)ATP结合到核苷酸结合位点;2)在镁离子和水分子的帮助下ATP分子分解成两个产物,即ADP(腺苷二磷酸)和Pi(磷酸盐);3)Pi 由核苷酸结合位点释放出来;4)ADP从核苷酸结合位点释放出来:与化学过程相对应,马达头部的各个部分产生了一连串有序的构象变化,完成了抵抗阻力向前运动一步的完整的力学过程。如图3所示:首先,在ATP结合到肌球蛋白之前,核苷酸结合位点处于开放状态,而裂隙区处于关闭状态,肌球蛋白与肌动蛋白细丝处于强结合态。然后ATP结合到肌球蛋白,使核苷酸结合位点处于闭合状态.同时引发裂隙打开,破坏了肌动蛋白和肌球蛋向的相互作用,导致马达头部从肌动蛋白结合位点脱离。接下来ATP发生水解,引发马达结构域和颈部结构域的构象变化到一个高能态,使肌球蛋白头部相对于肌动蛋白细丝向着正方向移动一段距离。下一步,ATP水解的瞵酸盐产物(Pi)从肌球蛋白中释放。这一步产生了两个关键的构象变化,第一是引发裂隙闭合,使马达头部与肌动蛋白细丝处于强结合态;第二是引发C区发生较大的移位.推动颈部杠杆发生了一个大的摆动。这一步就是肌球蛋白马达的力产生步骤,也被称为动力冲程(Power stroke)。这一步的力学效果是使粗丝相对于细丝向着Z艋正端移动5~10nm。最后,ADP从核苷酸结合位点释放,肌球蛋门的头部构象返回到最初的静息状态,完成了整个化学一力学循环。
2.3 肌球蛋白的发力原理
肌球蛋白的卜述化学一力学循环过程解释了为什么肌小声中的粗丝能够相对于细丝定向运动从而使肌小节发生收缩。这是目前被广泛接受的解释。但是关于肌球蛋白如何发力并产生一系列的构象变化却还有大量的问题没有理解。为了理解肌球蛋白的发力原理,人们很自然地会寻找肌球蛋白的构造与汽车上的普通马达的相似之处一一个普通马达主要由汽缸、活塞、连杆和曲柄组成。其中能够把化学过程(燃料燃烧)和力学过程联系起来的关键部件是活塞。由化学反应释放的能量推动了活塞的运动,从而带动了其他力学部件的运动。肌球蛋白的力学功能主要是通过杠杆部分的摆动实现的。这个摆动需要通过与杠杆根部紧密结合的C区的运动来实现。与C区直接接触的主要是传递螺旋和SH1螺旋,这两个螺旋的另一端恰好与核酸结合位点直接接触,见图2。有一种观点认为,传递螺旋就是起活塞作用的力学元件。传递螺旋是一个特别长的螺旋结构,它与周围多个区域有广泛的接触。让这样长的螺旋结构像活塞那样发生整体移动所需的能量会很大,由ATP水解释放的能量能否满足其能量要求还不清楚。此外,要直接验证一个分子上的某个部分发生的构象变化是非常困难的事情。这种观点尽管很有道理,但要用实验直接验证还有很多困难需要克服。
关于肌球蛋白的运动机理的理解所面临的另一个困难的问题是肌动蛋白怎样影响肌球蛋白的行为。事实上,肌球蛋白的化学、力学行为都是与它的肌动蛋白轨道密不可分的,也就是说,这种精巧的力学装置是与它的轨道一起设计的。一个单独的肌球蛋白在没有肌动蛋白的情况下催化一个ATP分子的水解反应需要一分钟。在肌动蛋白微丝上它的催化能力会提高一千倍。ATP水解产物Pi的释放是肌球蛋白发力的关键步骤,肌动蛋白对这个释放过程有明确的影响。但是这种影响在分子水平上是如何实现的,目前还不十分清楚。
3 小结
肌肉是用蛋白质构造的巧妙的力学装置。蛋门质采用20种氨基酸组成了不同层次的结构,每一层次的结构都有着不同的生物学功能。蛋白质的构造和它的各种功能都是通过各种不同形式的相互作用实现的,这些相互作用包括化学键作用和各种非化学键的作用,比如氢键,疏水作用等等。对生命现象的科学的理解必须要以关于这些相互作用的定量的知识为基础。在有关分子马达的研究领域,人们正在逐步接近这个标准。
