表达绿色荧光蛋白的布鲁氏菌16M和M5侵染小鼠巨噬细胞过程的差异分析
2014-04-29马慧苟亚峰刘鹏涛高剑峰
马 慧 苟亚峰 刘鹏涛 高剑峰


摘要:通过布鲁氏菌(BrUcella) 16M(强毒株)和M5(弱毒株)进入小鼠巨噬细胞后产生的荧光强度,结合布鲁氏菌胞内生存能力分析二者侵染小鼠巨噬细胞过程的差异,为布鲁氏菌在细胞内的生存繁殖及其分子机制研究提供理论依据。将绿色荧光蛋白(green fluoreseent prolein. GFP)布鲁氏菌16M(强毒株)和M5 f弱毒株)分不同时间段侵染小鼠巨噬细胞(感染复数为100:1),通过胞内生存实验、激光共聚焦显微镜和流式细胞仪观察和检测布鲁氏菌侵入RAW 264.7过程的差异 结果表明,布鲁氏菌16M和M5和GFP的l6M和M5侵染RAW264.7的能力不受影响,通过流式细胞仪可以鉴别CFP布鲁氏菌,但是不能确定细菌的存活状。 结合布鲁氏菌16M和M5胞内生存能力分析发现CFP+细胞的增加与活菌培养计数法(colony forming unit,CGU)数量的减少存在一一对应的关系,并且在侵染初期(5~25 min) 16M与M5的荧光强度并没有显著差异。 结果提示,布鲁氏茵16M和M5在侵染进入宿主细胞的初期即侵袭能力并没有明显差异.认为造成毒力差异的主要原因是两者的繁殖能力。
关键词:布鲁氏菌;绿色荧光蛋白(CFP);小鼠巨噬细胞;激光共聚焦显微镜:流式细胞仪
中图分类号:Q38
文献标识码:A
文章编号:1007-7847(2014)05-0401-06
布鲁氏菌属于革兰氏阴性胞内菌,可以对人类和家畜造成严重的慢性感染。人若患有此病会经常发高烧.精神萎靡,嗜睡,关节炎和脾肿大。在反刍动物中,布鲁氏菌病可导致流产,造成巨大的经济损失。近几年的研究发现布鲁氏菌没有典型的外毒素、Ⅲ型分泌系统等毒力元件,其毒力主要表现在侵袭力和繁殖力。作为胞内寄生菌.它们既能在小鼠巨噬细胞生存,也能在非巨噬细胞(如滋养层细胞,上表皮细胞等)中生存,并且可以引起天然宿主网状内皮系统持续性感染。因此了解布鲁氏菌在细胞内的生存繁殖及其分子机制是理解布鲁氏菌致病性的关键。布鲁氏菌强毒株16M和疫苗株M5是两种典型胞内寄生菌,同属布鲁氏菌I型标准菌株,进入宿主后,能以不同方式逃避巨噬细胞的杀灭并在细胞内生存、繁殖,还能逃避体液免疫和抗生素的杀灭作用,使巨噬细胞反而成为庇护所,导致临床治疗困难。但就日前来说,对布鲁氏菌进入宿主胞内和繁殖机制还有很多未知。因此,通过含有GFP的载体pMC-221电转进入布鲁氏菌16M和M5,利用GFP布鲁氏菌侵染RAW 264.7进行流式细胞和胞内生存能力分析,对布鲁氏菌16M和M5侵染小鼠巨噬细胞过程的侵袭力和繁殖力比较,分析导致两者毒力差异的主要因素。
1 材料与方法
1.1 试验材料
1.1.1 菌种、细胞系和载体
布鲁氏菌标准强毒株16M和弱毒株M5、RAW 264.7系由新疆石河子大学人畜共患病实验室保存。载体pMC-221由美国威斯康星大学Jerome S.Harms博士惠赠。
1.1.2 主要试剂和仪器
布鲁氏菌液体和固体培养基均购白美国BD公司; DMEM培养基、胎牛血清购自美国Gibco公司:丙三醇、庆大霉素、青霉素、链霉素、过氧化氢均为国产试剂;PCR仪(Techne、Bl0 -RAD、Biometra); UV凝胶成像系统(BIO-RAD);超速离心机(Eppenclorf, centrifuge -5415D);恒温培养箱(DNP-9162);恒温摇床(7HWY-2102C),高速冷冻离心机(Sigma,2-16K);常温离心机(Beickmanmi-crofuge16、Thermo PC21);水浴锅(DKB-501A);全自动高压蒸汽灭菌罐;超低温冰箱;电泳仪:超净工作台;去离子水仪器(Thermo);电热恒温培养箱(DNP-9162型、EYELA SLI~700);电转仪(Eppen-dorr eporator);电击杯(eppendorf)。
1.2 方法
1.2.1 布鲁氏菌16M和M5的培养
将布鲁氏菌16M和M5接种到布鲁氏菌固体培养基上,封口置于37 ℃培养箱倒置培养3~5 d。挑取单菌落置于20 mL布鲁氏菌液体培养基中,置于37℃,180 r/min摇床振荡培养3~4d。
1.2.2 布鲁氏菌16M和M5电转化感受态细胞的制备
挑取布鲁氏菌16M和M5单菌落.分别至20 mL布鲁氏菌液体培养基中,180 r/min、37 ℃振荡培养24 h;转接50 μL菌液至100 mL布鲁氏菌液体培养基,培养16~18 h,取94μl_的菌液至无菌EP管中,取出布鲁氏菌16M和M5的菌液冰上放置30 min,期间摇动几次,保证冷却均匀;4 ℃ 8 000 r/min离心5 min,收菌;用20 mL预冷的去离子水重悬浮菌体,4 ℃ 8 000 r/min离心5 min,倒掉上清;重复卜一步3次;加入预冷的15 %甘油,加入的量为浓缩60~80倍;重悬菌体,分装,每管100 μL,置于-80℃保存。
1.2.3 电击转化
取pMC-221质粒f41(图1)9μL加入布鲁氏菌感受态细胞中,吹打混匀,冰上静置15 min,转移至l mm电击杯中,电击参数为1.8 kV/mm, 4.5 ms,1次脉冲。电击完成后立即加入37℃预热的900 μL的布鲁氏菌液体培养基,吹打均匀,转移到1.5 mLEP管中,封口膜封口,置于37 ℃, 180 r/min培养24 h。常温8 000 r/min离心2 min收菌,重悬菌体,涂布于氯霉素抗性的布鲁氏菌同体培养基上,置于37℃恒温培养箱培养3~5 d,挑出单菌落。挑取单菌落至含有1mL的布鲁氏菌液体培养基的EP管中,置于37℃ 、180 r/min振荡培养24h。取100μL菌液至1 mL的EP管中85 ℃金属浴灭活1 h。菌液PCR鉴定阳性克降菌。
1.2.4 巨噬细胞系RAW264.7培养和细胞计数
无菌条件下将细胞瓶内小鼠巨噬细胞经2.5%胰酶消化后,转移至6孔板中,孔内细胞培养液加至4mL,放人细胞培养箱,5% C02、37℃,24 h半量换液,培养2 d,备用。取六孔板中1孔,用300 μL 2.5%胰酶消化2 min,加1 mL培养液,用吸管吹打至完伞脱落,收集至1.5 mL离心管,2 000r/min离心2min,弃上清,加入lmL PBS,取10 μL至另一含90 μL PBS的1.5 mL离心管,稀释混匀,取10μL悬液滴在计数板上,细胞计数。1.2.5 布鲁氏茵16M和M5侵染小鼠巨噬细胞和菌液计数
取lμL经计数的菌液于50 mL离心管中,3 min 12 000 r/min,PBS洗3次,然后加19 mL无双抗、含10%胎牛血清的新鲜细胞培养液,重悬。按照布鲁氏菌与RAW 264.7的比例为100:1,麦氏比浊至所需浓度,稀释至1 mL重悬细菌液。弃去六孔板中旧完全培养基,加入重悬细菌液,放入细胞培养箱,5%CO2、37 ℃条件下分别培养5、10、20、30 min、I、1.5、2、2.5、6、12、24、48 h取出六孔板,PBS洗3遍,加入2 mL含20/c双抗、10%胎牛血清的新鲜细胞培养液,备用。
1.2.6 布鲁氏菌16M和M5的胞内存活实验
RAW 264.7传代至六孔板,分别编为16M组、M5组、GFP-16M组、CFP-M5组。培养至铺满六孔板底部,细胞计数。将布鲁氏菌16M和M5接种到20 mL的布鲁氏菌液体培养基中,180r/min,37℃恒温摇床培养至对数期。收菌,PBS反复重悬浮菌体。依照1.2.5步骤计算出的细胞与细菌比例
将布鲁氏菌加入到六孔板中,置于CO2浓度为5.0,37 ℃恒温培养箱培养。侵染l h之后六孔板中每孔加入2.5μL庆大霉素作用45 min,仪染4、8、12 h之后的小鼠巨噬细胞用PBS清洗3次,每次5 min;收集细胞接种密度为lxl0个,之后加入0.2%细胞裂解液lmL,用移液器将RAW264.7完全吹打混匀,释放出胞内菌。然后转移至1.5 mL的EP管中,冰浴处理5 min;然后按照10-1、10-2、10-3、10-4、10-5、10-6梯度稀释,移液器吹打均匀,然后每个梯度取100μL,均匀涂布至无抗性的布鲁氏菌固体培养基上,置于37℃恒温培养箱倒置培养,3~4 d,记录平皿中细菌的数量,每组实验重复3次。
1.2.7 布鲁氏菌16M和M5侵染RAW 264.7的激光共聚焦显微镜试验
将RAW 264.7传代至六孔板(盖玻片置于每孔中),分别编为Brucella组和过氧化氢Brucella组(盖玻片以备置于每孔中)每孔3 mL,放入细胞培养箱,5% C02、37℃条件下过夜培养(激光共聚焦显微镜试验中平铺在六孔板的数量最好维持在(1~lO)xl0 5/mL为最佳,细胞数量较多,平铺在6孔板中形成层叠,造成荧光重叠,对荧光观测有一定影响)。次日在六孔板中将已爬好细胞玻片用PBS浸洗3次,加入无双抗的培养液,备用;取1 mL经麦氏比浊法稀释的菌液加入每孔中,侵染时间分别为4 h:侵染完成后在过氧化氢Brucella组中加入过氧化氢.取出细胞爬片盖向滴有70%甘油的载玻片上,制片完成放入保湿盒,用于共聚焦显微镜观测.每组实验重复3次。
1.2.8 羊布鲁氏菌16M和M5侵染RAW 264.7的流式细胞仪试验
将RAW 264.7加入六孔板,放人细胞培养箱,5%CO2、37℃条件下过夜培养。次日取l mL经麦氏比浊法稀释的菌液加入每孔中,侵染时间分别为5 .10、15、20、25 min、6、12、24、48 h,根据侵染时问依次加入PBS吹打细胞收集放入1.5 mLEP管中,离心3min 12 000 r/min,去除PBS加入4%多聚甲醛和庆大霉素2.5μL吹打混匀,静止30 min,在侵染1 h后加入2.5μL,庆大霉素为了防止残留在胞外的细菌侵染细胞影响实验结果。之后用于流式细胞仪分析试验,每组实验重复3次,
2 结果
2.1 布鲁氏菌侵染之前RAW 264.7和茵量的计数结果
根据细胞计数方法得到细胞lxlO11/mL.按照细菌与细胞的MOI为100:1别需要细菌lxlO 8。利用麦氏比浊管将布鲁氏菌比浊稀释至1×lO8/mL。
2.2 布鲁氏菌侵染RAW 264.7激光共聚焦显微镜试验结果
按照图2A中显示结果来看,布鲁氏菌侵染进入RAW 264.7后产生CFP绿色荧光蛋白,未进入胞内的布鲁氏菌在胞外不产生绿色荧光。图2B结果显示来看,加入过氧化氢的目的是使小鼠巨噬细胞破裂死亡并杀死胞内布鲁氏菌,但是发现GFP没有因为RAW 264.7破裂被释放和伴随着布鲁氏菌的死亡而荧光强度受到影响。2.3 16M和M5侵染小鼠小鼠巨噬细胞的胞内生存能力实验结果
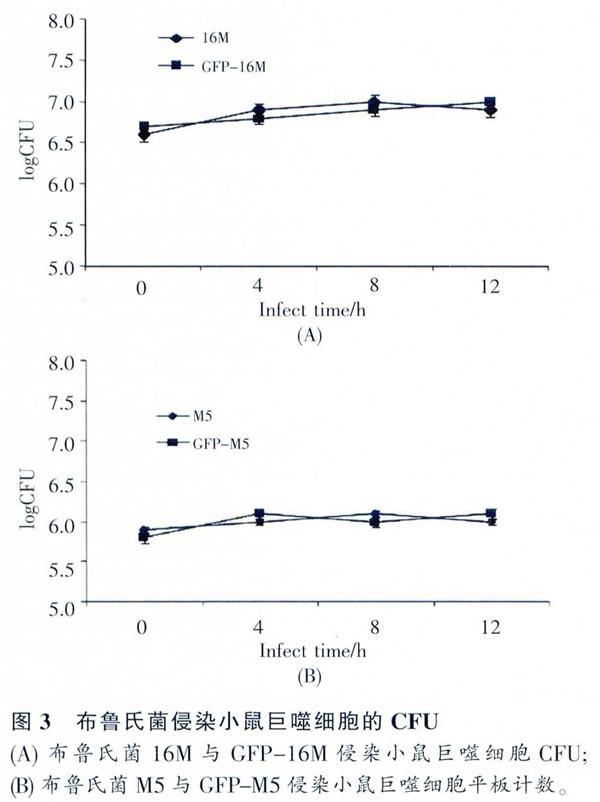
布鲁氏菌侵染小鼠巨噬细胞0~12 h的胞内菌CFU计数.从图3A、B可以看出,CFP布鲁氏菌16M和M5对比正常布鲁氏菌16M和M5在胞内生仔能力方面并没有影响。因此,GFP基因的整合重组并不会影响布鲁氏菌本身的生物特性。
2.4 16M和M5侵染小鼠巨噬细胞0—48 h流式细胞仪检测
图4A中结果得知含有GFP的布鲁氏菌16M和M5侵染小鼠巨噬细胞264.7在6—24 h内GFP+细胞百分数增长迅速,证明是细胞免疫强烈阶段、 24~48 h增长趋于平缓。图4B中我们可以看出在0—24 h之问CFU数量减少,24~48 h后逐渐增加。图3A、B结合分析发现GFP+细胞百分数与CFU数量在0~48 h之问有一一对应关系,图3A实验结果可以得出流式细胞仪通过GFP+细胞的百分数,反映含有GFP布鲁氏菌16M和M5进入小鼠巨噬细胞264.7的数量,但不能确定GFP布鲁氏菌进入宿主细胞后的存活状态,但通过胞内菌CFU计数,可以很好地弥补这一点。
2.5 16M和M5侵染初期小鼠巨噬细胞5—25min流式细胞仪检测
图5表示细菌侵染细胞的初级阶段,5 min时GFP+细胞数量少且可忽略不计,10 min时GFP+细胞逐渐增多但布鲁氏菌16M和M5之间的差异并不明显,经统计学检验无显著性差异(P>0.05),得知在侵染初期(5~25 min之内)布鲁氏菌16M和M5进入小鼠巨噬细胞的数量大致相同。
3 讨论
布鲁氏菌16M和M5虽同为I型布鲁氏菌,但至今对其致病机制没有更为深入的研究,目前,国内外主要集中在布鲁氏菌毒力因子和宿主因子的筛选及功能研究上,缺乏对布鲁氏菌16M和M5侵入、胞内存活、复制等过程的认识和差异比较。因此,本实验利用流式细胞仪对荧光的高敏感性,将含有GFP的布鲁氏菌16M和M5划分不同时间段侵染RAW 264.7得到的结果进行差异比较,经研究证实含有GFP的布鲁氏菌与不含有GFP的布鲁氏菌在侵染细胞和进入宿主细胞后生仔及繁殖能力上相同,因此用含有GFP的布鲁氏菌来侵染小鼠巨噬细胞不会干扰实验结果。从实验结果中我们得知0~24 h布鲁氏菌侵染细胞使得GFP+细胞百分数增长迅速,之后便达到饱和状态,增长缓慢;但通过CFU计数得知0—24 h布鲁氏菌16M和M5在胞内存活数量下降了15倍之多,说明大部分布鲁氏菌并没有逃脱内吞作用 24—48 h后细菌在胞内繁殖使得数量增加,但胞内布鲁氏菌16M与M5的数量差距也在不断增大。之后通过流式细胞仪测定仪染初期5—25 min时发现,布鲁氏菌16M和M5进入细胞的数量差距并不明显,反映出布鲁氏菌16M与M5进入细胞的侵入能力相同但胞内存活和复制的能力16M强于M5,因此认为二者产生差异的原因丰要是与胞内存活与复制有关。
