颈总动脉内膜损伤后的自噬现象☆
2014-04-28叶兰香余剑陈歆然龚琼丁乔廖松洁
叶兰香 余剑※ 陈歆然 龚琼 丁乔 廖松洁※
颈总动脉内膜损伤后的自噬现象☆
叶兰香*余剑*※陈歆然*龚琼△丁乔*廖松洁*※
目的观察颈总动脉内膜损伤后自噬的动态变化。方法40只雄性SD大鼠利用简单随机抽样法分为假手术组(n=20)和模型组(n=20)。假手术组依次分离颈部皮肤、皮下组织,暴露左侧颈总动脉后直接缝合皮肤,模型组行左侧颈总动脉内膜剥脱术。假手术组及模型组在3 d、7 d分别用western blot、免疫荧光检测颈总动脉中Beclin-1、微管相关蛋白1轻链3(microtubule associated protein 1 light chain 3,LC3)的表达;并在相同的时间点用western blot检测颈总动脉中P62的表达。结果western blot结果显示,与假手术组相比,模型组Beclin-1及LC3的表达于3 d、7 d增高,其中第7 d增高明显,自噬底物P62的表达于3 d、7 d下降,其中7 d下降显著。免疫荧光结果显示,与假手术组相比,模型组Beclin-1在颈总动脉中膜及内膜总的表达增高(第3 d 18.60± 1.34;6.40±0.55,P=0.000,n=5;7 d 27.6±2.19;6.40±0.55,P=0.000,n=5);模型组LC3在颈总动脉中膜及内膜总的表达增高(第3d 10.60±1.52;3.00±0.71,P=0.000,n=5;第7d 21.20±2.49;3.00±0.71,P=0.000,n=5)。结论模型组中调控自噬的Beclin-1蛋白以及自噬体形成所必需的LC3的表达增高,均表明自噬被激活,并于不同时间点呈动态变化,推测其可能参与新生内膜形成。
颈动脉 新生内膜 自噬LC3 Beclin-1
颈动脉狭窄是脑卒中的危险因素之一,颈动脉狭窄的手术治疗虽有助于降低颈动脉狭窄患者缺血性卒中的发病风险[1],但内膜损伤所致术后再狭窄严重影响了手术疗效[2]。大量表型改变的血管平滑肌细胞(vascular smooth muscle cells,VSMCs)在新生内膜中堆积是血管再狭窄的病理标志[3-4]。自噬作为是真核细胞维持自身稳态的重要方式,广泛存在于真核细胞的病理生理过程中[5]。在氧化应激、缺血、损伤等特定条件下自噬可迅速上调,主要表现为胞质内形成大量特征性双层膜结构的自噬体[6-7]。尽管血管内膜损伤所致氧化应激有可能上调自噬水平,而过度自噬导致自噬性死亡,可因而影响VSMCs的数量,但是至今为止,血管内膜损伤后自噬的变化及其与新生内膜的关系却并不清楚。本研究中,我们利用正常雄性SD大鼠制作颈总动脉内膜剥脱模型,模拟颈动脉狭窄手术的损伤后再狭窄的过程,观察自噬水平的动态变化。
1 材料与方法
1.1 动物模型采用体重为300~350 g雄性Sprague-Dawley(SD)大鼠(广东省动物实验监测所,许可证号:SCXK粤2009-0011)作为实验动物。按球囊扩张法制作颈总动脉内膜剥脱模型,腹腔注射10%的水合氯醛(0.35 mL/100 g)麻醉,颈部做正中切口,分离暴露颈总、颈内、颈外动脉,结扎颈外动脉远端,游离出甲状腺上动脉并结扎,防止渗血,动脉夹暂时夹闭颈内动脉和颈总动脉血流。于颈外动脉远端作一切口,将21F PTCA球囊导管从颈外动脉切口插入至颈总动脉,注入生理盐水后,反复旋出3次,撤出球囊导管,结扎颈外动脉近端,取下颈内动脉及颈总动脉血管夹,确认血流恢复及颈总动脉搏动良好后,缝合伤口。
1.2 血管取材术后3 d、7 d于麻醉状态下处死动物。取用于做蛋白半定量分析的材料时,用预冷的生理盐水经左心室灌注,冲出血管中的血液后取出双侧颈总动脉置于预冷的1.5 mLEP管中,立即投入液氮中急冻,随后取出放于—80℃冰箱备用。取切片用材料时,左心室灌注预冷生理盐水后,灌注4%多聚甲醛,取下双侧颈总动脉,置于4%多聚甲醛4℃浸泡固定6 h,然后加入20%、30%蔗糖4℃梯度脱水。将血管平均分为3段,按从远心端到近心端排列包埋于OCT中,从远心端到近心端行冰冻切片,片厚10 μm,间隔100 μm。
1.3 免疫荧光分析取片室温复温10 min,水化10 min,枸橼酸中火微波5 min修复抗原,0.01MPBS摇床洗5 min 3次,加入封闭液(博士德)室温封闭1 h后加入兔抗大鼠Beclin-1一抗(1:400,abcam)检测Beclin-1、兔抗大鼠LC3一抗(1:100 CST)检测LC3,4℃过夜,加入delight488标记的山羊抗兔荧光二抗(1:600联科)室温孵育1 h后0.01MPBS摇床洗5 min 3次,封片后于荧光显微镜下拍照,用ImageJ软件行定量分析。
1.4 Western blot检测检测Beclin-1、LC3、P62蛋白的表达水平,取出血管称重,按每100 mg组织加入1 mL裂解液(RIPA/PMSF=100/1碧云天),冰上研磨提取总蛋白并用BCA法测定蛋白浓度后配平,加入loading buffer,140℃恒温煮5 min变性蛋白后置于——80℃冰箱备用。分别取40 μg蛋白样品行SDS-PAGE电泳,300 mA恒流湿转至PVDF膜,5%脱脂奶粉室温封闭1 h,分别用兔抗大鼠Beclin-1一抗(1:500 CST)、兔抗大鼠LC3一抗(1:1000 sigma)、兔抗大鼠P62一抗(1:500 CST)及小鼠抗大鼠β-actin一抗(1:5000 sigma)于4℃孵育过夜。TBST洗膜3次,每次10 min。分别加入对应的山羊抗兔二抗(1:10000北京康为世纪)、山羊抗小鼠二抗(1:10000北京康为世纪)室温孵育1 h,TBST洗膜3次,每次10 min,随后以ECL化学发光显色后显影定影。ImageJ软件分析各条带的吸光度(A)值,计算Beclin-1A值、LC3Ⅱ/LC3Ⅰ值、P62 A值分别与β-actinA值的比值,分析各组Beclin-1、LC3、P62蛋白的相对表达水平。
1.5 统计学方法采用SPSS13.0统计软件对数据进行处理实验数据用(±s)表示。两组间比较使用Student t检验,多组间比较用one-way ANOVA。检验水准α=0.05。
2 结果
2.1 模型组Beclin-1蛋白表达上调在模型组中,颈总动脉的中膜、内膜Beclin-1蛋白的表达均上调,其中于中膜的表达在3 d达高峰、7 d时有所回落,而于内膜的表达在7 d显著(3 d时尚无内膜修复)(图1)。与假手术组相比,在3 d和7 d时,中膜与内膜中总的Beclin-1阳性细胞数增多(3 d 18.60±1.34;6.40±0.55,P=0.000,n=5;7 d 27.6±2.19;6.40±0.55,P=0.000,n=5)。Western blot定量分析显示,与假手术组相比,模型组在3 d、7 d Beclin-1蛋白表达水平显著上调,其中7 d增高更明显(P= 0.000,n=5.00),与免疫荧光结果相符(图2)。
2.2 模型组LC 3蛋白表达上调模型组中3 d、7 d免疫荧光检测LC3阳性细胞数显示,与假手术组(3.00±0.71,P=0.000,n=5)相比,模型组中3 d LC3阳性细胞数已经开始增加(10.60±1.52,P=0.000,n=5),7 d增加更明显(21.20±2.49,P=0.000,n=5)(图3),其中于中膜的表达在3 d达高峰、7 d时有所回落,而于内膜的表达在7 d显著(3 d时尚无内膜修复)。Western blot检测结果显示,与假手术组相比较,模型组3 d、7 d LC3蛋白水平显著上调,其中7 d增高更明显(P=0.000,n=5),与免疫荧光结果相符(图4)。
2.3 模型组中P62蛋白表达下降Western blot检测结果显示,与假手术组相比,模型组中3 d、7 d P62蛋白表达显著下降,其中7 d下降最显著(图5)。
3 讨论
缺血性脑卒中是脑血管疾病最重要的一种类型,其中约有15%~20%的缺血性脑卒中的发生是由于颅外颈内动脉狭窄导致[8]。自从1953年,DeBakey成功进行第一例颈动脉内膜切除术(carotid endarterectomy,CEA),随后在包括北美症状性颈动脉狭窄内膜切除术实验组(NASCET)、无症状颈内动脉粥样硬化研究组(ACAS)等多项多中心大宗临床试验证实,CEA对于有症状和无症状颈动脉粥样硬化性狭窄的患者预防和治疗脑卒中的短期和长期疗效已得到肯定[9-11],但是在术后一定时间会发生不同程度的再狭窄影响了手术疗效。有研究报道颈动脉再狭窄在术后36个月内的发生率可高达7.9%~14%,对之进行再次外科手术引起的二次再狭窄的风险仍高达6%~14%[2]。因此,预防CEA再狭窄是目前亟待解决的一大难题,但目前并没有非常有效的方法来预防CEA再狭窄。目前认为,内膜损伤后血管平滑肌的增殖、迁移以及细胞外基质的增生,这些因素是发生再狭窄的主要机制[12]。但内膜损伤后血管平滑肌的增殖、迁移以及细胞外基质的增生是受何种机制的调控并未完全阐明,此机制的阐明将为靶向治疗CEA再狭窄提供科学依据。
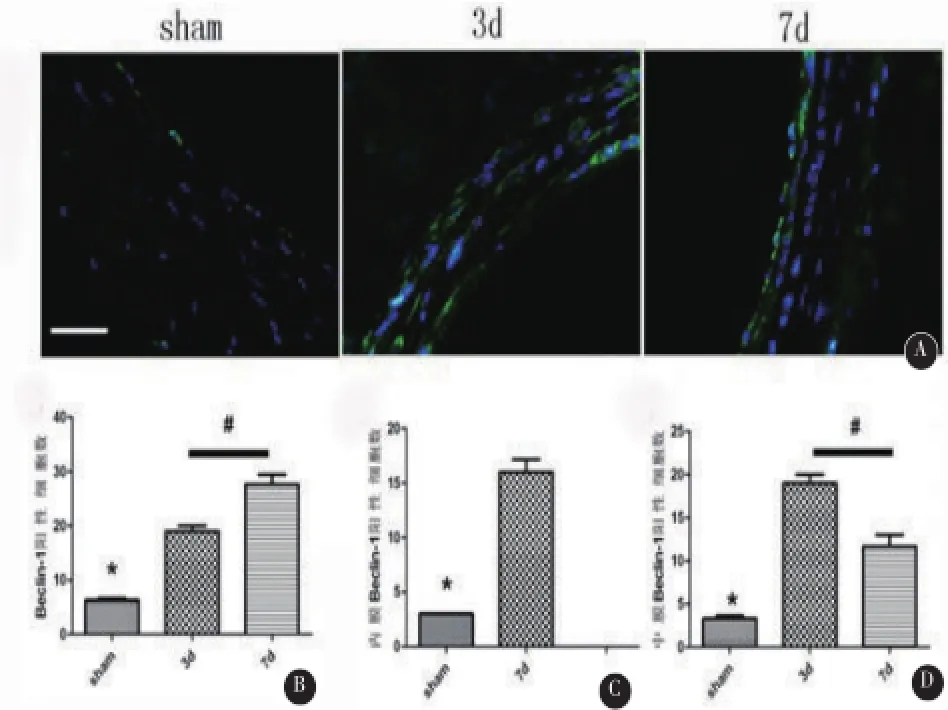
图1 Beclin-1蛋白在血管中膜、内膜的表达A:模型组中Beclin-1蛋白于中膜的表达在第3d时达高峰,在7 d有所回落,于内膜中的表达在7 d显著,800×,标尺=10 μm。B、C、D分别为Beclin-1阳性细胞在血管中膜和内膜、内膜、中膜中的定量分析。(*P=0.000与3 d组、7 d组相比,n=5;#P=0.000,3 d组与7 d组相比,n=5)

图2 模型组Beclin-1蛋白表达随时间变化的定量分析(*P=0.000假手术组与3 d、7 d相比,n=5;#P=0.000,3 d与7 d相比,n=5)

图3 LC3蛋白在血管中膜、内膜的表达A:模型组中第3d LC3蛋白于中膜的表达达高峰,术后7 d有所回落,于内膜中的表达在第7 d显著,800×,标尺=10μm。B、C、D分别为LC3阳性细胞在血管中膜和内膜、内膜、中膜中的定量分析(*P=0.000与3 d组、7 d组相比,n=5;#P=0.000 3 d组与7 d组相比,n=5)
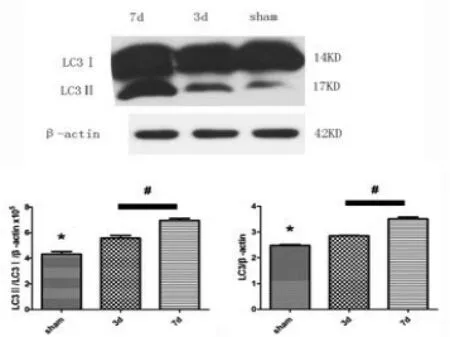
图4 模型组中LC3蛋白表达随时间变化的定量分析。(*P=0.000与3 d组、7 d天组相比,n=5;#P=0.0003 d组与7 d组相比,n=5)

图5 模型组中P62蛋白表达随时间变化的定量分析。(*P=0.000与3 d组、7 d组相比,n=5;#P=0.000 3d组与7d组相比,n=5)
血管内表面完整的内皮细胞能够抑制内膜的增厚,通过机械或化学性的方法损伤内膜促进病理性新生内膜的形成已成为研究血管再狭窄的动物实验方法,而球囊扩张法是复制颈总动脉内膜剥除模型的常用方法[13],本研究正是利用此法制备正常SD大鼠左侧颈总动脉内膜剥脱的动物模型,模拟CEA的手术过程,从而更好的研究颈动脉内膜切除术后再狭窄的发生和发展过程。
自噬是是溶酶体介导细胞”自我消化”细胞内容物的一系列生化过程[5]。在生理状态下,自噬活性保持在一个较低的基础水平,以维持细胞内环境的稳态和细胞功能的完整性,在特定的应激条件(饥饿,低氧,激素,感染)下,可以迅速上调,清除、降解细胞内受损的细胞结构、不需要的生物大分子、衰老的细胞器等,回收利用降解产物如氨基酸、核苷酸、脂肪酸等,促进受损细胞的重构,在细胞代谢中起重要作用[6-7]。然而,过度的自噬也会诱导细胞的死亡,因此自噬又称为Ⅱ型程序性死亡方式。自噬受多条信号通路的调节,Beclin-1-III型PI3K是其中一条通路,正性调节自噬水平,Beclin-1表达水平的上调,可促进自噬[14]。LC3是衡量自噬活性的的指标之一,分为LC3Ⅰ和LC3Ⅱ两型。LC3Ⅰ定位于胞质,LC3Ⅱ特异性定位于自噬体膜,参与自噬小体的形成,是自噬小体成熟的标志,其表达水平反应自噬活性的高低[15]。自噬活性增高时,LC3Ⅰ表达水平下降,LC3Ⅱ表达水平上升,故LC3Ⅱ/LC3Ⅰ比值升高可作为自噬活性增高的重要指标[16]。P62是自噬底物,偶联于LC3参与自噬体的构成,在自噬的中、晚期被降解,故P62水平的表达与自噬活性负相关[17]。在本研究中,在模型组,3 d就可观察到Beclin-1及LC3Ⅱ蛋白表达的升高,3 d Beclin-1及LC3B蛋白主要表达在血管中膜,这可能与血管内膜剥脱后,短时间内新生内膜还未生长出来。7 d Beclin-1及LC3蛋白表达就更显著,但这两种蛋白都主要表达在内膜中,这反应了在血管损伤后的修复过程中,不仅自噬的水平有上调,而且自噬发生的部位也从中膜逐渐向内膜转移,这提示内膜损伤后,在新生内膜的生长过程中伴随自噬活性的增高,其可能参与新生内膜的形成。自噬底物P62蛋白的表达正好相反,从另一方面证明了模型组中自噬活性的增高。另外,多种支架涂层药物都是通过抑制细胞增殖而减轻血管内膜损伤后新生内膜的形成,西罗莫司就是其中一种,但同时它也是一种自噬诱导剂,体外实验发现它能增加新生内膜VAMCs内自噬体数目,这提示西罗莫司有可能通过激活自噬水平,增加新生内膜VAMCs自噬性死亡,从而达到减轻新生内膜的形成,这从另一方面间接支持自噬可能参与到了新生内膜的形成过程[18-19]。
本研究初步探讨了颈总脉内膜损伤模型中不同时间段自噬活性的变化,发现不仅自噬水平有变化,而且自噬活跃的部位也从中膜逐渐向内膜转移,提示在内膜形成过程中伴随着自噬水平的升高,自噬可能参与了新生内膜的形成,不足之处是未能深入研究自噬活性变化对新生内膜形成的影响的机制,但是为进一步研究自噬在颈总动脉内膜剥脱后新生内膜的形成作用上提供了一定的研究依据。
[1] CAVATAS investigators.Endovascular versus surgical treatmentin patients wit-h carotid stenosis in the Carotid and VertebralArteryTransluminal Angioplasty Study(CAVATAS):a randomizedtrial[J].Lancet,2001,357(9270):1729-1737.
[2] Bettendorf MJ,Mansour MA,Davis AT,et al.Carotidangioplastyandstentingvers-us redo endarterectomy for recurrentstenosis [J].AmJ Surg,2007,193(3):356-359.
[3] Schwartz SM.The intima:A newsoil[J].Circ Res,1999,85(10):877-879.
[4] Orford JL,Selwyn AP,Ganz P,et al.Thecomparativepathobiologyofatherosclerosi-s and restenosis[J].AmJ Cardiol,2000,86(4B):6H-11H.
[5] Orenstein SJ,CuervoAM.Chaperone-mediated autophagy:molecular mechanism-sand physiological relevance[J].SeminCellDevBiol,2010,21(7):719-726.
[6] Kaminskyy V,Zhivotovsky B.Proteases in autophagy[J].BBAProteinsProteo-m,2012,1824(1):44-50.
[7] Levine B,Kroemer G.Autophagy in the pathogenesis of disease [J].Cell,2008,132(1):27-42.
[8] Chaturvedi S,Bruno A,Feasby T,et al.Carotid endarterecto my-an evidence-based review:report of the Therapeutics and Technology Assessment Subcommittee of the American Academy of Neurology[J].Neurology,2005,65(6):794-801.
[9] EliasziwM,Streifler JY,Fox AJ,et al.Significance of plaque ulceration in sy-mptomatic patients with high-grade carotid stenosis.NorthAmericanSymptomatic C-arotidEndarterectomy Trial [J].Stroke,1994,25(2):304-308.
[10] European Carotid Surgery Trialists’Collaborative Group.MRCEuropeancarot-id surgery trial:interimresults for symptomaticpatients with severe(70%~99%)o-r with mild(O%~29%)carotid stenosis[J].Lancet,1991,337(8752):1235-1243.
[11] The Executive Committee for the Asymptomatic CarotidAtherosclerosisStudy.E-ndarterectomy for asymptomatic carotid arterystenosis[J].JAMA,1995,273(18):1421-1428.
[12] Bennett MR.In-stent stenosis:pathology and implications for thedevelopment of drug eluting stents[J].Heart,2003,89(2): 218-224.
[13] Jagadeesha DK,Lindley TE,Deleon J,et al.Tempol therapy attenuates medial smo-oth muscle cell apoptosis and neointimaformation after balloon catheter injury in caro-tid artery ofdiabetic rats[J].AmJ Physiol Heart CircPhysiol,2005,289(3):H1047-1053.
[14] Yang ZF,Klionsky DJ.Eaten alive:a history of macroautophagy [J].Nat Cell Biol,2010,12(9):814-822.
[15] Mizushima N.Methods for monitoring autophagy[J].IntJBiochemCell Biol,2004,36(12):2491-2502.
[16] KarimMR,Kanazawa T,Daigaku Y,et al.CytosolicLC3 ratio as a sensitive index of macroautoPhagy in isolated rat hepatocytes and H4-11-E cells[J].AutoPhagy,2007,3(6):553-560.
[17] Kirkin V,McEwan DG,Novak I,et al.A role for ubiquitin in selective autophagy[J].Molecular cell,2009,34(3):259-269.
[18] Hayashi S,Yamamoto A,You F,et al.The stent-eluting drugs sirolimus and pacl-itaxel suppress healing of the endotheliumby induction of autophagy[J].AmJ Pat-hol,2009,175(5): 2226-2234.
[19] Dichtl W,Stocker EM,Mistlberger K,et al.Countervailing effects of rapamycin(sirolimus)on nuclear factor-kappa b activities in neointimal and medial smooth muscl-ecells[J].Atherosclerosis,2006,186(2):321-330.
The dynamic changes of autophagy in carotid artery after balloon in jury in rats.
YE Lanxiang,YU Jian, CHEN Xinran,GONG Qiong,DING Qiao,LIAO Songjie.The Department of Neurology,the First AffiliatedHospital of Sun Yat-sen University,58 Zhongshan II Rd,Guangzhou 510080,China.Tel:020-87616221.
ObjectiveTo investigate the dynamic levels of autophagy after intimal injury of carotid artery.MethodsIn this study,40 male SD rats were randomly assigned to operated(n=20)and control groups(n=20).Balloon injury was induced in the left carotid artery in operated groups.Rats in control groups just received carotid artery exposure without injury.Western blot was used to detect the levels of Beclin-1,LC3 and p62 at the third and seventh days.Immunofluorescence was used to examine the expression of Beclin-1 and LC3 at the third and seventh days.ResultsThe expression levels of Beclin-1 and LC3 were increased while the levels of P62 were decreased at the third and seventh days after carotid balloon injury.Beclin-1 and LC3 were present in neointima and medintima.The numbers of both Beclin-1 positive cells and LC3 positive cells were increased at the third and seventh days after carotid injury.The numbers of Beclin-1 positive cells were 18.60±1.34 in neointima and 6.40±0.55 in medintima at third day,(27.6±2.19 in neointima and 6.40±0.55 in medinitima at the seventh day,(all P=0.000,n=5).The numbers of LC3 positive cells were 10.60±1.52 in neointima and 3.00±0.71 in medintima at third day,(P=0.000,n=5;at the seventh day 21.20±2.49;3.00±0.71,P= 0.000,n=5).ConclusionsThis study domenstrates that autophagy was activated after carotid injury and the chang is dynamic,which may contribute to neointima formation.
Carotid artery neointima Autophagy LC3 Beclin-1
R743.3
A
2013-11-27)
(责任编辑:李立)
10.3936/j.issn.1002-0152.2014.07.006
☆国家自然科学基金青年科学基金项目(编号:81100871);中大青年教师培育基金项目(编号:13ykpy16);国家自然科学基金面上项目(编号:81371276)
*中山大学附属第一医院神经内科(广州510080)
※广东省重大神经疾病诊治研究重点实验室;卫生部国家临床重点专科;教育部国家重点专科
△广东省第二人民医院
