[11C]CFT脑多巴胺转运体PET显像对帕金森病诊断和严重程度评估的应用☆
2014-04-28冼文彪史新冲张祥松江璐璐刘妍梅郑一帆唐刚华裴中黎锦如刘焯霖陈玲
冼文彪 史新冲 张祥松 江璐璐 刘妍梅 郑一帆 唐刚华 裴中 黎锦如 刘焯霖 陈玲
[11C]CFT脑多巴胺转运体PET显像对帕金森病诊断和严重程度评估的应用☆
冼文彪*史新冲△张祥松△江璐璐*刘妍梅*郑一帆*唐刚华△裴中*黎锦如*刘焯霖*陈玲*
目的探讨[11C]CFT脑多巴胺转运体(dopamine transporer,DAT)正电子发射断层显像(positron emission tomography,PET)在帕金森病(Parkinson disease,PD)诊断和病情严重度评估的应用价值。方法对38例PD患者进行[11C]CFT PET显像,分析[11C]CFT PET和帕金森病统一评分量表第三部分(unified Parkinson disease rating scale partⅢ,UPDRSⅢ)评分的相关性。采用统计参数图(statistical parametric mapping,SPM)比较早、晚期PD患者DAT分布的差异。结果PD患者双侧纹状体[11C]CFT摄取值显著降低。纹状体[11C]CFT摄取值与PD患者UPDRSⅢ、强直、运动迟缓、姿势、步态评分均呈显著负相关。早期PD患者纹状体DAT分布呈双侧不对称降低,起病对侧壳核、尾状核均显著降低,起病同侧以壳核外侧部降低为主。晚期PD患者纹状体DAT分布呈对双侧称性显著降低,与早期PD组相比,DAT逐渐发展至起病同侧壳核和双侧尾状核进一步降低。结论[11C]CFT PET显像是PD诊断、病情严重程度评估一个良好指标。
帕金森病 正电子发射断层显像 多巴胺转运体[11C]CFT
目前对帕金森病(Parkinson disease,PD)的诊断主要依据患者的症状、体征以及对左旋多巴制剂治疗反应等指标进行综合评价,但由于出现PD症状时黑质多巴胺能神经元脱失往往已经达到50%~80%,因此对PD患者进行早期诊断十分困难[1]。对PD病情严重程度的评估也缺乏一个可靠的客观评价指标,目前最常采用相关量表进行评估,但其结果容易受评估者主观因素及患者服药情况的影响。正电子发射断层显像(positron emission tomography,PET)借助分子成像技术,能够活体显像,在PD诊断和病情监测方面发挥着日益重要的作用[2]。[11C]-甲基-2-β-甲基酯-3-β-(4-F-苯基)托烷([11C]-labeled 2-β-carbomethoxy-3-β-(4-fluorophenyl)tropane,[11C]CFT)PET显像对脑多巴胺转运体(dopamine transporer,DAT)的检测是早期诊断PD的一种重要技术[3],CFT示踪剂高特异性地与多巴胺转运体(dopamine transporter,DAT)结合,同时与5-羟色胺、去甲肾上腺素受体结合率低,故CFT PET显像受患者服药因素的影响较少[3],广泛应用于PD的临床研究。本研究采用[11C]CFT PET显像对不同病情程度的PD患者进行研究,探讨其在PD临床诊断和病情严重评估的应用价值。
1 对象与方法
1.1 研究对象搜集2009年10月至2013年10月在我院PET中心进行脑[11C]CFT PET显像的PD患者。入选标准:原发性帕金森病,符合2006年我国帕金森病诊断标准[4]。排除标准:①非原发性帕金森病;②合并脑卒中、头颅外伤及颅脑手术等脑部疾病。共纳入PD患者38例,其中男20例,女18例,平均年龄为(56.2±10.2)岁,平均病程为(7.0±5.4)年。根据Hoehn&Yahr(H&Y)分级评分进一步将PD患者分成严重程度不同的两组[5]:H&Y评分1~2的17例患者纳入为早期PD组,H&Y评分3~5的21例患者纳入为晚期PD组。同时选取年龄匹配的健康受试者9名作为正常对照组,其中男5例,女4例,平均年龄(60.1±11.7)岁。PD患者和正常对照组年龄分布无统计学差异。
1.2.1 临床资料收集 采用帕金森病统一评分量表(unified Parkinson disease rating scale,UPDRS)中第三部分的运动评分(UPDRSⅢ)和H&Y分级评分对纳入研究的帕金森病患者进行评分,评分均在未服药状态下(停用抗帕金森药物至少12 h)进行,该两项评分分值越大提示症状越严重。
1.2.2 PET扫描 [11C]CFT示踪剂按照本中心报道的自动化控制方法进行合成[3]:以[11C]C02为原料(比利时IBA公司Cyclone10/5回旋加速器生产),与氢化铝锂(lithiumaluminumhydride,LiAlH)生成盐,经水解再与碘化氢(hydrogen iodide,HI)反应生成[11C] CH3I,经过Ag-Triflate/C转化柱生成Triflate-[11C] CH3,最后与前体nor-β-CFT进行甲基化反应合成[11C]CFT,用无水乙醇洗脱,经无菌滤膜过滤后备用。高效液相色谱法(high performance liquid chromatography,HPLC)测定其放化纯度>95%。
所有PD患者PET检查前停用抗帕金森药物至少12 h[6]。显像设备为飞利浦Gemini GXL 16型PET/CT扫描仪,扫描时采用专用的头部扫描程序进行,首先进行脑部诊断剂量CT扫描(120 kV,250 mAs),用于PET图像的衰减矫正和融合定位。受检者注射[11C]CFT(平均185-370 MBq)后进行PET显像,PET扫描以3D模式进行,扫描视野(field of view,FOV)为180 mm,于静脉注射显像剂后1 h进行采集,采集时间为25~30 min,最后利用3D RAMLA重建算法进行图像重建,得到分辨率为2 mm×2 mm×2 mm的脑部PET图像。采用半定量分析的方式对纹状体[11C]CFT摄取指数进行分析。感兴趣区(regions of interest,ROIs)的勾勒在PET工作站的融合图像上进行,首先在CT图像上选择3层纹状体显示最为清晰的层面,在每个层面上勾勒出双侧壳核和尾状核,并分别计算出左、右侧壳核和尾状核的放射性平均计数。考虑到小脑(cerebellum,CB)内无DAT分布,本研究选用小脑作为参考区域,选取小脑的3个连续层面,在每个层面上放置半径为20 mm的感兴趣区,并计算其平均放射性计数。以尾状核、壳核3层ROI的平均值进一步计算(ROI-CB)/CB比值获得这些区域的CFT特异性放射性摄取值,以此反映这些区域DAT的数量和功能。
1.2.3 统计参数图分析(statistical parametric mapping,SPM) 应用SPM8分析软件(Well come Depar tment ofCognitive Neurology,London,UK.)进行数据分析。首先以小脑区域ROI的平均放射性计数值生成容积比值图像(全脑/小脑),用12参数的线性仿射变换和非线性迭代法,将生成的每个比值图像对应到标准Talairach脑空间坐标上;然后用6 mm×6 mm×6 mm的高斯算子进行平滑,以去除图像中的高频噪声;最终获得矩阵大小为79×95× 69,像素为2 mm×2 mm×2 mm的脑三维数据。然后利用单因子方差分析模型分别对早、晚期PD组以及对照组进行组间分析(统计学差异水准为P<0.01),检验结果利用MRIcro软件(Version1.40)按蒙特利尔神经病学研究所(Montreal Neurological Institute,MNI)的脑图谱(MNI; http://www.bic.mni.mcgill.ca)进行处理,叠加在标准脑MRI T1加权图像上。为增加数据的可比性及减少统计误差,我们研究将PD患者临床症状起病(肢体)对侧脑区定义在标准头颅MRI模板的左侧,起病(肢体)同侧脑区定义在标准头颅MRI模板的右侧。
1.3 统计学方法应用SPSS13.0版统计软件对试验数据进行统计分析,将相应脑区对[11C]CFT的特异性放射性摄取值与患者的临床症状严重程度评分进行Pearson相关分析,如果存在显著相关性,则进一步计算出相关系数r。两组均数之间比较采用t检验;多组间均数比较先进行方差分析,再采用SNK法(即q检验法)进行两组之间比较。P<0.05为差异有统计学意义。
2 结果
38例PD患者平均H&Y分级评分(药物关期)为(2.6±1.0),UPDRSⅢ运动评分(药物关期)为(40.6±18.9)分,其中震颤评分为(4.8±4.3)分,强直评分为(8.6±4.6)分,运动迟缓评分为(15.6±5.7)分,姿势评分(3.0±1.9)分,步态评分(1.7±0.9)分。
PD患者壳核、尾状核[11C]CFT摄取值较正常对照组显著减低(见表1)。PD患者壳核、尾状核平均[11C]CFT摄取平均值分别为降低至正常对照组的53.7%、68.2%。PD患者的壳核、尾状核[11C]CFT摄取值同时存在以下特点:晚期患者比早期患者显著降低,起病对侧脑区比起病同侧脑区显著降低。其中5例PD患者仅表现为单侧肢体症状,对侧肢体无运动症状。该5例患者起病对侧壳核、尾状核[11C]CFT摄取值分别为:(1.91±0.28)(降低至正常组57.0%),(2.32±0.23)(降低至正常组83.8%);起病同侧(“健”侧脑区)壳核、尾状核[11C]CFT摄取值分别为:(2.38±0.43)(降低至正常组71.0%),(2.64± 0.21)(降低至正常组95.3%)。PD组壳核/尾状核[11C]CFT摄取值相对比(壳/尾比值)较正常对照组显著减低;壳/尾比值在PD组起病对侧与起病同侧之间,以及不同病情分期之间没有显著统计学差异(见表1)。壳核、尾状核[11C]CFT摄取值与年龄、病程、H&Y分级均存在显著负相关性,也与UPDRSⅢ运动评分以及强直、运动迟缓、姿势、步态等运动亚评分存在显著负相关。纹状体[11C]CFT摄取值与震颤评分无显著相关性(见表2)。

表1 PD患者和正常对照组纹状体[11C]CFT摄取值
SPM分析提示,早期PD组与正常对照组相比,双侧纹状体[11C]CFT摄取较正常对照组显著减低(两侧呈不对称性),起病对侧壳核、尾状核均显著减低,起病同侧以壳核外侧部减低为主(P<0.01)(图1-A)。晚期PD组与正常对照组相比表现为双侧壳核、尾状核[11C]CFT摄取呈对称性显著减少(P<0.01)(图1-B)。晚期PD组与早期PD组比较,晚期PD组表现为起病对侧壳核和双侧尾状核[11C]CFT摄取值较早期PD组进一步减低(P<0.01)为主(图1-C)。
3 讨论
目前,PD的诊断和病情评估主要依靠医生的临床经验,尚缺乏良好的生物学指标。然而,大多数PD患者早期临床症状不典型,很难在早期确诊,从而导致不少患者误诊以及错失治疗时机。我们早期采用SPECT研究表明DAT显像可作为早期PD诊断的敏感指标[7]。PET显像借助分子成像的特点,能够在活体内对与疾病发生、发展密切相关的生物学标志物进行检测,相比于SPECT显像,PET显像具有更高的空间分辨率和图像质量,在PD的临床应用越来越得到重视。
本研究采用[11C]CFT PET显像发现PD患者壳核、尾状核DAT减少至正常对照组的53.7%、68.2%,与国外DAT PET显像研究文献报道结果大致相仿[9-10],其中部分差异可能与病例选择、DAT显像示踪剂及图像后处理不同有关。我们同时对5例单侧症状患者分析发现,不仅起病对侧纹状体[11C]CFT摄取值显著低于正常对照组,而且起病同侧(“健”侧脑区)纹状体[11C]CFT摄取值也显著低于正常对照组,提示[11C]CFT PET能发现PD临床症状前期纹状体DAT变化,可作为PD早期诊断的灵敏指标。我们研究也发现PD组壳核/尾状核摄取值相对比较正常对照组显著降低,在不同疾病分期壳核DAT摄取值均比尾状核下降更明显,Nurmi E等[10]应用[18F]CFT PET研究结果也显示PD患者壳核DAT下降较尾状核明显,而帕金森叠加综合征患者研究报道却是尾状核DAT下降比壳核明显[11-12]。因此,壳核/尾状核DAT摄取值之比下降可能是PD与其他帕金森叠加综合征鉴别的指标之一。
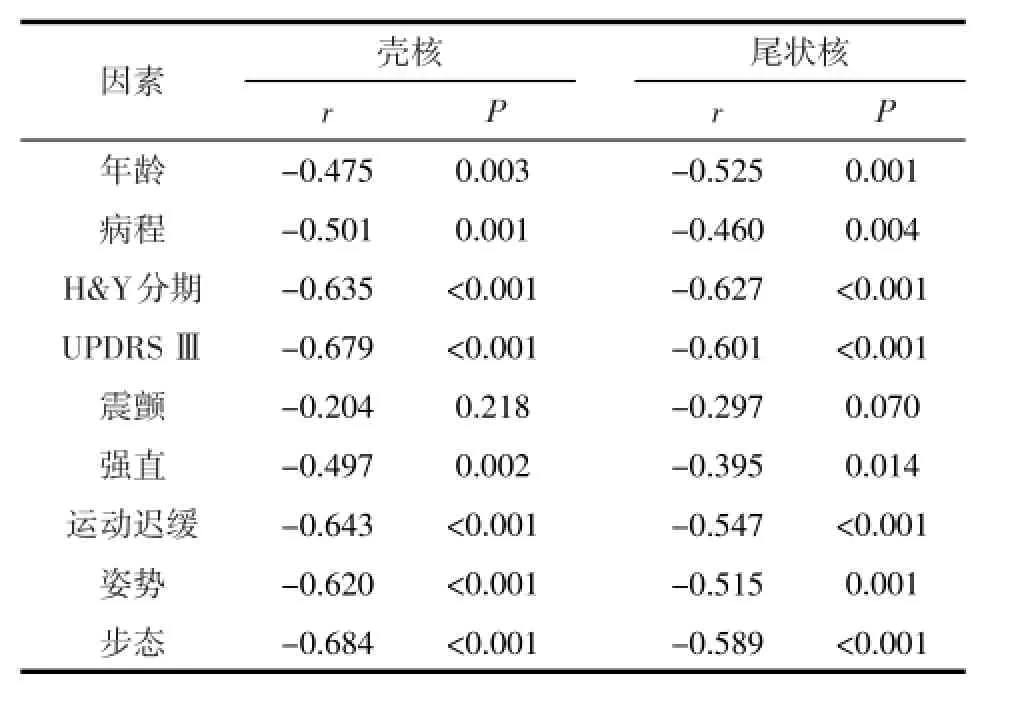
表2 纹状体[11C]CFT摄取值与临床评分的相关性分析
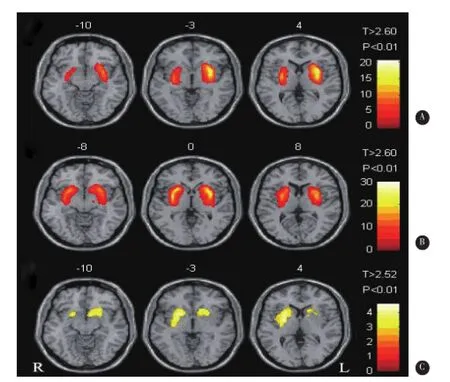
图1 不同组别[11C]CFT图像SPM分析L:起病对侧;R:起病同侧图A:(早期PD组与正常对照组比较):早期PD组双侧纹状体DAT不对称性显著减低,起病对侧壳核、尾状核均减低,起病同侧以壳核外侧部减低为主;图B:(晚期PD组与正常对照组比较):晚期PD组双侧纹状体DAT呈对称性显著减低;图C:(晚期PD组与早期PD组比较):晚期PD组主要发展至起病同侧壳核和双侧尾状核DAT进一步减低
我们进一步采用SPM技术对[11C]CFT PET图像分析提示,早期PD患者较正常对照组主要表现为以早期PD组双侧纹状体DAT较正常对照组显著减低,呈不对称性。起病对侧壳核、尾状核均显著减低,起病同侧以壳核外侧部减低为主。本研究进一步发现晚期与早期PD患者相比逐渐发展至起病同侧壳核及双侧尾状核[11C]CFT进一步减少,因此PD患者DAT的减少特点为双侧不对称,最早开始减少部位从脑部外侧的壳核,逐渐发展至靠近脑部中线的尾状核。
尾状核、壳核DAT摄取值与年龄呈明显的线性负相关关系,这表明纹状体的DAT多巴胺代谢水平随年龄增长逐渐降低,这与Troiano等[13]的研究一致。动物研究表明,DAT与神经突触多巴胺递质水平[14]以及黑质残存多巴胺能神经元[15]显著相关,能准确地反映黑质纹状体多巴胺能神经元的功能完整性,可以作为PD早期诊断的一个良好标尺[16]。本研究[11C]CFT PET显像均在患者未服药12 h后进行,在药物洗脱期后更能准确地反映实际的疾病严重程度。研究结果显示尾状核、壳核DAT摄取值与患者病程、H&Y分级和UPDRSⅢ评分均存在密切的负相关性,与强直、运动迟缓、姿势、步态的评分也存在良好的负相关性。因此DAT PET显像可以作为追踪PD病情进展及评估各种治疗手段疗效的一个指标。本研究提示纹状体DAT摄取值与震颤无显著相关性,我们临床也发现许多严重的帕金森病患者震颤不明显甚至没有震颤,故震颤与病情严重程度不存在明显的相关性。
我们的PET研究发现脑部纹状体DAT摄取值和运动症状评分以及H&Y分级评分存在明显的负相关性。[11C]CFT DAT PET显像不仅有助于PD早期的临床诊断,对PD患者病情严重程度的评估也有重要的作用。因此,多巴胺转运体PET显像不但可以作为PD诊断的敏感指标,而且可以运用于评估患者的病情严重程度以及监测疾病的进展。
[1] Braak H,Del Tredici K.Invited Article:Nervous systempathology in sporadic Parkinson disease[J].Neurology,2008,70(20): 1916-1925.
[2] Wu YC,Le W,Jankovic J.Preclinical biomarkers of Parkinson disease[J].Arch Neurol,2011,68(1):22-30.
[3] Huang T,Wang H,Tang G,et al.The influence of residual nor-β-CFT in 11C CFT injection on the Parkinson disease diagnosis:a 11C CFT PET study[J].Clin Nucl Med,2012,37(8): 743-747.
[4] 中华医学会神经病学分会运动障碍及帕金森病学组.帕金森病的诊断[J].中华神经科杂志,2006,39(6):408-409.
[5] Wang J,Zuo CT,Jiang YP,et al.18F-FP-CIT PET imaging and SPManalysis of dopamine transporters in Parkinson's disease in various Hoehn&Yahr stages[J].J Neurol,2007,254(2): 185-190.
[6] Bohnen NI,Gedela S,Kuwabara H,et al.Selective hyposmia and nigrostriatal dopaminergic denervation in Parkinson's disease[J].J Neurol,2007,254(1):84-90.
[7] 陈玲,胡平,黎锦如,等.脑多巴胺转运体SPECT显像鉴别早期帕金森病与原发性震颤[J].中华神经科杂志,2003,36 (6):414-417.
[8] Shyu WC,Lin SZ,Chiang MF,et al.Early-onset Parkinson's disease in a Chinese population:99mTc-TRODAT-1 SPECT, Parkin gene analysis and clinical study[J].ParkinsonismRelat Disord,2005,11(3):173-l80.
[9] Kas A,Payoux P,Habert MO,et al.Validation of a standardized normalization template for statistical parametric mapping analysis of 123I-FP-CIT images[J].J Nucl Med,2007,48(9): 1459-1467.
[10] Nurmi E,Bergman J,Eskola O,et al.Progression of dopaminergic hypofunction in striatal subregions in Parkinson's disease using[18F]CFT PET[J].Synapse,2003,48(3):109-115.
[11] El Fakhri G,Habert MO,Maksud P,et al.Quantitative simultaneous(99m)Tc-ECD/123I-FP-CIT SPECT in Parkinson's disease and multiple systematrophy[J].Eur J Nucl Med Mol Imaging,2006,33(1):87-92.
[12] Scherfler C,Seppi K,Donnemiller E,et al.Voxel-wise analysis of[123I]beta-CIT SPECT differentiates the Parkinson variant of multiple systematrophy fromidiopathic Parkinson's disease[J]. Brain,2005,128(Pt 7):1605-1612.
[13] Troiano AR,Schulzer M,de la Fuente-Fernandez R,et al.Dopamine transporter PET in normal aging:dopamine transporter decline and its possible role in preservation of motor function[J]. Synapse,2010,64(2):146-151.
[14] de la Fuente-Fernández R,Sossi V,McCormick S,et al.Visualizing vesicular dopamine dynamics in Parkinson’s disease[J]. Synapse,2009,63(8):713-716.
[15] Sossi V,Dinelle K,Topping GJ,et al.Dopamine transporter relation to levodopa-derived synaptic dopamine in a rat modelof Parkinson’s:an in vivo imaging study[J].J Neurochem,2009, 109(1):85-92.
[16] Stiasny-Kolster K,Doerr Y,Moller JC,et al.Combination of'idiopathic'REMsleep behaviour disorder and olfactory dysfunction as possible indicator for alpha-synucleinopathy demonstrated by dopamine transporter FP-CIT-SPECT[J].Brain,2005, 128:126-137.
Application of[11C]CFT dopamine transporter PET imaging in the diagnosis and severity assessment of Parkinson disease.
XIAN Wenbiao,SHI Xinchong,ZHANG Xiangsong,JIANG Lulu,LIU Yanmei,ZHENG Yifan,TANG Ganghua,PEI Zhong,LI Jinru,LIU Zhuolin,CHEN Ling.Department of Neurology,National Key Clinical Department, National Key Discipline,Guangdong key laboratory for diagnosis and treatment of major neurological diseases,The First Affiliated Hospital of Sun Yat-sen University,58 Zhongshan RoadⅡ,Guangzhou 510080.Tel:020-87332200-8253.
ObjectiveTo investigate the clinical value of[11C]CFT PET in the diagnosis and severity assessment of Parkinson disease(PD).MethodsThirty-eight patients with PD at various Hoehn&Yahr(H&Y)stages were included and underwent a[11C]CFT PET scan.The correlation between[11C]CFT uptake and unified Parkinson disease rating scale part III(UPDRS III)of PD patients was evaluated by calculating Pearson’s regression coefficient.Statistical parametric mapping(SPM)analysis was performed to compare the difference of dopamine transporter(DAT)distribution between early and advanced PD patients.ResultsThere was a significant reduction of[11C]CFT uptake in the bilateralstriatumof PD patients.There was a significant negative correlation between clinical scores of UPDRS III,rigidity,bradykinesia,posture,gait and[11C]CFT uptake in the striatum.The SPManalysis revealed a significant and asymmetric decrease of[11C] CFT uptake in the striatum,predominantly on the putamen and caudate nucleus contralateralto the onset limb,in the posterior area of ipsilateralputamen in early PD(H&Y 1-2)patients compared with the normal controls.There was a significant symmetric decrease of[11C]CFT uptake in both putamen and caudate nucleus in advanced PD(H&Y 3-5)patients,compared with normal controls.Compared with early PD patients,the reduction of DAT was more severe in bilateral caudate nucleus and the ipsilateral putamen in the advanced PD patients.Conclusions[11C]CFT PET is a sensitive biomarker in the diagnosis and assessment of disease severity of PD patients.
Parkinson's disease Positron emission tomography Dopamine transporter[11C]CFT
R742.5
A
2014-02-13)
(责任编辑:李立)
10.3936/j.issn.1002-0152.2014.08.006
☆广东省自然科学基金资助项目(编号:10151008901000187);广东省科技计划项目(编号:2006B36004021,2006B60501023,2010B080701107)
*中山大学附属第一医院神经科,教育部国家重点学科,卫生部国家临床重点专科,广东省重大神经疾病诊治研究重点实验室
△中山大学附属第一医院核医学科
