转录因子2基因单核苷酸多态性对瑞格列奈和罗格列酮疗效的影响
2014-04-28高凌一贾伟平
高凌一,胡 承,陈 淼,江 枫,张 蓉,杨 静*,贾伟平
(1山西医科大学第一医院内分泌代谢科,太原 030001;2上海交通大学附属第六人民医院内分泌代谢科,上海市糖尿病研究所,上海市糖尿病重点实验室,上海市糖尿病临床医学中心,上海 200233)
患者对于药物治疗的反应存在个体间差异。除了致病原、疾病严重程度、药物相互作用、年龄、营养情况、肝肾功能,伴发疾病等因素能够影响药物反应之外,遗传因素在其中也发挥相当重要的作用。药物基因组学(pharmacogenomics)是在药物遗传学(pharmacogenetics)基础上发展起来的新学科,研究个体对药物的反应以及它们之间关系,是分子药理学与功能基因组学结合的产物。而基因多态性在药物治疗里也越来越被认为是导致药物疗效反应的个体差异的一个重要的机制[1]。通过研究药物代谢、转运及药物作用受体相关基因单核苷酸多态性(single nucleotide polymorphisms,SNP)对药物疗效的影响,从而一定程度上解决不同患者对同一药物的不同反应,使药物基因组学的主要研究对象又从相对药代学发展到药效学,对开发新药和指导临床合理用药有重要的临床意义[2]。
2型糖尿病是一种由遗传及环境因素共同决定的复杂性多基因疾病,其发生发展的分子遗传学机制尚不明确。它是由慢性高血糖引起,主要特征是胰岛素抵抗和β细胞功能障碍,现已成为全球公共卫生问题[3]。减少在肝、脂肪组织、骨骼肌内的胰岛素活性对2型糖尿病发病起着重要作用[4]。目前临床常用的降糖药包括:磺酰脲类促泌剂、格列奈类、噻唑烷二酮类及双胍类。
格列奈类降糖药是一类短效快速的非磺酰脲类促泌剂,这类药物能有效模拟生理胰岛素分泌,对β细胞具有保护作用,大规模临床研究已肯定了其在糖尿病疾病防治中的重要作用[5]。噻唑烷二酮类作为新一代的口服降糖药,能改善2型糖尿病患者的胰岛素敏感性,降低血糖和调节血脂异常[6]。过去的药物基因组学研究中从PPARG、ADIPOQ和CYP2CB来分析噻唑烷二酮类药物的SNPs,也表明了相关的变化会影响2型糖尿病的治疗效果[7−13]。罗格列酮(rosiglitazone)属噻唑烷二酮类药物,是临床常用的一类2型糖尿病降糖药。它可通过改善血脂和内皮功能紊乱、减少血管平滑肌增生及降低纤溶酶原激活物抑制剂1浓度等改善胰岛素抵抗。它对大小血管也有保护作用,同时减少机体对胰岛素的需要量、减轻甘油三酯、游离脂肪酸和葡萄糖对β细胞的糖毒性和脂毒性,对β细胞产生直接和间接的保护作用[14],也使转录因子参与调节体内的糖脂平衡[15]。
TCF2是由9个外显子构成,主要在胰腺、肝、肾等器官表达。TCF2的突变最早描述的是一种单基因糖尿病,即年轻的成年发病型糖尿病(maturity-onset diabetes of the young,MODY5)。除此之外,TCF2的变异也与一些其他疾病相关,如肾发育缺陷、肝功能障碍、胰腺萎缩、胰岛素分泌缺陷、生殖道畸形和其他类型的癌症[2]。本研究对新诊断的中国人2型糖尿病患者进行TCF2基因rs4430796基因型检测并分析其与瑞格列奈(repaglinide)及罗格列酮药物疗效之间的关系。
1 对象与方法
1.1 研究对象
按照糖尿病分型诊断标准,入选新诊断的2型糖尿病患者209例,所有患者均为初诊并接受任何降糖治疗且满足以下条件:年龄30~70岁;糖化血红蛋白(glycosylated hemoglobin A1c,HbA1c)≥6.5%;体质量指数(body mass index,BMI)≥18.5kg/m2;女性已绝经或绝育或已有效避孕。空腹血糖(fasting plasma glucose,FPG)>13mmol/L和(或)餐后2h血糖(2 hour postprandial blood glucose,2hPBG)>18mmol/L,血压>180/110mmHg(1mmHg=0.133kPa),及发生其他并发症或合并症者不列入本项研究。本研究经上海交通大学附属第六人民医院医学伦理委员会批准,所有受试者均签署了知情同意书。
1.2 分组及给药
所有受试者分为两组进行口服瑞格列奈和罗格列酮进行治疗,为期48周。瑞格列奈组起始剂量为0.5mg/d,罗格列酮组起始剂量为4mg/d。8周后血糖控制良好的患者仍用该剂量治疗直至48周。血糖控制不佳者[FPG>7mmol/L和(或)2hPBG>10mmol/L]瑞格列奈逐步增加剂量到1.0,1.5,2mg/d至48周,罗格列酮增加到8mg/d。若12周时HbA1c≥8%,或连续2次FPG>13mmol/L或2hPBG>18mmol/L,则患者退出本研究,2次检查时间间隔不超过6d。
1.3 观察指标
分别测量人体基本参数,包括身高、体质量、腰围、臀围、股围、收缩压和舒张压。计算BMI=体质量/身高2(kg/m2)、腰臀比=腰围/臀围。并抽取静脉血检测糖脂代谢指标。治疗前后的FPG和75g葡萄糖负荷后2hPBG(葡萄糖氧化酶−过氧化物酶法,上海生物制品研究所)以及HbA1c(高压液相色谱法,Bio-Rad variant Ⅱ,NGSP,美国),测量空腹胰岛素(fasting insulin,FINS)及胰岛素原(fasting proinsulin,FPINS);血脂谱:甘油三酯、总胆固醇、低密度脂蛋白胆固醇、高密度脂蛋白胆固醇(全自动生化分析仪7600-20,Hitachi,日本);胰岛素分泌功能检测:应用精氨酸刺激试验(静脉推注10%精氨酸溶液50ml,推注时间30~60s)分别测定0,2,4,6min时的血糖、胰岛素(INS0、INS2、INS4、INS6;放射免疫法,Linco Research,美国)及胰岛素原(PINS0、PINS2、PINS4、PINS6)。并采用稳态模式评估法公式,以FPG及FINS计算胰岛素抵抗指数(Homeostasis Assessment of Insulin Resistance,HOMA-IR)和胰岛β细胞功能指数(homeostasis assessment of β cell function,HOMA-β)。HOMA-IR=FPG×FINS/22.5;HOMA-β=20×FINS/(FPG-3.5),分别反映胰岛素敏感性及基础状态下的胰岛β细胞分泌功能。精氨酸刺激后的胰岛素分泌量Arg-INS=(INS2+INS4+INS6)/3-INS0,和胰岛素原分泌量Arg-PINS=(PINS2+PINS4+PINS6)/3-PINS0,反映胰岛素急性相分泌。
1.4 基因型检测
在外周血白细胞中用常规酚−氯仿法提取基因组DNA。通过基质辅助激光解吸电离飞行时间质谱技术(Sequenom,San Diego,CA,USA)检测rs4430796位点基因型。分析瑞格列奈和罗格列酮对不同基因型患者有无疗效差异。
1.5 统计学处理
数据资料均以均数±标准误表示。各临床变量的⊿值均为第8次随访(V8)的数值与第1次随访(V1)的数值之差。计算各基因型及等位基因频率,使用Hardy-Weinberg平衡检验确认研究样本的群体代表性。采用Shapiro-Wilk检验各变量的正态性,符合正态分布的变量采用t检验、方差或协方差分析进行统计,非正态分布的变量采用Wilcoxon秩和检验进行统计。采用多元线性回归模型(正态分布变量)或Kruskal-Wallis检验(非正态分布变量)进行各临床变量3组基因型之间的比较。采用多元线性回归模型分析时校正年龄、性别、药物剂量和基线BMI。所有数据资料均使用SAS统计软件进行分析处理。
2 结 果
本研究随访209例患者中,181例完成48周随访(罗格列酮92例,瑞格列奈89例)。其中AA、GA、GG基因型频率分别为50.2%(91/181)、39.2%(71/181)、10.6%(19/181)。A、G等位基因频率分别为69.9%和30.1%,符合Hardy-Weinberg平衡。
罗格列酮治疗组中,rs4430796各基因型患者在基线时的FINS及HOMA-β存在显著差异,分别P=0.0450和0.0213。经罗格列酮治疗24及48周之后,3种基因型患者的精氨酸刺激实验一相胰岛素分泌反应存在显著差异,分别P=0.0291和0.0167(表1)。
瑞格列奈治疗组中,各基因型患者在治疗之前各项指标均没有显著差异。经瑞格列奈治疗24周之后,不同基因型患者FINS及HOMA-IR存在显著差异,分别P=0.0248和0.0330(表2)。
3 讨 论
2型糖尿病是一种遗传和环境因素共同作用的多基因遗传性疾病。而胰岛素抵抗是2型糖尿病发病机制中的一个主要环节,从基因到葡萄糖代谢过程中任何步骤异常均可能引起胰岛素抵抗。
罗格列酮是调控脂肪细胞分化和脂代谢的过氧化物酶增殖激活受体(peroxisome proliferator-activated receptor γ,PPAR-γ)的激动剂,通过刺激PPAR-γ从而增加周围组织比如骨骼肌、肝等器官对胰岛素的敏感性[17],而过去有研究证明疾病初期治疗使用罗格列酮能减缓糖尿病患者血糖调控能力的下降趋势,降低糖尿病发病率,改善个人的空腹血糖受损或糖耐量受损[18,19]。瑞格列奈的一个重要的药物作用机制是改善胰岛素分泌一相从而改善2hPBG,抑制肝糖输出,减少胰岛素抵抗和减少游离脂肪酸[20−23]。本研究分析了罗格列酮和瑞格列奈对新诊断的2型糖尿病患者TCF2上同一基因位点的3种不同基因型AA、GA、GG的影响,从而对药效的影响。罗格列酮是通过提高β-连环蛋白(β-catenin)来激活TCF反应元件,从而影响血糖水平。瑞格列奈是一种短效快速的胰岛素促泌剂,主要通过刺激快速的胰岛素分泌来改善餐后血糖。之前的临床研究表明,经瑞格列奈治疗之后,患者的胰岛素分泌及HOMA-β和HOMA-IR都能够得到显著改善[24−26]。而研究证明TCF2基因上的多态性能够影响胰岛β细胞功能及胰岛素分泌[27],因此,可能会与药物相互作用,从而使不同基因型患者经瑞格列奈治疗之后的疗效不同。
另外,由于本研究样本量较小,可能造成失访,也可能无充足的证据证明是否有基因变异和胰岛素原转换的影响。其次,由于样本是新诊断的糖尿病患者,无法完全排除代偿机制在疾病早期的影响。再者由于是按照TCF2不同基因型进行分组比较,组内样本的一般情况如年龄、性别等情况也不能完全统一。所以TCF2基因变异与罗格列酮、瑞格列奈疗效的关系有待进一步探讨。

表1 rs4430796位点与罗格列酮治疗24及48周前后各临床变量变化的关联Table 1 The relationship between rs4430796 and the changes in clinical variables after rosiglitazone treatment for 24 weeks and 48 weeks
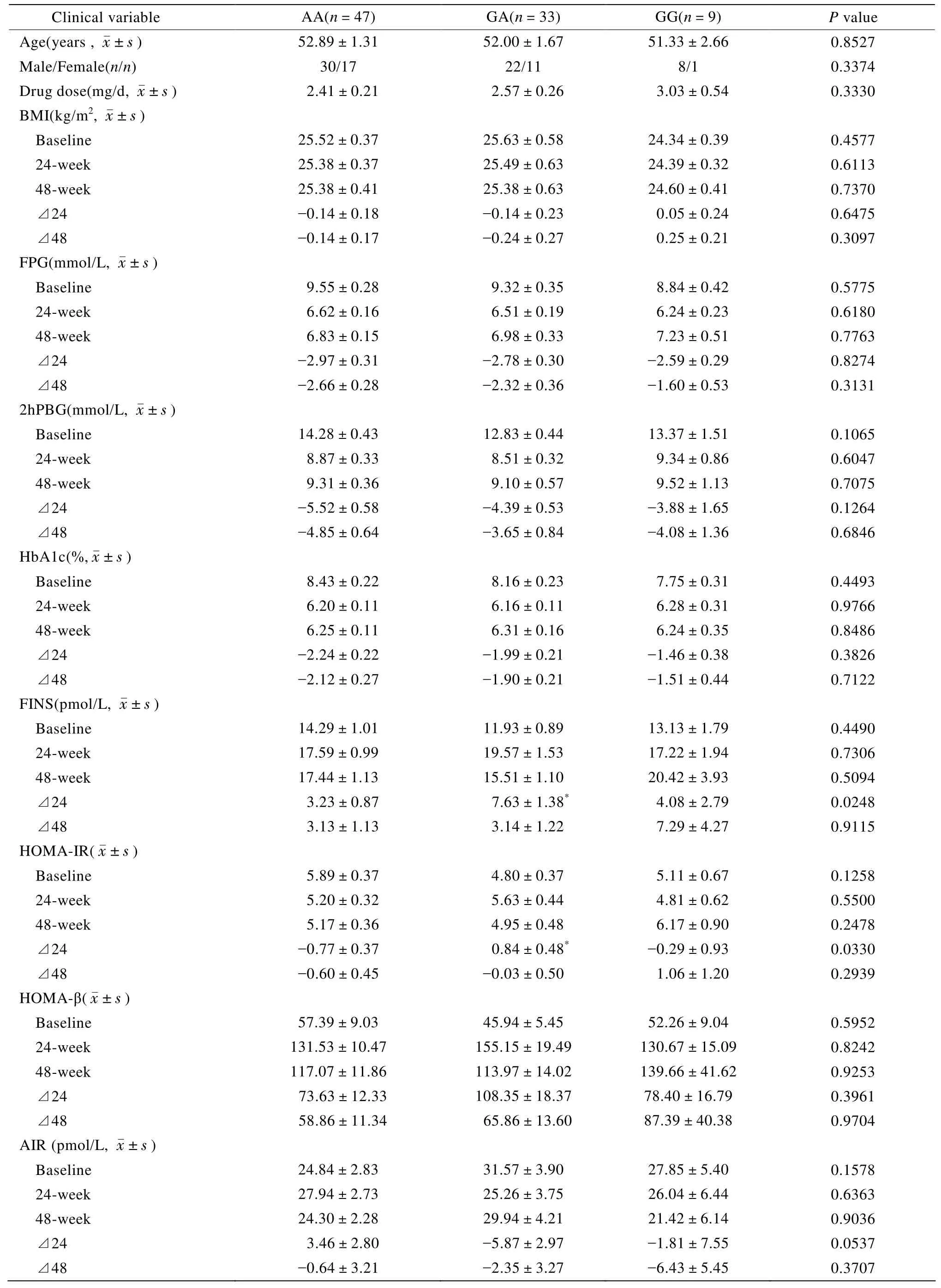
表2 rs4430796位点与瑞格列奈治疗24及48周前后各临床变量变化的关联Table 2 The relationship between rs4430796 and the changes in clinical variables after repaglinide treatment for 24 weeks and 48 weeks
综上,本研究提示,TCF2rs4430796位点与新诊断2型糖尿病患者口服瑞格列奈及罗格列酮的疗效相关。
【参考文献】
[1]Eichelbaum M, Ingelman-Sundberg M, Evans WE.Pharmacogenomics and individualized drug therapy[J]. Annu Rev Med, 2006, 57:119−137.
[2]Distefano JK, Watanabe RM. Pharmacogenetics of anti-diabetes drugs[J]. Pharmaceuticals (Basel), 2010, 3(8):2610−2646.
[3]Stumvoll M, Goldstein BJ, van Haeften TW. Type 2 diabetes:principles of pathogenesis and therapy[J]. Lancet, 2005,365(9467):1333−1346.
[4]DeFronzo RA. Pathogenesis of type 2 (non-insulin dependent) diabetes mellitus:a balanced overview[J].Diabetologia, 1992, 35(4):389−397.
[5]Zhang X, Qiao H, Zhao Y,et al. Association of single nucleotide polymorphisms in TCF2 with type 2 diabetes susceptibility in a Han Chinese population[J]. PLoS One,2012, 7(12):e52938.
[6]Day C. Thiazolidinediones:a new class of antidiabetic drugs[J]. Diabet Med, 1999, 16(3):179−192.
[7]Kirchheiner J, Thomas S, Bauer S,et al. Pharmacokinetics and pharmacodynamics of rosiglitazone in relation to CYP2C8 genotype[J]. Clin Pharmacol Ther, 2006, 80(6):657−667.
[8]Kang ES, Park SY, Kim HJ,et al. The influence of adiponectin gene polymorphism on the rosiglitazone response in patients with type 2 diabetes[J]. Diabetes Care,2005, 28(5):1139−1144.
[9]Snitker S, Watanabe RM, Ani I,et al. Changes in insulin sensitivity in response to troglitazone do not differ between subjects with and without the common, functional Pro12Ala peroxisome proliferator-activated receptor -γ2 gene variant:results from the Troglitazone in Prevention of Diabetes(TRIPOD) study[J]. Diabetes Care, 2004, 27(6):1365−1368.
[10]Bluher M, Lubben G, Paschke R. Analysis of the relationship between the Pro12Ala variant in the PPAR-gamma2 gene and the response rate to therapy with pioglitazone in patients with type 2 diabetes[J]. Diabetes Care, 2003, 26(3):825−831.
[11]Wolford JK, Yeatts KA, Dhanjal SK,et al. Sequence variation in PPARG may underlie differential response to troglitazone[J]. Diabetes, 2005, 54(11):3319−3325.
[12]Kang ES, Park SY, Kim HJ,et al. Effects of Pro12Ala polymorphism of peroxisome proliferator-activated receptor γ2 gene on rosig1itazone response in type 2 diabetes[J]. Clin Pharmacol Ther, 2005, 78(2):202−208.
[13]Florez JC, Jablonski KA, Sun MW,et al. Effects of the type 2 diabetes-associated PPARG P12A polymorphism on progression to diabetes and response to troglitazone[J]. J Clin Endocrinol Metab, 2007, 92(4):1502−1509.
[14]Wang J, Bao YQ, Hu C. Effects of ABCA1 variants on rosiglitazone monotherapy in newly diagnosed type 2 diabetes patients[J]. Acta Pharmacol Sin, 2008, 29(2):252−258.
[15]Rosen ED, Spiege1man BM. PPARγ:a nuc1ear regu1ator of metabolism, differentiation, and cell growth[J]. J Biol Chem,2001, 276(41):37731−37734.
[16]Hollingdal M, Sturis J, Gall MA,et al. Repaglinide treatment amplifies first-phase insulin secretion and high-frequency pulsatile insulin release in type 2 diabetes[J]. Diabet Med,2005, 22(10):1408−1413.
[17]Duan SZ, Usher MG, Foley EL 4th,et al. Sex dimorphic actions of rosiglitazone in generalised peroxisome proliferator-activated receptor-gamma (PPAR-gamma)-deficient mice[J]. Diabetologia, 2010, 53(7):1493−1505.
[18]Kahn SE, Haffner SM, Heise MA,et al. Glycemic durability of rosiglitazone, metformin or glyburide monotherapy[J]. N Engl J Med, 2006, 355(23):2427−2443.
[19]Gerstein HC, Yusuf S, Bosch J,et al. Effect of rosiglitazone on the frequency of diabetes in patients with impaired glucose tolerance or impaired fasting glucose:a randomised controlled trial[J]. Lancet, 2006, 368(9541):1096−1105.
[20]Hollingdal M, Sturis J, Gall MA,et al. Repaglinide treatment amplifies first-phase insulin secretion and high-frequency pulsatile insulin release in type 2 diabetes[J]. Diabet Med,2005, 22(10):1408−1413.
[21]Del Prato S, Tiengo A. The importance of first-phase insulin secretion:implications for the therapy of type 2 diabetes mellitus[J]. Diabetes Metab Res Rev, 2001, 17(3):164−174.
[22]Boden G, Shulman GI. Free fatty acids in obesity and type 2 diabetes:defining their role in the development of insulin resistance and beta-cell dysfunction[J]. Eur J Clin Invest,2002, 32 Supp1 3:14−23.
[23]Rizzo MR, Barbieri M, Grella R,et al. Repaglinide has more beneficial effect on cardiovascular risk factors than glimepiride:data from meal-test study[J]. Diabetes Metab,2005, 31(3 Pt 1):255−260.
[24]Ma J, Liu LY, Wu PH,et al. Comparison of metformin and repaglinide monotherapy in the treatment of new onset type 2 diabetes mellitus in China[J]. J Diabetes Res,2014, 2014:294017.
[25]Fang FS, Gong YP, Li CL,et al. Comparison of repaglinide and metformin monotherapy as an initial therapy in Chinese patients with newly diagnosed type 2 diabetes mellitus[J].Eur J Endocrinol, 2014, 170(6):901−908.
[26]Li J, Tian H, Li Q,et al. Improvement of insulin sensitivity and beta-cell function by nateglinide and repaglinide in type 2 diabetic patients—a randomized controlled double-blind and double-dummy multicentre clinical trial[J]. Diabetes Obes Metab, 2007, 9(4):558−565.
[27]Wang L, Coffinier C, Thomas MK,et al. Selective deletion of the Hnf1beta (MODY5) gene in beta-cells leads to altered gene expression and defective insulin release[J].Endocrinology, 2004, 145(8):3941−3949.
